
3012
.pdf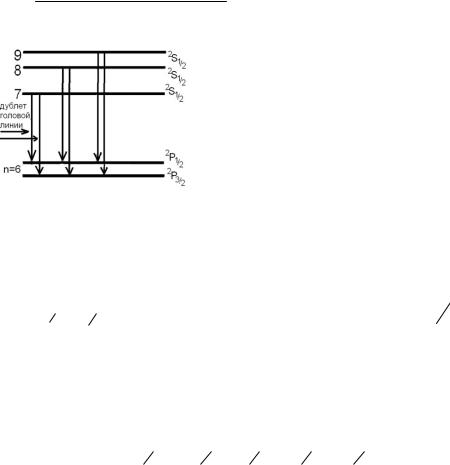
E 2 3 108 1,05 10 34 0,59 10 9 эВ 2,0 10 3эВ 2,0мэВ. (589 10 9)2 1,6 10 19
5.163. Спектральные линии резкой серии излучения атомов цезия (Cs) соответствуют
переходам валентного электрона n
2S1/2→62P3/2 и n 2S1/2→62P1/2, где
n=7,8,. Примерное расположение энергетических уровней, между которыми происходят эти
переходы, показано на рисунке.
Из рисунка видно, что частот-ное расстояние между компонентами дублета для всех линий резкой серии спектра цезия
одинаково |
|
|
|
|
|
и |
|
равно |
||
62 P3 |
62 P |
2 c( |
1 |
|
1 |
) |
2 c |
|
2 3 108 110,7 10 9 |
1,044 1014 1 |
|
|
|
|
|||||||
2 |
1 |
|
1 |
|
2 |
1 2 |
1358,8 1469,5 10 18 |
c |
||
2 |
|
|
||||||||
5.164. Двойная структура линий возникает и в спектре
водорода. Для возбужденного состояния атома водорода, харак-
теризуемом главным квантовым числом n=3, укажем следующие квантовые числа: l= 0, 1, 2 (s, p, d-состояния электрона); j=l+s ,|l-s|
2
(3T(i)). Отсюда 32S1 , 3 2P1 , 32P3 , 32D3 , 32D5 . Состояния
2 |
2 |
2 |
2 |
2 |
S, P, D и т.д. атома обозначаются по значению орбитального квантового числа 1 валентного электрона в атоме s, p, d и т.д.
5.165. При LS-взаимодействии электронов атома полный механический момент атома MJ определяется суммой результирующего азимутального Ml и результирующего спинового момента MS электронов, т.е. MJ ML MS . Модуль полного механического момента атома принимает значения
101

MJ 
 J(J 1) , где квантовое число J полного момента может
J(J 1) , где квантовое число J полного момента может
иметь одно из следующих значений: J=L+S, L+S-1, …, |L-S|.
При этом J будет целым, если S целое (т.е. при четном числе электронов) или полуцелым, если S полуцелое (при нечетном числе электронов).
Для заданных значений S и L для J будем иметь а)S=2, L=3: J=1, 2, 3, 4, 5;
б)S=3, L=3: J=0, 1, 2, 3, 4, 5, 6; в)S=5/2, L=2: J=1/2, 3/2, 5/2, 7/2, 9/2.
5.166. Уровни (термы) ряда L состояний атома принято обозначать символом LJ , где =2S+1 – мультиплетность (число
подуровней), J-квантовое число полного момента атома. Найдем значения механического момента атомов,
находящихся в состояниях 4P и 5D.
1) |
Состояние |
4P: |
4,L 1 S 3 |
. |
|
Квантовое |
||||||||||
|
|
|
|
|
|
|
|
2 |
1 |
,3 |
|
,5 |
|
|
||
число полного момента принимает значения J |
2 |
. Для |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
|
||
модуля полного момента атома по формуле |
M |
|
J(J 1) |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
получим: |
|
3 |
|
, |
|
, |
|
. |
|
|
|
|
|
|
|
|
M |
|
15 |
35 |
|
|
|
|
|
|
|
||||||
|
4 |
|
|
4 |
|
4 |
|
|
|
|
|
|
|
|
||
2) Состояние 5D: Здесь L=2, =5, S=( -1)/2=2; J=0, 1, 2, 3, 4. Значения механического момента атома: M=0;

 2,
2, 
 6,
6, 
 12,
12, 
 20 .
20 .
5.167. Найдем максимально возможные значения механического момента возбужденных атомов натрия
(1s22s22p64s) и бериллия (1s22p3d).
а) Атом натрия. Механический момент иона натрия равен нулю. Следовательно, механический момент атома определяется моментом валентного электрона, спин которого s=1/2 и для n=4 с одним из значений азимутального квантового числа l=0, 1, 2, 3. Максимальное значение спин-орбитального квантового числа валентного электрона, а значит, и атома в целом, равно
102
Jmax=jmax=lmax+s=3+1/2 =7/2. Здесь Lmax=lmax=3, мультиплетность
2S 1 2 . Отсюда следует, что заданому состоянию атома натрия с М=Мmax соответствует терм 2F7/2. Максимальное значение полного механического момента атома натрия в
состоянии 2F7/2 равно M 
 Jmax (Jmax 1)
Jmax (Jmax 1) 
 634 .
634 .
б) Атом бериллия. Для электронов К-оболочки механический момент равен нулю. Механический момент атома в заданном состоянии определяется орбитальными и спиновыми моментами 2p и 3d электронами. В модели LS-связи момент атома MJ=MS+ML. Здесь Smax=2s=1, Lmax=( l 1 )+( l 2 )=3; Jmax=Lmax+Smax= =3+1=4. Мультиплетность 2S 1 3 . Итак, речь идет о состоянии 3D4. Наибольшее значение механического
момента атома равно Mmax 
 Jmax (Jmax 1)
Jmax (Jmax 1) 
 4(4 1) 2
4(4 1) 2 
 5. 5.168. Для F-состояния атомной системы L=3. Положим S=1. Тогда возможные значения квантового числа J полного
5. 5.168. Для F-состояния атомной системы L=3. Положим S=1. Тогда возможные значения квантового числа J полного
механического момента системы будут таковы: 4, 3, 2, 1, 0 (всего пять). При этом спиновый механический момент
MS 
 S(S 1)
S(S 1) 
 2 .
2 .
Для D-состояния L=2. В этом случае логично взять S=2 и получить те же пять значений числа J: 4, 3, 2, 1, 0. Спиновый
механический момент системы Ms 
 2(2 1)
2(2 1) 
 6 .
6 .
Из сравнения значений MS для F и D состояний видим, что
MS(D)>MS(F).
5.169. По |
условию |
мультиплетность |
состояния |
атома |
||||
2S 1 3 . Отсюда спиновое |
квантовое |
число атома |
S=1. |
|||||
Поскольку MJ |
|
|
|
|
|
, квантовое число полного |
||
|
J(J 1) |
20 |
||||||
момента атома J=4. При этом азимутальное квантовое число атома L=J-S=4-1=3.
5.170. Наиболее распространенным видом связи в многоэлектронных атомах является LS-связь, так называемая нормальная связь. В случае нормальной связи состояние атома характеризуют соответствующим термом, обозначаемым
103
символом LJ , где при S L 2S 1и при |
момента |
|
, J |
||
– квантовое2 2 |
число полного механического |
атома |
|||
≥ |
= 2 +1 |
|
|||
M j J(J 1) , принимающее значения L=S, |
L+S-1, |
L+S-2, |
|||
…,|L-S|; под L понимается одна из букв S, P, D, F и т.д. в зависимости от значения L: 1, 2, … .
Энергетическое состояние атома определяется значениями квантовых чисел L, S и J. Энергетический уровень с определенными значениями L и S расщепляется на подуровней с различными J. Это так называемое мультиплетное расщепление определяет тонкую структуру уровней энергии. Каждый из подуровней остается 2J 1 - кратно вырожденным по
направлениям полного момента М (точнее по значениям его |
|||
проекции MZ на некоторую произвольную |
ось (MZ |
mJ , где |
|
mJ 0, 1,..., J ). Величину |
g=2J+1 назовём |
кратностью |
|
вырождения подуровня, определяемого значением J. |
|
||
Теперь получим решение предложенной задачи. Нам |
|||
известны мультиплетность |
некоторого |
терма LJ состояния |
|
атома и кратность его вырождения g. Требуется установить вид соответствующего терма. По формулам мультиплетности2S 1 и кратности вырождения g=2J+1 для заданных значений 5и g=7 находим S=2, J=3. Значениям J=3 и S=2 при L>S отвечает квантовое число полного орбитального момента, равное L=5 (J=L-S, 3=L-2). Итак, соответствующий терм состояния атома получает вид 5Н3.
|
|
5.171. Даны термы типа D2, P3 |
, |
F1. Найти возможные |
||||||
мультиплетности этих термов. |
|
|
|
2 |
|
|||||
|
|
|
|
|
||||||
|
|
а) Терм D . Здесь L=2, J=2. Поскольку J целое, значения |
||||||||
2 |
|
|
|
|
|
|
||||
S также целые. Значения S |
найдем |
из |
условий J L S и |
|||||||
J |
|
L S |
|
, т.е. 2 2 S и 2 |
|
2 S |
|
. Из первого условия следует: |
||
|
|
|
|
|||||||
S 0. Из второго: при S L 2 S 0; при S L 2 получим
J L S , т.е. S J L 4.
104

Итак, имеем S=0, 1, 2, 3, 4 и мультиплетность терма
1, 3, 5, 7, 9. Подуровень с J=2 и S=0 не расщепляется. |
|
||||||||||||||||||||||
|
|
б) |
Терм |
P |
|
|
. В данном случае |
L=1, J=3/2. Из условий |
|||||||||||||||
|
|
|
|
|
|
|
|
3 |
2 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
J L S |
|
и |
J |
|
L S |
|
|
в данном случае получим: |
1 S и |
|||||||||||||
|
|
||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
5 |
|
2 |
|
||
|
S 1, |
|
т.е. S |
и S |
|
|
|||||||||||||||||
|
|
. следовательно, число S |
пробегает |
||||||||||||||||||||
2 |
2 |
|
|||||||||||||||||||||
|
|
1 |
|
3 |
|
|
5 |
|
|
|
|
|
|
2 |
|
|
|
|
|||||
значения |
, |
,. |
. |
|
При |
этом мультиплетность νсоответственно |
|||||||||||||||||
|
2 |
|
|
||||||||||||||||||||
|
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
имеет значения 2, 4, 6. |
|
|
|
|
|
|
|||||||||||||||||
|
|
в) |
|
Терм |
|
F . Здесь L=3, J=1, |
S- целое. Из |
условий, |
|||||||||||||||
1
аналогичным в пунктах а) и б), получаем S ≥ - 2, а поскольку S
неотрицательное число, то S ≥ 0; еще S≤4.
Итак, имеем последовательность значений S и ѵ: S=0, 1, 2, 3, 4; ѵ=1, 3, 5, 7, 9.
5.172. Полный механический момент внутренних заполненных оболочек атома равен нулю. Следовательно, полный момент данного атома определяется суммарным моментом внешних s, p и d электронов. Поскольку полный момент MJ должен иметь наибольшее значение, орбитальный полный момент L и спиновый полный момент S также должны иметь максимальные значения. Это значит, что орбитальные моменты всех трех электронов имеют одно направление. То же можно сказать относительно спиновых моментов электронов. Исходя из этих соображений можем написать (быть может приближенно): = ( ) + ( )+ ( ) =
ħ 0+ 1(1+1) + 2(2+1) = ħ(√2+ √6);
так как = ħ ( +1), то имеем равенство √2+ √6 =
105
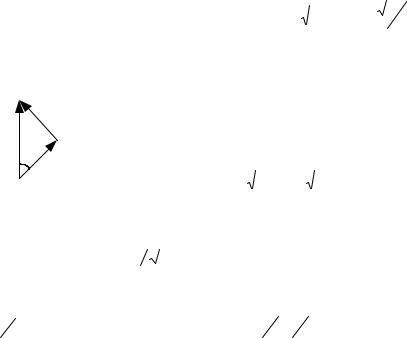
= |
( |
+1). |
Отсюда |
получим |
L 3,38 . |
|
Поскольку |
квантовое |
|||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||
число L – целое, принимает L=3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
Спиновый момент электрона |
MS |
|
|
|
|
|
( |
3 |
|
) . |
||||||||||||||||
|
|
|
|
|
s(s 1) |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||
Спиновый |
|
момент |
рассматриваемых |
|
электронов |
= 3 |
= |
||||||||||||||||||||||
|
|
|
. Отсюда находим, что S=2. |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
(3√3/2)ħ = ħ |
( |
|
+1) |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
ML |
|
|
|
Теперь обратимся к векторной диаграмме |
|||||||||||||||||||||
MJ |
моментов (см. рисунок). С помощью рисунка по |
||||||||||||||||||||||||||||
|
|
|
теореме |
косинусов |
можем |
|
|
написать: |
|
Cos |
|||||||||||||||||||
|
|
|
|
M |
S |
|
MJ2 |
MS2 ML2 |
|
J(J 1) S(S 1) L(L 1) |
(на |
||||||||||||||||||
|
|
|
|
|
2MS MJ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
2 S(S 1) |
|
J(J 1) |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
2 |
|
сократили). |
|
Здесь |
J Jmax L S 5 . |
|
Подставляя |
в |
|||||||||||||||||||||
выражение для Cos найденные значения квантовых |
чисел L, S |
||||||||||||||||||||||||||||
и J, получим: Cos |
|
2 |
|
|
0.89 , а затем 27 . |
|
|
|
|
|
|
||||||||||||||||||
|
5 |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
5.173. Сперва для рассматриваемой системы найдем |
||||||||||||||||||||||||||
возможные значения квантовых чисел S и L. Спин электрона |
|||||||||||||||||||||||||||||
S 1 |
2 , |
|
двух |
|
электронов |
S s s 1 |
2 1 |
2 |
|
, т.е. |
S=0;1. |
||||||||||||||||||
Орбитальные квантовые числа для p- и d-электрона
соответственно l1 |
|
1, |
l2 2 .. Для двух электронов |
L l1 l2 , |
||
l1 l2 1,..., |
|
l1 l2 |
|
: L=1, 2, 3. |
|
|
|
|
|
||||
Теперь определим возможные значения квантового числа J полного механического момента системы и соответствующие термы состояний системы, учитывая закон сложения квантовых
чисел L и S: . |
| |
| |
1) S=0, L=1:= +J=1,; |
+мультиплетность−1;…, + |
. 1 (согласно закону |
=2 +1); терм 1P1.
2)S=0, L=2: J=2, ѵ =1, терм 1D2.
3)S=0, L=3: J=3, ѵ =1, терм 1F3.
106
4)S=1, L=1: J=0, 1, 2: ѵ =3. Термы: 3P0, 3P1, 3P2.
5)S=1, L=2: J=1, 2, 3; ѵ =3. Термы: 3D1, 3D2, 3D3.
6)S=1, L=3: J=2, 3, 4; ѵ =3. Термы: 3F2, 3F3, 3F4.
Систематизируя найденные термы по рядам состояний,
напишем: 1P1, 3P0, 1, 2, 1D2, 3D1, 2, 3, 1F3, 3F2, 3, 4.
5.174. Согласно символическому обозначению терма 2P3/2 квантовые числа, характеризующие состояние атома имеют
следующие значения: La |
=1, Sa =1/2 ( J J S, |
L S 1, … , |
||||||||
|
L S |
|
: |
3 |
1 Sa |
Sa |
|
1 |
, удовлетворяется). |
|
|
|
|
||||||||
|
|
|
|
|||||||
|
|
|
2 |
|
|
|
2 |
|
|
|
Для d-электрона: l=2, s=1/2.
Для системы атом - d-электрон:
S SaT S, SaT S S 1;0.
L LaT L,LaT L 1,..., LaT L L 1,2,3.
Итак, для рассматриваемой системы имеем: L=1, 2, 3; S=0, 1. Подобный случай описан в пунктах 1 – 6 предыдущей задачи
4.173.
5.175. При переходах сложных атомов из одного состояния в другое при наличии LS-связи действуют правила отбора: L 0, 1; S 0; J 0, 1 (*).
В остальных случаях переходы запрещены, в том числе и переход (J 0) (J 0).
Представим терм состояния системы νLJ точкой (L, S, J) в пространстве квантовых чисел L, S, J. При таком соглашении совокупность заданных переходов получает вид:
1)(2, 1/2, 3/2) (1, ½, ½) для 2D3/2
(1, ½, ½) для 2D3/2 2P1/2;
2P1/2;
2)(1, 1, 1)  (0, ½, ½) для 3P1
(0, ½, ½) для 3P1  2S1/2;
2S1/2;
3)(3, 1, 3)  (1, 1, 2) для 3F3
(1, 1, 2) для 3F3 3P2;
3P2;
107

4) (3, 3/2, 7/2) (2, 3/2, 5/2) для 4F7/2 4D5/2.
(2, 3/2, 5/2) для 4F7/2 4D5/2.
Здесь принято во внимание, что v=2S+1. Для переходов 1 – 4 соответственно имеем:
1)L 1, S 0, J 1,
2)L 2, S 0, J 1,
3)L 2, S 0, J 1,
4)L 1, S 0, J 1.
Учитывая условия (*), скажем, что второй и третий переходы запрещены.
5.176. Электронная структура возбужденного атома лития (3Li) имеет вид 1s23d. Для электронов К-оболочки атома орбитальное и спиновое квантовое числа равны нулю. Следовательно, состояние атома будет определяться квантовыми числами l и s внешнего d-электрона, для которого l=2 и s=1/2. Квантовое число j полного механического момента принимает
одно из двух значений: j 2 1 |
5 |
и j 2 1 |
2 |
3 |
2 |
(по |
2 |
2 |
|
|
|
формуле: j=l+s, |l+s|). Поскольку речь идет об атоме, квантовые
числа l, s и j |
формально переобозначим через большие буквы |
L, |
||||
S и J. Итак, имеем: L=2, S=1/2, и J=3/2, 5/2. Возможные термы |
||||||
состояний |
такие: |
2D3/2, |
2D5/2. Здесь 2S 1 2 |
- |
||
мультиплетность каждого из термов по S. Кратность вырождения |
||||||
по J первого терма |
равна |
2J 1 2* |
3 |
1 4 , второго терма |
||
|
||||||
|
|
|
2 |
|
|
|
равна 6. Так J-состояние учитывает направление спина, то суммарная кратность вырождения 3D-состояния атома лития g=4+6=10. Величина g означает существование числа возможных направлений вектора (точнее проекций на заданное направле-
ние), отвечающих одному и тому же значению энергии системы.
108
5.177. Заданы состояния: 2Р, 3D, 4F. Укажем квантовые числа L, S, J и кратность вырождения g этих состояний, учитывая формулы квантования: J=L+S (по условию J=Jmax), ν=2S+1, а также, что g=2J+1.
1)Состояние системы 2Р: L=1, S=1/2, J=3/2, g=4.
2)Состояние 3D: L=2, S=1, J=3, g=4.
3)Состояние 4F: L=3, S=3/2, J=9/2, g=10.
Итак, в той же последовательности имеем: g=4, 7, 10.
5.178. Из формулы для кратности вырождения системы g=2J+1 для g=7 имеем J=3. Здесь J – целое, и следовательно, S –целое (L – всегда целое). Из последовательности значений квантового числа полного механического момента J=L+S, L+S-1, … , |L-S| и условия L=3S подходящим значением J является L+S-1. Отсюда следует, что 4S-1=3, т.е. S=1. При этом L=3 (соответствует символу F). Мультиплетность ѵ=2S+1|S=1=3. Итак, символ рассматриваемого терма имеет вид 3F3.
5.179. Согласно принципу Паули в K, L и M оболочках некоторого атома при полном их заполнении находится 2(12+22+32)=28 электронов. Максимально возможное число электронов в l-подоболочке равно 2(2l+1): в S-подоболочке 2 электрона, в р-подоболочке – 6. По условию 4S подоболочка заполнена полностью, 4р – наполовину. Итак, электрически нейтральный атом имеет 28+2+3=33 электрона и, следовательно, является атомом мышьяка (As).
5.180. В р-электронной подоболочке атома (l=1, n≥2) согласно принципу Пауля реализуетсяя шесть различных квантовых состояний (ячеек). Эти состояния для заданных n и l отличаются значениями квантовых чисел ml и ms=±1/2. Для р- подоболочки ml=0, ±1 (см. таблицу np-состояний).
109
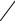
ml |
-1 |
|
0 |
|
1 |
|
ms |
±1/2 |
|
±1/2 |
|
±1/2 |
|
|
Распределение |
электронов по |
состояниям в подоболочке, |
|||
частичном или полном заполнении, осуществляется так, чтобы энергия электронов имела наименьшее значение. Минимальный уровень зависит от числа электронов в подоболочке (электронной конфигурации). Каждой из электронных конфигураций np2, np3, … , np6 будет соответствоватьсвойминимум энергии.
Полагая предыдущую оболочку n-1 и подоболочку ns замкнутыми, скажем, что квантовые числа L, S и J атома в целом будут определяться квантовыми числами электронной конфигурации внешней р-подоболочки. В предложенной задаче для конфигурации Р и Р4 требуется указать квантовые числа S, L, J (термы) основных состояний атома, соответствующих наименьшим значениям энергии. При решении задачи будем
исходить из правил Хунда. |
|
|
|
||||||||||
|
а) |
Конфигурация p3 |
Из |
таблицы видно, |
что S=Smax= |
||||||||
Si |
|
1 |
|
1 |
|
|
1 |
3 |
. При этом |
орбитальное квантовое число |
|||
1 |
2 |
|
2 |
|
2 |
|
2 |
|
|
|
|||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
L mli |
, |
|
определяемое |
суммой квантовых |
чисел ml, |
||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
соответственно выборке Si, равно L=-1+0+1=0. Поскольку р- подоболочка заполнена не более, чем наполовину, квантовое число полного механического момента, согласно второму правилу Хунда, J=|L-S|=3/2. Мультиплетность ѵ=2S+1=2∙3/2+1=4.
Итак, терм основного состояния в данном случае имеет вид 4S3/2. б) Конфигурация р4. Здесь выборка из четырех ячеек. Из таблицы видно, что Smax=3∙1/2-1/2=1. Причем выборка ячеек должна быть такова, чтобы L=Lmax. Изтойже таблицы видно, что Lmax=1 (это следует из соответствующих состояний (ml, ms): (-1, ½),(0; ½),(1, ½), (1,-½). Подоболочка р заполнена более, чем наполовину,
110
