
- •Часть 3. Биополимеры и их структурные компоненты
- •Омск – 2016
- •Предисловие
- •1. Тематические разделы дисциплины «химия биополимеров»
- •1.1 Углеводы. Моносахариды и их производные
- •Биологические функции углеводов
- •Моносахариды
- •I. По виду функциональной группы моносахариды делятся на:
- •II. По числу атомов углерода в цепи различают:
- •Биологически важные альдогексозы Глюкоза (виноградный сахар):
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.2 Сложные углеводы. Дисахариды. Олигосахариды. Полисахариды.
- •По строению и химическим связям дисахариды делят на 2 типа:
- •Таутомерия мальтозы:
- •Химические свойства восстанавливающих дисахаридов.
- •Химические свойства невосстанавливающих дисахаридов
- •Мукополисахариды
- •Контрольные вопросы
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.3 Рубежная контрольная работа Тема: Углеводы – простые и сложные Контрольные вопросы
- •Демонстрационный вариант билета
- •Критерии оценивания контрольной работы:
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •Строение -аминокислот
- •Классификация -аминокислот по составу бокового радикала:
- •Моноаминомонокарбоновые α-аминокислоты (нейтральные):
- •VI. Ароматические -аминокислоты
- •VII. Гетероциклические -аминокислоты
- •Стереоизомерия аминокислот
- •Физические свойства аминокислот.
- •Кислотно-основные свойства -аминокислот.
- •Химические свойства аминокислот.
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.5 Пептиды и белки Пептиды, реакция образования, строение
- •Классификация пептидов и белков
- •I. В зависимости от формы молекул белки подразделяются на фибриллярные и глобулярные.
- •Изоэлектрическая точка белка (pI)
- •Химические свойства пептидов и белков
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.6 Биологически важные азотсодержащие гетероциклические соединения
- •Классификация гетероциклических соединений:
- •Пятичленные гетероциклы с одним гетероатомом:
- •Пятичленные гетероциклы с двумя гетероатомами:
- •Шестичленные гетероциклы с одним гетероатомом:
- •Шестичленные гетероциклы с двумя гетероатомами:
- •Конденсированные системы гетероциклов
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.7 Нуклеиновые кислоты
- •Состав нуклеозидов и нуклеотидов днк и рнк
- •Нуклеозиды рнк
- •Нуклеозиды днк
- •Названия важнейших нуклеотидов, входящих в состав нуклеиновых кислот
- •С троение атф
- •Структура нуклеиновых кислот
- •Между гуанином и цитозином – три водородные связи:
- •Типовые задания
- •2) Гуанозин.
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.8 Липиды Характеристика и классификация липидов:
- •Жиры и масла (триацилглицерины) – это сложные эфиры глицерина и высших жирных кислот, в которых все три гидроксильные группы глицерина ацилированы.
- •Биологическая роль и основные функции жиров
- •Химические свойства триацилглицеринов:
- •3. Присоединение иода:
- •Фосфолипиды, строение, биологическая роль, химические свойства:
- •Классификация глицерофосфолипидов
- •Химические свойства:
- •2) Щелочной гидролиз:
- •Гликолипиды, строение и биологическая роль:
- •1. Цереброзиды. Они включают остаток церамида и моносахарида (d-глюкоза, d-галактоза), которые соединены -гликозидной связью.
- •Галактоцереброзид Галактоцереброзиды входят в состав оболочек нервных клеток.
- •2. Ганглиозиды. Они включают остаток церамида и олигосахарида (например, лактозы или мальтозы), соединённых -гликозидной связью.
- •Жидкостно-мозаичная модель мембраны Зингера-Николсона:
- •Контрольные вопросы
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •2. Инструкция по охране труда и пожарной безопасности для обучающихся при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •32.05.01 Медико-профилактическое дело
- •Демонстрационный вариант зачетной работы по дисциплине «Химия биополимеров»
- •Демонстрационный вариант зачетного билета
- •Заключение
- •Глоссарий
- •Электронные образовательные ресурсы
Типовые задания
Задание 1. Пиридиновое ядро входит в состав витамина PP. Докажите, что пиридин является ароматическим соединением.
Решение. Молекула пиридина отвечает критериям ароматичности, сформулированным для ароматических углеводородов, а именно имеет плоский σ-скелет, сопряженную замкнутую электронную систему, охватывающую все атомы цикла и содержащую шесть π-электронов, удовлетворяя формуле Хюккеля (4n+2=6; n=1).
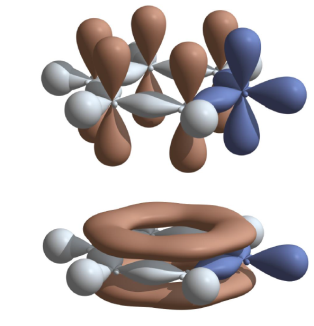
Задание 2. Пуриновое ядро входит в состав азотистых оснований. Докажите, что пиридин является ароматическим соединением.
Р ешение.
Пурин
является ароматическим соединением,
образуя единое электронное облако из
10 π-электронов,
что удовлетворяет правилу Хюккеля при
n
= 2.
ешение.
Пурин
является ароматическим соединением,
образуя единое электронное облако из
10 π-электронов,
что удовлетворяет правилу Хюккеля при
n
= 2.
Задание 3. В живом организме имидазол (радикал α-аминокислоты гистидина) выполняет роль катализатора ряда ферментативных реакций, выступая донором – акцептором протонов. Какие особенности строения имидазола обуславливают его кислотно-основные свойства?
Решение. Гистидин представляет собой замещенную α-аминопропионовую кислоту, содержащую гетероциклический радикал – имидазол у β-углеродного атома.

Имидазол является ароматическим соединением (4n+2=6, n=1). С двумя двойными связями цикла вступает в сопряжение неподеленная пара электронов пиррольного атома азота. Пиридиновый атом азота участвует в образовании общей сопряженной системы одним р-электроном.

Наличие гетероатомов в молекуле имидазола приводит к смещению электронной плотности сопряженной системы к более электроотрицательным атомам азота. С другой стороны, неодинаковое участие атомов азота в образовании сопряженного π-электронного облака обусловливает индивидуальные особенности пиридинового и пиррольного атомов азота.
Пиридиновый атом азота, имея неподеленную пару электронов, обладает основными свойствами. Имидазол образует соли как с сильными минеральными кислотами, так и с органическими кислотами средней силы, например с салициловой кислотой.

Наличие атома водорода у пиррольного атома азота приводит к проявлению имидазолом кислотных свойств, как и у пиррола. Однако имидазол является более сильной кислотой, чем пиррол. Причина повышения кислотности заключается во влиянии пиридинового атома азота, который, действуя как электроноакцепторный заместитель, стабилизирует образующийся анион. Имидазол способен образовывать соли с щелочными и щелочноземельными металлами.

Амфотерный характер имидазола обусловливает его участие в реакциях в виде аниона или катиона в зависимости от условий реакции. В нейтральной среде молекулы имидазола связаны между собой межмолекулярными водородными связями. В такую межмолекулярную ассоциацию входит до 20 молекул имидазола. Этим объясняется высокая температура кипения имидазола (256ОС).

Таким образом, кислотно-основные свойства имидазола связаны с наличием в гетероцикле двух атомов азота. Пиридиновый атом азота обусловливает основные свойства, пиррольный – кислотные.
