
- •Часть 3. Биополимеры и их структурные компоненты
- •Омск – 2016
- •Предисловие
- •1. Тематические разделы дисциплины «химия биополимеров»
- •1.1 Углеводы. Моносахариды и их производные
- •Биологические функции углеводов
- •Моносахариды
- •I. По виду функциональной группы моносахариды делятся на:
- •II. По числу атомов углерода в цепи различают:
- •Биологически важные альдогексозы Глюкоза (виноградный сахар):
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.2 Сложные углеводы. Дисахариды. Олигосахариды. Полисахариды.
- •По строению и химическим связям дисахариды делят на 2 типа:
- •Таутомерия мальтозы:
- •Химические свойства восстанавливающих дисахаридов.
- •Химические свойства невосстанавливающих дисахаридов
- •Мукополисахариды
- •Контрольные вопросы
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.3 Рубежная контрольная работа Тема: Углеводы – простые и сложные Контрольные вопросы
- •Демонстрационный вариант билета
- •Критерии оценивания контрольной работы:
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •Строение -аминокислот
- •Классификация -аминокислот по составу бокового радикала:
- •Моноаминомонокарбоновые α-аминокислоты (нейтральные):
- •VI. Ароматические -аминокислоты
- •VII. Гетероциклические -аминокислоты
- •Стереоизомерия аминокислот
- •Физические свойства аминокислот.
- •Кислотно-основные свойства -аминокислот.
- •Химические свойства аминокислот.
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.5 Пептиды и белки Пептиды, реакция образования, строение
- •Классификация пептидов и белков
- •I. В зависимости от формы молекул белки подразделяются на фибриллярные и глобулярные.
- •Изоэлектрическая точка белка (pI)
- •Химические свойства пептидов и белков
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.6 Биологически важные азотсодержащие гетероциклические соединения
- •Классификация гетероциклических соединений:
- •Пятичленные гетероциклы с одним гетероатомом:
- •Пятичленные гетероциклы с двумя гетероатомами:
- •Шестичленные гетероциклы с одним гетероатомом:
- •Шестичленные гетероциклы с двумя гетероатомами:
- •Конденсированные системы гетероциклов
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.7 Нуклеиновые кислоты
- •Состав нуклеозидов и нуклеотидов днк и рнк
- •Нуклеозиды рнк
- •Нуклеозиды днк
- •Названия важнейших нуклеотидов, входящих в состав нуклеиновых кислот
- •С троение атф
- •Структура нуклеиновых кислот
- •Между гуанином и цитозином – три водородные связи:
- •Типовые задания
- •2) Гуанозин.
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.8 Липиды Характеристика и классификация липидов:
- •Жиры и масла (триацилглицерины) – это сложные эфиры глицерина и высших жирных кислот, в которых все три гидроксильные группы глицерина ацилированы.
- •Биологическая роль и основные функции жиров
- •Химические свойства триацилглицеринов:
- •3. Присоединение иода:
- •Фосфолипиды, строение, биологическая роль, химические свойства:
- •Классификация глицерофосфолипидов
- •Химические свойства:
- •2) Щелочной гидролиз:
- •Гликолипиды, строение и биологическая роль:
- •1. Цереброзиды. Они включают остаток церамида и моносахарида (d-глюкоза, d-галактоза), которые соединены -гликозидной связью.
- •Галактоцереброзид Галактоцереброзиды входят в состав оболочек нервных клеток.
- •2. Ганглиозиды. Они включают остаток церамида и олигосахарида (например, лактозы или мальтозы), соединённых -гликозидной связью.
- •Жидкостно-мозаичная модель мембраны Зингера-Николсона:
- •Контрольные вопросы
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •2. Инструкция по охране труда и пожарной безопасности для обучающихся при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •32.05.01 Медико-профилактическое дело
- •Демонстрационный вариант зачетной работы по дисциплине «Химия биополимеров»
- •Демонстрационный вариант зачетного билета
- •Заключение
- •Глоссарий
- •Электронные образовательные ресурсы
Изоэлектрическая точка белка (pI)
Молекула белка имеет электрический заряд. В сильно кислой среде белок заряжается положительно, в сильно щелочной – отрицательно. В нейтральной среде заряд белковой молекулы определяется соотношением количества свободных групп –COOH и –NH2 и степенью их диссоциации. Чем больше карбоксильных групп (–COOH), тем выше отрицательный заряд, и белок будет проявлять свойства слабой кислоты. У кислых пептидов и белков pI ˂ 7. Преобладание аминогрупп (-NH2) сообщает белку основные свойства и положительный заряд. У основных пептидов и белков pI ˃ 7.
Химические свойства пептидов и белков
I. Аминокислоты, пептиды и белки являются амфотерными соединениями, содержащими и кислотные группы (-COOH) и оснóвные группы (-NH2).
II. По месту пептидных связей молекулы белков гидролизуется in vivo с участием ферментов-пептидаз.
Среди пептидаз выделяют:
- эндопептидазы, расщепляющие связи внутри макромолекулы;
- экзопептидазы, отщепляющие N- или C-концевую АК.
В организме белки расщепляются полностью, т.к. для жизнедеятельности необходимы только свободные α-аминокислоты.
Гидролиз in vitro происходит в сильнокислой или сильнощелочной среде и используется для расшифровки состава белков. В настоящее время расшифрован состав 1500 белков, в том числе ферментов и гормонов.
Уровни структурной организации белковой молекулы:
Первичная структура – последовательность аминокислотных остатков в молекуле белка или пептида:
NH2-Tyr-Pro-Lys-Gly-Phe-Tyr-Lys-COOH.
Первичная структура определяет уровни структурной организации белка.
Вторичная структура – локальные высокоупорядоченные конформации белковой цепи – спирали и складчатые слои.
В 1950 г. Л. Полинг и Р. Кори показали, что наиболее выгодной конформацией полипептидной цепи является правозакрученная -спираль.
Основной вклад в закрепление этой конформации цепи вносят водородные связи, формирующиеся между параллельными участками пептидных групп.
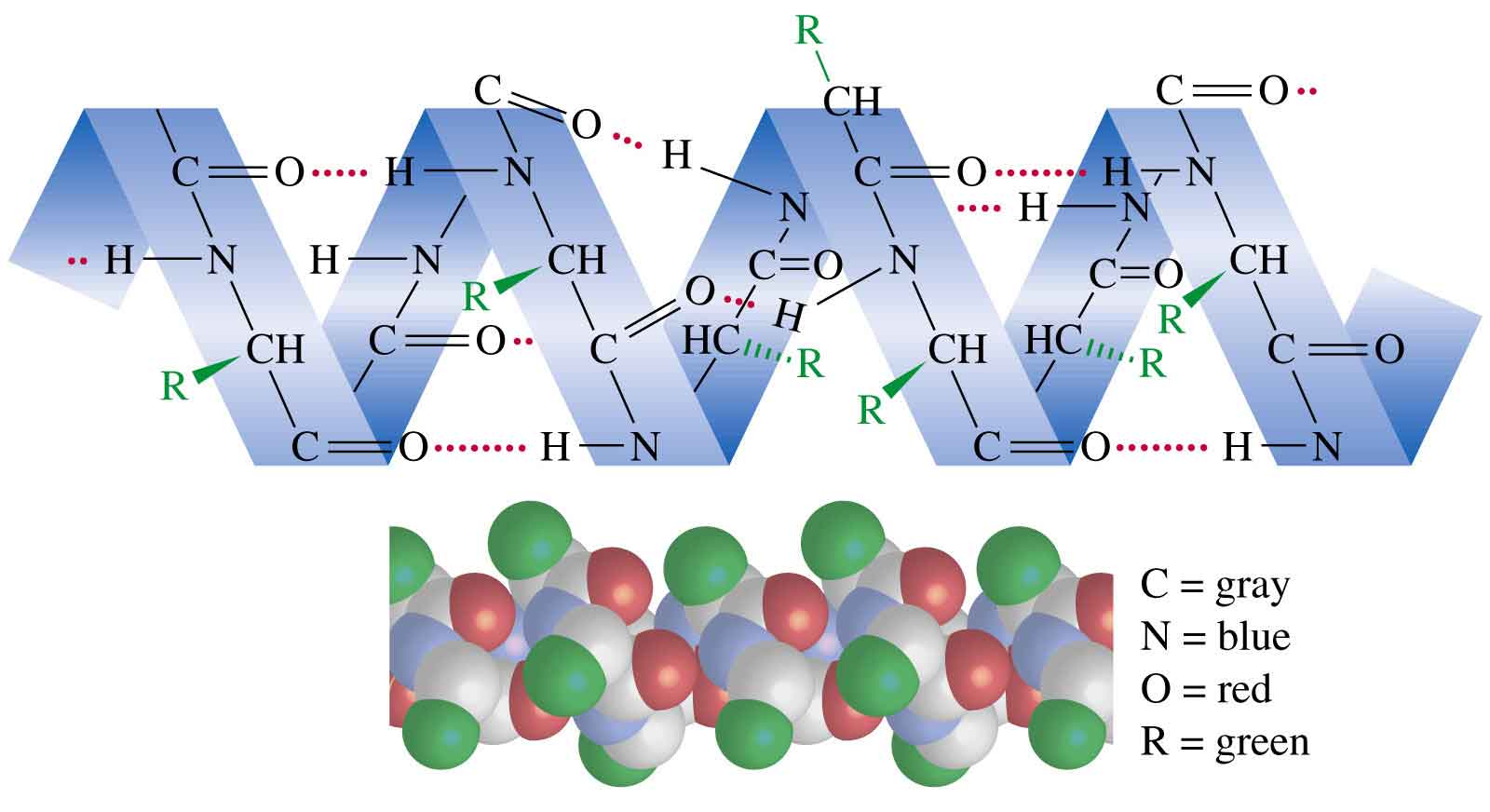
Вторичная структура также стабилизуется дисульфидными мостиками по месту цистеиновых остатков.
Известна другая вторичная структура белка: -структура в виде складчатого листа -Структура образуется из нескольких полипептидых цепей связанных водородными связями.


Третичная структура – форма белковой молекулы; трёхмерная структура белка.
Укладка нерегулярных областей и α- и -структур в глобулу определяет третичную структуру белка. Третичная структура является более сложной пространственной организацией макромолекулы, которая стабилизируется водородной связью, дисульфидными мостиками, гидрофобными взаимодействиями и силами Ван-дер-Ваальса.
По третичной структуре белки делят на:
- глобулярные – для них характерна -спиральная структура, уложенная в пространстве в виде сферы – глобулы (например, яичный белок, фермент – глобин в составе гемоглобина);
- фибриллярные – для них характерна -структура. Как правило, эти белки имеют волокнистое строение и к ним относятся белки мышц, ткани – миоинозин, бетта-кератин волос.
Четвертичная структура известна для некоторых белков, выполняющих важные физиологические функции. Четвертичная структура – агрегат нескольких белковых молекул, образующих одну структуру.
Взаимодействия: ионные, водородные, гидрофобные, ковалентные (дисульфидные).
Протомер – отдельная полипептидная цепь.
Субъединица – функциональная единица.
Например, четвертичная структура глобина является пространственным образованием 4-х субъединиц. Доказано, что переносчиком кислорода гемоглобин может только при наличии четвертичной структуры глобина.
