
- •Часть 3. Биополимеры и их структурные компоненты
- •Омск – 2016
- •Предисловие
- •1. Тематические разделы дисциплины «химия биополимеров»
- •1.1 Углеводы. Моносахариды и их производные
- •Биологические функции углеводов
- •Моносахариды
- •I. По виду функциональной группы моносахариды делятся на:
- •II. По числу атомов углерода в цепи различают:
- •Биологически важные альдогексозы Глюкоза (виноградный сахар):
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.2 Сложные углеводы. Дисахариды. Олигосахариды. Полисахариды.
- •По строению и химическим связям дисахариды делят на 2 типа:
- •Таутомерия мальтозы:
- •Химические свойства восстанавливающих дисахаридов.
- •Химические свойства невосстанавливающих дисахаридов
- •Мукополисахариды
- •Контрольные вопросы
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.3 Рубежная контрольная работа Тема: Углеводы – простые и сложные Контрольные вопросы
- •Демонстрационный вариант билета
- •Критерии оценивания контрольной работы:
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •Строение -аминокислот
- •Классификация -аминокислот по составу бокового радикала:
- •Моноаминомонокарбоновые α-аминокислоты (нейтральные):
- •VI. Ароматические -аминокислоты
- •VII. Гетероциклические -аминокислоты
- •Стереоизомерия аминокислот
- •Физические свойства аминокислот.
- •Кислотно-основные свойства -аминокислот.
- •Химические свойства аминокислот.
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.5 Пептиды и белки Пептиды, реакция образования, строение
- •Классификация пептидов и белков
- •I. В зависимости от формы молекул белки подразделяются на фибриллярные и глобулярные.
- •Изоэлектрическая точка белка (pI)
- •Химические свойства пептидов и белков
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.6 Биологически важные азотсодержащие гетероциклические соединения
- •Классификация гетероциклических соединений:
- •Пятичленные гетероциклы с одним гетероатомом:
- •Пятичленные гетероциклы с двумя гетероатомами:
- •Шестичленные гетероциклы с одним гетероатомом:
- •Шестичленные гетероциклы с двумя гетероатомами:
- •Конденсированные системы гетероциклов
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.7 Нуклеиновые кислоты
- •Состав нуклеозидов и нуклеотидов днк и рнк
- •Нуклеозиды рнк
- •Нуклеозиды днк
- •Названия важнейших нуклеотидов, входящих в состав нуклеиновых кислот
- •С троение атф
- •Структура нуклеиновых кислот
- •Между гуанином и цитозином – три водородные связи:
- •Типовые задания
- •2) Гуанозин.
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.8 Липиды Характеристика и классификация липидов:
- •Жиры и масла (триацилглицерины) – это сложные эфиры глицерина и высших жирных кислот, в которых все три гидроксильные группы глицерина ацилированы.
- •Биологическая роль и основные функции жиров
- •Химические свойства триацилглицеринов:
- •3. Присоединение иода:
- •Фосфолипиды, строение, биологическая роль, химические свойства:
- •Классификация глицерофосфолипидов
- •Химические свойства:
- •2) Щелочной гидролиз:
- •Гликолипиды, строение и биологическая роль:
- •1. Цереброзиды. Они включают остаток церамида и моносахарида (d-глюкоза, d-галактоза), которые соединены -гликозидной связью.
- •Галактоцереброзид Галактоцереброзиды входят в состав оболочек нервных клеток.
- •2. Ганглиозиды. Они включают остаток церамида и олигосахарида (например, лактозы или мальтозы), соединённых -гликозидной связью.
- •Жидкостно-мозаичная модель мембраны Зингера-Николсона:
- •Контрольные вопросы
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •2. Инструкция по охране труда и пожарной безопасности для обучающихся при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •32.05.01 Медико-профилактическое дело
- •Демонстрационный вариант зачетной работы по дисциплине «Химия биополимеров»
- •Демонстрационный вариант зачетного билета
- •Заключение
- •Глоссарий
- •Электронные образовательные ресурсы
Типовые задания
Задание 1. Напишите все возможные стереоизомеры треонина в проекционных формулах Фишера. Укажите конфигурацию каждого хирального центра. Какие структуры являются энантиомерами, а какие диастереомерами? Есть ли среди приведенных структур мезоформа?
Решение. Молекула треонина содержит два хиральных центра:

следовательно, число оптических изомеров равно 2n = 22 = 4.

I и II, III и IV энантиомеры;
I и III, I и IV, II и III, II и IV σ-диастереомеры.
Среди приведенных структур мезоформы нет, так как каждый стереоизомер имеет свой энантиомер.
Задание 2. Приведите примеры α-аминокислот, входящих в состав белков, с гидрофобными и гидрофильными боковыми радикалами.
Решение. α-Аминокислоты с гидрофобными радикалами: глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан и пролин (иминокислота). Радикалы этих аминокислот воду не притягивают, а стремятся друг к другу или к другим гидрофобным молекулам.
α-Аминокислоты с гидрофильными радикалами: серин, треонин, тирозин, аспарагиновая кислота, глутаминовая кислота, цистеин и оксипролин (иминокислота). В состав радикалов этих аминокислот входят полярные функциональные группы, образующие водородные связи с водой.
В свою очередь, эти аминокислоты делят на две группы:
- неионогенные α-аминокислоты, не способные к ионизации.
Н апример,
гидроксильная группа треонина:
апример,
гидроксильная группа треонина:
- ионогенные α-аминокислоты, способные к ионизации в условиях организма.
К α-аминокислотам с отрицательно заряженными радикалами относятся тирозин, цистеин, аспарагиновая и глутаминовая кислоты. Эти аминокислоты называют кислыми.
Например, при рН 7 фенольная гидроксильная группа тирозина ионизирована на 0,01%; тиольная группа цистеина на 8%.
Полностью ионизированные формы аспарагиновой и глутаминовой кислот называют аспартатом и глутаматом:

К α-аминокислотам с положительно заряженными радикалами относятся лизин, аргинин и гистидин. Эти аминокислоты называют оснóвными.
У лизина есть вторая аминогруппа, способная присоединять протон:

У аргинина положительный заряд приобретает гуанидиновая группа:
 Пиридиновый
атом азота в имидазольном ядре гистидина
содержит неподеленную пару электронов,
которая также может присоединять протон:
Пиридиновый
атом азота в имидазольном ядре гистидина
содержит неподеленную пару электронов,
которая также может присоединять протон:

Задание 3. Для аланина напишите уравнения реакций, иллюстрирующих его амфотерный характер.
Решение. Напишем формулу аланина – 2-аминопропановой кислоты

Как все аминокислоты, аланин за счет наличия карбоксильной группы обладает кислотными свойствами, а за счет аминогруппы проявляет основные свойства.
Реакция, иллюстрирующая кислотные свойства аланина, – это реакция взаимодействия со щелочью, с образованием натриевой соли аланина.
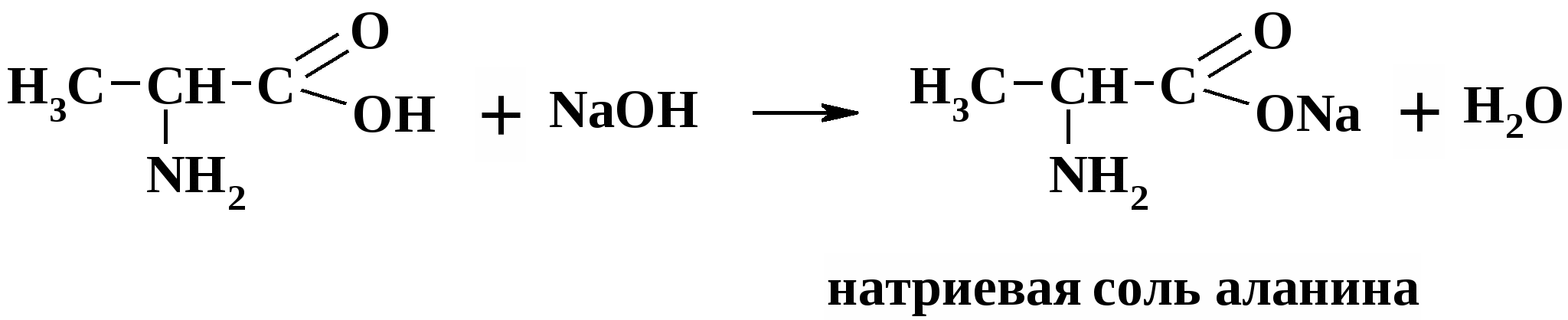
Реакция, доказывающая основные свойства аланина, – это реакция взаимодействия с соляной кислотой, с образованием соответствующей соли.

Задание 4. Смесь глицина, аланина, лизина, аргинина, серина и глутаминовой кислоты разделяли методом электрофореза при рН 6.
Определите направление движения аминокислот при электрофорезе, если изоэлектрические точки этих аминокислот соответственно равны значениям pH: 6,0; 6,0; 9,8; 10,8; 5,7 и 3,2.
Решение. В изоэлектрической точке (pI рН) суммарный заряд α-аминокислоты равен нулю. В данных условиях такое соотношение выполняется для аланина, глицина и серина и эти аминокислоты в электрическом поле перемещаться не будут.
При рН > pI преобладает анионная форма и аминокислота (в данном случае глутаминовая кислота) будет перемещаться к аноду.
В случае, когда рН < pI в растворе преобладает катионная форма, поэтому лизин и аргинин будут перемещаться к катоду.
Задание 5. Даны три аминокислоты: аспарагиновая, лизин и глицин. Определите, в какой среде кислой, нейтральной или щелочной будут находиться изоэлектрические точки этих кислот по сравнению с глицином, для которого рI = 6.
Решение. У аспарагиновой кислоты рI будет находиться в более кислой среде, чем у глицина, так как для подавления диссоциации второй карбоксильной группы требуется дополнительное количество ионов H+.
У лизина рI будет находиться в более щелочной среде, чем у глицина, так как для предотвращения образования второй NH3+ группы требуется дополнительное количество ионов OH.
Задание 6. Заболевание фенилкетонурия связано с нарушением синтеза тирозина из фенилаланина и накоплением в организме токсичных продуктов дезаминирования фенилаланина. Какое соединение получается в результате окислительного дезаминирования фенилаланина?
Решение. α-Аминокислота фенилаланин в организме под действием фермента (фенилаланингидроксилаза) гидроксилируется в α-аминокислоту тирозин. В отсутствие этого фермента или при его недостаточной активности в организме накапливается фенилаланин. При его дезаминировании (удаление азотсодержащей функциональной группы) получается оксокислота – фенилпировиноградная кислота, которая и вызывает токсический эффект.
Дезаминирование не затрагивает углеродного скелета α-аминокислоты, поэтому у продуктов дезаминирования сохраняется способность включаться в другие обменные процессы. Кроме того, через реакцию дезаминирования осуществляется генетическая связь α-аминокислот с другими типами органических кислот:
Окислительное дезаминирование α-аминокислот в организме протекает под действием ферментов (оксидазы) с участием коферментов NAD+, NADP+. На первой стадии реакции фенилаланин окисляется (дегидрируется) с образованием соответствующей α-иминокислоты:
С6Н5-СН-СООН окисление С6Н5-С-СООН + 2Н+ Н2О С6Н5-С-СООН + NH3
| || ||
NH2 NH O
Фенилаланин α-иминокислота Фенилпировиноградная
кислота
Таким образом, в результате окислительного дезаминирования фенилаланина образуется фенилпировиноградная кислота.
