
- •Часть 3. Биополимеры и их структурные компоненты
- •Омск – 2016
- •Предисловие
- •1. Тематические разделы дисциплины «химия биополимеров»
- •1.1 Углеводы. Моносахариды и их производные
- •Биологические функции углеводов
- •Моносахариды
- •I. По виду функциональной группы моносахариды делятся на:
- •II. По числу атомов углерода в цепи различают:
- •Биологически важные альдогексозы Глюкоза (виноградный сахар):
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.2 Сложные углеводы. Дисахариды. Олигосахариды. Полисахариды.
- •По строению и химическим связям дисахариды делят на 2 типа:
- •Таутомерия мальтозы:
- •Химические свойства восстанавливающих дисахаридов.
- •Химические свойства невосстанавливающих дисахаридов
- •Мукополисахариды
- •Контрольные вопросы
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.3 Рубежная контрольная работа Тема: Углеводы – простые и сложные Контрольные вопросы
- •Демонстрационный вариант билета
- •Критерии оценивания контрольной работы:
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •Строение -аминокислот
- •Классификация -аминокислот по составу бокового радикала:
- •Моноаминомонокарбоновые α-аминокислоты (нейтральные):
- •VI. Ароматические -аминокислоты
- •VII. Гетероциклические -аминокислоты
- •Стереоизомерия аминокислот
- •Физические свойства аминокислот.
- •Кислотно-основные свойства -аминокислот.
- •Химические свойства аминокислот.
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.5 Пептиды и белки Пептиды, реакция образования, строение
- •Классификация пептидов и белков
- •I. В зависимости от формы молекул белки подразделяются на фибриллярные и глобулярные.
- •Изоэлектрическая точка белка (pI)
- •Химические свойства пептидов и белков
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.6 Биологически важные азотсодержащие гетероциклические соединения
- •Классификация гетероциклических соединений:
- •Пятичленные гетероциклы с одним гетероатомом:
- •Пятичленные гетероциклы с двумя гетероатомами:
- •Шестичленные гетероциклы с одним гетероатомом:
- •Шестичленные гетероциклы с двумя гетероатомами:
- •Конденсированные системы гетероциклов
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.7 Нуклеиновые кислоты
- •Состав нуклеозидов и нуклеотидов днк и рнк
- •Нуклеозиды рнк
- •Нуклеозиды днк
- •Названия важнейших нуклеотидов, входящих в состав нуклеиновых кислот
- •С троение атф
- •Структура нуклеиновых кислот
- •Между гуанином и цитозином – три водородные связи:
- •Типовые задания
- •2) Гуанозин.
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.8 Липиды Характеристика и классификация липидов:
- •Жиры и масла (триацилглицерины) – это сложные эфиры глицерина и высших жирных кислот, в которых все три гидроксильные группы глицерина ацилированы.
- •Биологическая роль и основные функции жиров
- •Химические свойства триацилглицеринов:
- •3. Присоединение иода:
- •Фосфолипиды, строение, биологическая роль, химические свойства:
- •Классификация глицерофосфолипидов
- •Химические свойства:
- •2) Щелочной гидролиз:
- •Гликолипиды, строение и биологическая роль:
- •1. Цереброзиды. Они включают остаток церамида и моносахарида (d-глюкоза, d-галактоза), которые соединены -гликозидной связью.
- •Галактоцереброзид Галактоцереброзиды входят в состав оболочек нервных клеток.
- •2. Ганглиозиды. Они включают остаток церамида и олигосахарида (например, лактозы или мальтозы), соединённых -гликозидной связью.
- •Жидкостно-мозаичная модель мембраны Зингера-Николсона:
- •Контрольные вопросы
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •2. Инструкция по охране труда и пожарной безопасности для обучающихся при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •32.05.01 Медико-профилактическое дело
- •Демонстрационный вариант зачетной работы по дисциплине «Химия биополимеров»
- •Демонстрационный вариант зачетного билета
- •Заключение
- •Глоссарий
- •Электронные образовательные ресурсы
Химические свойства аминокислот.
Аминокислоты – это гетерофункциональные органические соединения, вступающие в реакции, характерные для карбоксильных групп, аминогрупп, и проявляющие ряд специфических биохимических свойств.
1. Как амфолиты -аминокислоты образуют соли при взаимодействии с кислотами и основаниями.

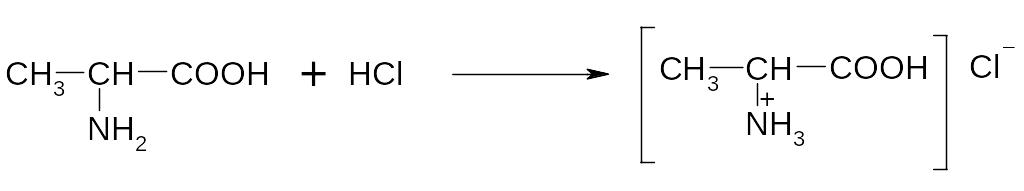 аланин
натриевая
соль аланина
аланин
натриевая
соль аланина
аланин гидрохлорид аланина
2. Реакция декарбоксилирования -аминокислоты – это ферментативный процесс образования биогенных аминов из соответствующих -аминокислот. Декарбоксилирование происходит с участием фермента – декарбоксилазы и кофермента (KoF) – пиридоксальфосфата.
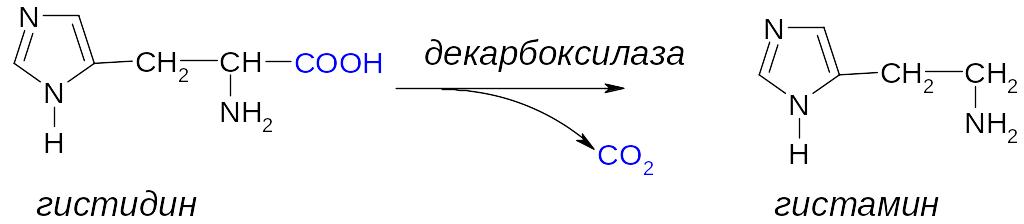
Г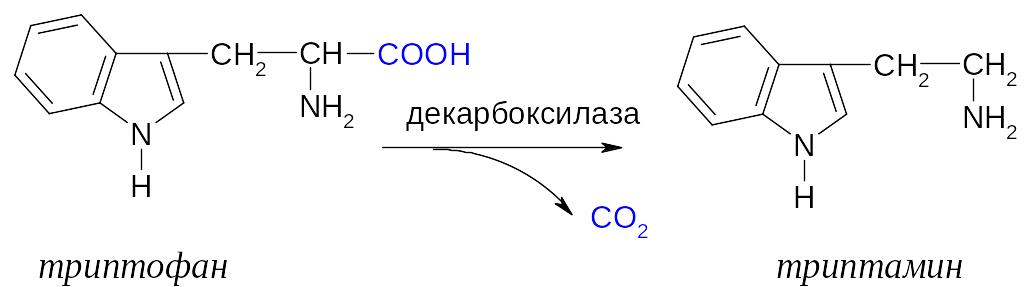 истамин
является медиатором аллергических
реакции организма. При декарбоксилировании
глутаминовой α-аминокислоты образуется
ГАМК (γ-аминомасляная кислота),
которая является медиатором торможения
нервной системы.
истамин
является медиатором аллергических
реакции организма. При декарбоксилировании
глутаминовой α-аминокислоты образуется
ГАМК (γ-аминомасляная кислота),
которая является медиатором торможения
нервной системы.
3. Реакция дезаминирования – эта реакция является процессом удаления аминогруппы путем окислительного, восстановительного, гидролитического или внутримолекулярного дезаминирования. В организме преобладает путь окислительного дезаминирования с участием ферментов – дегидрогеназ и кофермента – NAD+.
На первой стадии процесса осуществляется дегидрирование -звена с образованием -иминокислоты. На второй стадии происходит неферментативный гидролиз -аминокислоты, приводящий к образованию -кетокислоты и сопровождающийся выделением аммиака, включающегося в цикл образования мочевины.
Общая схема процесса окислительного дезаминирования:
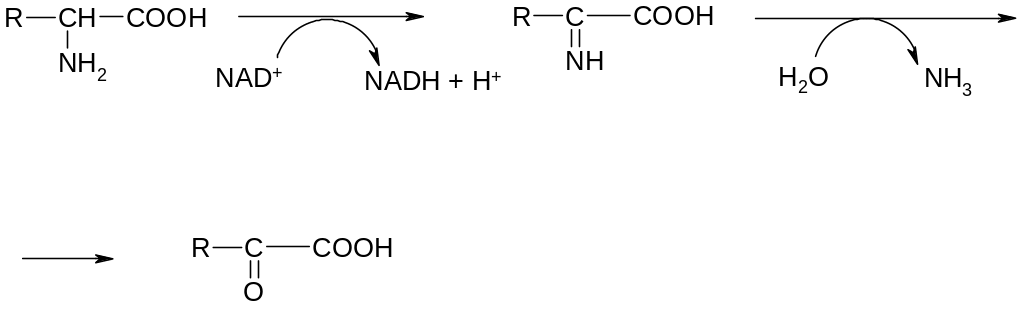
Например, реакция окислительного дезаминирования аланина:
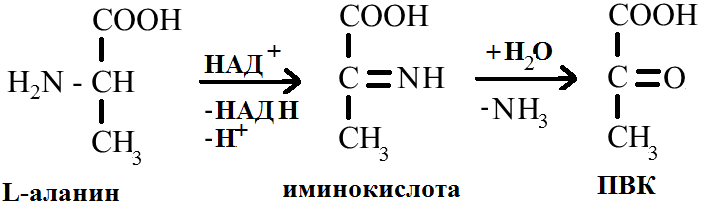
С помощью подобных процессов снижается уровень избыточных АК в клетке.
4. Трансаминирование или переаминирование -аминокислоты – это путь синтеза необходимых АК из -кетокислот. При этом донором аминогруппы является -аминокислота, находящаяся в избытке, а акцептором аминогруппы – -кетокислота (ПВК, ЩУК, -кетомасляная кислота). Процесс происходит с участием фермента – трансаминазы и кофермента – пиридоксальфосфата. Например, процесс трансаминирования L-аланина и ЩУК:
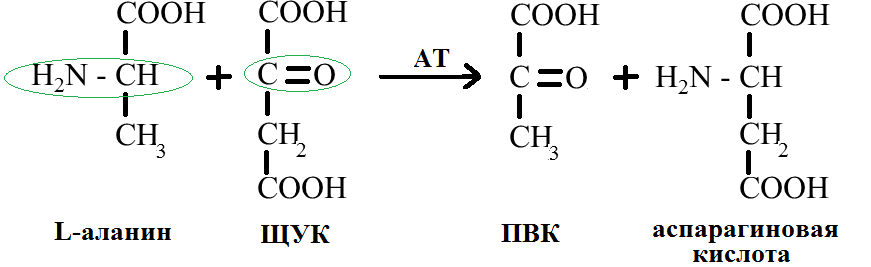
Процесс переаминирования связывает обмен белков и углеводов в организме, он регулирует содержание -аминокислот и синтез заменимых -аминокислот.
Кроме этих реакций -аминокислоты способны образовывать сложные эфиры, ацильные производные и вступать в реакции, которые не имеют аналогий в химии in vitro. К таким процессам относятся гидроксилирование фенилаланина в тирозин.
При отсутствии необходимого фермента в организме накапливается фенилаланин, при его дезаминировании образуется токсичная кислота, накопление которой приводит к тяжелому заболеванию – фенилкетонурии.
Контрольные вопросы
Строение α-аминокислот, номенклатура, изомерия.
Классификация α-аминокислот по характеру бокового радикала, физико-химические характеристики боковой радикала. Классификация α-аминокислот по способности синтезироваться в организме.
Кислотно-основные свойства α-аминокислот.
Общие пути обмена α-аминокислот в организме. Реакции декарбоксилирования, трансаминирования, окислительного дезаминирования.
