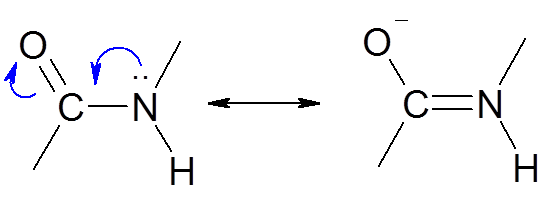- •Часть 3. Биополимеры и их структурные компоненты
- •Омск – 2016
- •Предисловие
- •1. Тематические разделы дисциплины «химия биополимеров»
- •1.1 Углеводы. Моносахариды и их производные
- •Биологические функции углеводов
- •Моносахариды
- •I. По виду функциональной группы моносахариды делятся на:
- •II. По числу атомов углерода в цепи различают:
- •Биологически важные альдогексозы Глюкоза (виноградный сахар):
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.2 Сложные углеводы. Дисахариды. Олигосахариды. Полисахариды.
- •По строению и химическим связям дисахариды делят на 2 типа:
- •Таутомерия мальтозы:
- •Химические свойства восстанавливающих дисахаридов.
- •Химические свойства невосстанавливающих дисахаридов
- •Мукополисахариды
- •Контрольные вопросы
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.3 Рубежная контрольная работа Тема: Углеводы – простые и сложные Контрольные вопросы
- •Демонстрационный вариант билета
- •Критерии оценивания контрольной работы:
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •Строение -аминокислот
- •Классификация -аминокислот по составу бокового радикала:
- •Моноаминомонокарбоновые α-аминокислоты (нейтральные):
- •VI. Ароматические -аминокислоты
- •VII. Гетероциклические -аминокислоты
- •Стереоизомерия аминокислот
- •Физические свойства аминокислот.
- •Кислотно-основные свойства -аминокислот.
- •Химические свойства аминокислот.
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.5 Пептиды и белки Пептиды, реакция образования, строение
- •Классификация пептидов и белков
- •I. В зависимости от формы молекул белки подразделяются на фибриллярные и глобулярные.
- •Изоэлектрическая точка белка (pI)
- •Химические свойства пептидов и белков
- •Контрольные вопросы
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.6 Биологически важные азотсодержащие гетероциклические соединения
- •Классификация гетероциклических соединений:
- •Пятичленные гетероциклы с одним гетероатомом:
- •Пятичленные гетероциклы с двумя гетероатомами:
- •Шестичленные гетероциклы с одним гетероатомом:
- •Шестичленные гетероциклы с двумя гетероатомами:
- •Конденсированные системы гетероциклов
- •Типовые задания
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.7 Нуклеиновые кислоты
- •Состав нуклеозидов и нуклеотидов днк и рнк
- •Нуклеозиды рнк
- •Нуклеозиды днк
- •Названия важнейших нуклеотидов, входящих в состав нуклеиновых кислот
- •С троение атф
- •Структура нуклеиновых кислот
- •Между гуанином и цитозином – три водородные связи:
- •Типовые задания
- •2) Гуанозин.
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •1.8 Липиды Характеристика и классификация липидов:
- •Жиры и масла (триацилглицерины) – это сложные эфиры глицерина и высших жирных кислот, в которых все три гидроксильные группы глицерина ацилированы.
- •Биологическая роль и основные функции жиров
- •Химические свойства триацилглицеринов:
- •3. Присоединение иода:
- •Фосфолипиды, строение, биологическая роль, химические свойства:
- •Классификация глицерофосфолипидов
- •Химические свойства:
- •2) Щелочной гидролиз:
- •Гликолипиды, строение и биологическая роль:
- •1. Цереброзиды. Они включают остаток церамида и моносахарида (d-глюкоза, d-галактоза), которые соединены -гликозидной связью.
- •Галактоцереброзид Галактоцереброзиды входят в состав оболочек нервных клеток.
- •2. Ганглиозиды. Они включают остаток церамида и олигосахарида (например, лактозы или мальтозы), соединённых -гликозидной связью.
- •Жидкостно-мозаичная модель мембраны Зингера-Николсона:
- •Контрольные вопросы
- •Тестовые задания для самоконтроля
- •Контрольные задания
- •Литература Основная литература
- •Дополнительная литература
- •Электронные образовательные ресурсы
- •2. Инструкция по охране труда и пожарной безопасности для обучающихся при работе в лабораториях кафедры химии
- •2.1. Общие требования безопасности
- •2.2. Требования безопасности перед началом работы
- •2.3. Требования безопасности во время работы
- •2.4. Требования безопасности в аварийных ситуациях
- •32.05.01 Медико-профилактическое дело
- •Демонстрационный вариант зачетной работы по дисциплине «Химия биополимеров»
- •Демонстрационный вариант зачетного билета
- •Заключение
- •Глоссарий
- •Электронные образовательные ресурсы
Литература Основная литература
1. Тюкавкина Н. А. Биоорганическая химия [Электронный ресурс] : учебник. Глава 12. α-Аминокислоты, пептиды и белки / Тюкавкина Н.А., Бауков Ю. И., Зурабян С. Э. // Москва : Гэотар-Медиа, 2014. – 416 с. Режим доступа : http://www.studmedlib.ru/ru/book/ISBN9785970427835.html
Дополнительная литература
1. Биоорганическая химия [Электронный ресурс] : руководство к практическим занятиям / под ред. Н. А. Тюкавкина // Москва : Гэотар-Медиа, 2014. – 168 с. Режим доступа : http://www.studmedlib.ru/ru/book/ISBN9785970428214.html
2. Руководство к лабораторным занятиям по биоорганической химии : учеб. пособие для студентов вузов / под ред. Н. А. Тюкавкина // Москва : ДРОФА, 2006. – 319 с.
3. Тюкавкина Н. А. Биоорганическая химия: учеб. для студентов [мед.] вузов / Н. А. Тюкавкина, Ю. И. Бауков // Москва : Дрофа, 2005. – 542 с.
Электронные образовательные ресурсы
Базы данных, информационно-справочные и поисковые системы:
1. Электронная библиотека ОмГМУ: http://weblib.omsk-osma.ru;
2.Электронно-библиотечная система «КнигаФонд»: http://www.knigafund.ru;
3. ЭБС «Консультант студента. Электронная библиотека медицинского вуза» http://www.studmedlib.ru;
4. Научная электронная библиотека: http://elibrary.ru/defaultx.asp;
5. База данных Scopus: http://www.scopus.com.
1.5 Пептиды и белки Пептиды, реакция образования, строение
Пептиды (греч. πεπτος — питательный) и белки - биополимеры, построенные из -аминокислот.
Пептиды содержат до 100, белки свыше 100, олигопептиды - не более 10 аминокислотных остатков. Молекулярная масса пептидов до 10000, белков от 10000 до нескольких миллионов.
Функции белков
Ферментативная
Структурная
Питательная
Защитная
Транспортная
Регуляторная
Запасающая
Двигательная
Классификация пептидов и белков
I. В зависимости от формы молекул белки подразделяются на фибриллярные и глобулярные.
Молекулы фибриллярных белков вытянуты в длину, нитеобразны, группируются одна подле другой. Образуют за счёт многочисленных межмолекулярных водородных связей суперспирали. Межмолекулярные водородные связи не могут быть преодолены молекулами растворителя, поэтому фибриллярные белки нерастворимы в воде.
Глобулярные белки сложены в компактные глобулы. Водородные связи являются в основном внутримолекулярными, межмолекулярные силы относительно слабы и разрушаются молекулами растворителя. Вследствие этого глобулярные белки растворимы в воде с образованием коллоидных растворов.
Строение белков определяет те функции, которые они выполняют в живых организмах. Фибриллярные белки нерастворимы, склонны к образованию волокон и потому служат основным строительным материалом животных клеток. К числу фибриллярных белков относятся кератин (в коже, волосах, рогах, ногтях, перьях), коллаген (в сухожилиях), миозин (в мышцах).
Глобулярные белки выполняют функции, требующие подвижности и, следовательно, растворимости. Они участвуют в регуляции жизненных процессов: гемоглобин переносит кислород из лёгких в ткани, ферменты катализируют многочисленные химические реакции, протекающие в организме, антитела обеспечивают защиту от чужеродных организмов и т.д.
II. По составу белки делят на простые (неконъюгированные) и сложные (конъюгированные). Сложные белки состоят из белковой и небелковой простетической группы. По ряду характерных свойств простые белки можно разделить на несколько подгрупп: альбумины, глобулины, гистоны, протамины, проламины, склеропротеины. К сложным белкам относятся фосфопротеины, нуклеопротеины, хромопротеины, гликопротеины, липопротеины.
Схема образования пептидов
Общим свойством -аминокислот является процесс поликонденсации, приводящий к образованию пептидов. В результате этой реакции формируются амидные связи по месту взаимодействию карбоксильной группы одной -аминокислоты и аминогруппы другой -аминокислоты. В пептидах эта связь называется пептидной связью в составе пептидной группы.
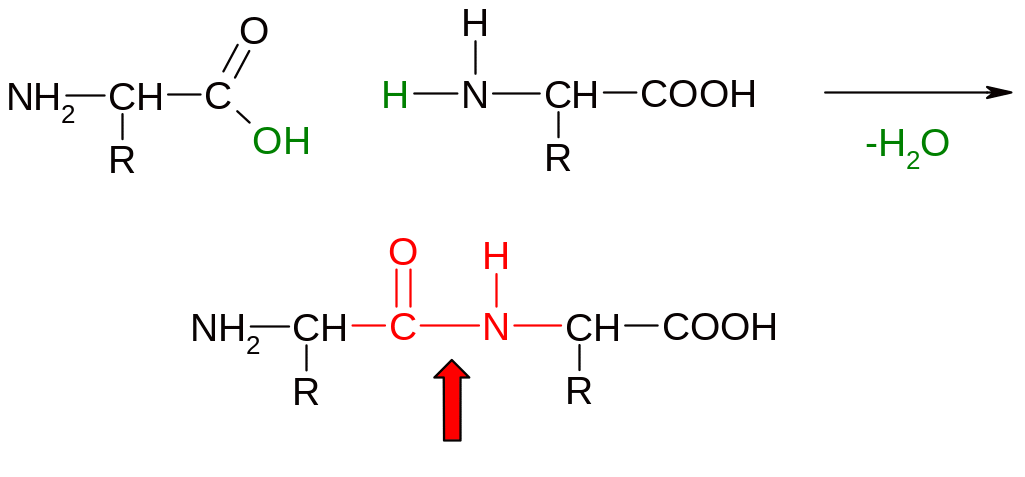
Схема образования треонилфениаланилтирозина:
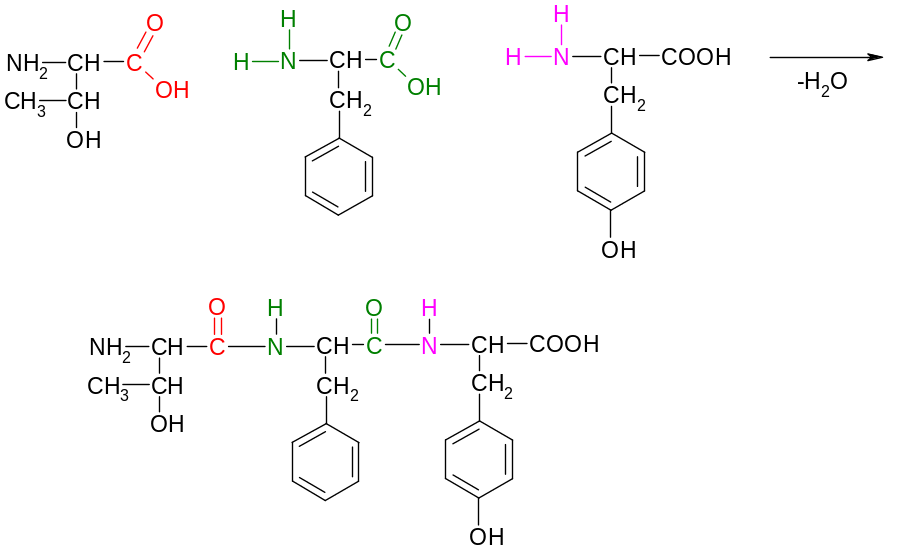
Названия пептидов строятся путём последовательного перечисления аминокислотных остатков, начиная с N-конца, с добавлением суффикса -ил, кроме последней С-концевой аминокислоты, для которой сохраняется её полное название. Для остатка аспарагиновой кислоты используется название аспартил.
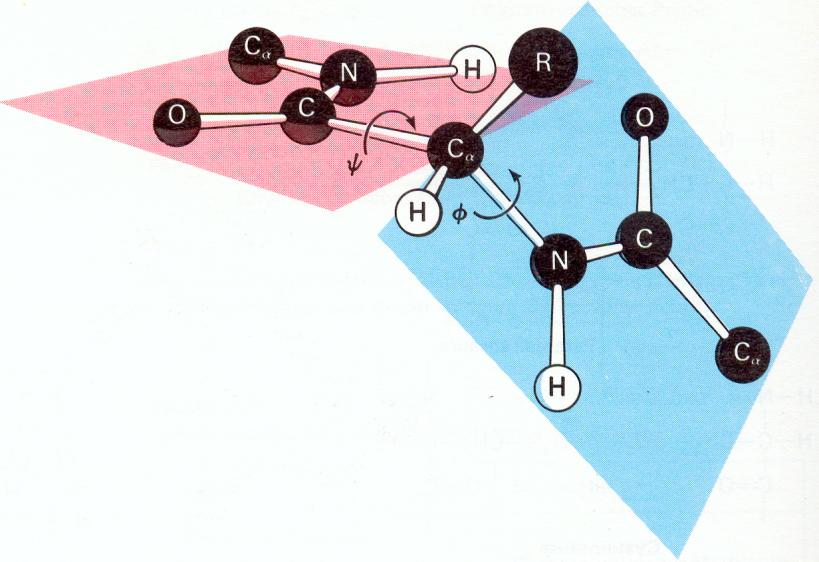
Пространственное строение пептидной (амидной) группы:
Пептидная группа относится к р,-сопряженной системе, в составе которой атомы С, О и N лежат в одной -плоскости.
За счет образования единого делокализованного 4-электронного облака вращение вокруг С-N связи затруднено. При этом -углеродные звенья находятся в выгодном транс-положении.