
- •Раздел 3. Частная вирусология
- •Тема 3.1. Микробиологическая диагностика стафило- и стрептокок-
- •Тема 3.2. Микробиологическая диагностика рожи свиней и листериоза. 149
- •Введение
- •Требования к уровню освоения дициплины
- •Раздел 1. Общая микробиология
- •Устройство бактериологической лаборатории
- •Устройство микроскопа
- •Правила работы с микроскопом
- •Контрольные вопросы:
- •Тема 1.2. Основные формы бактерий. Бактериологические краски. Приго-
- •Формы бактерий
- •Бактериологические краски
- •Техника приготовлениябактериологических препаратов (мазков)
- •Методы фиксации мазков:
- •Простые методы окраски бактерий
- •Сложные методы окраски
- •Окраска по Граму
- •Окраска по Циль-Нильсену
- •Контрольные вопросы:
- •Тема 1.3. Окраска спор, капсул бактерий, методы определения подвижно- сти бактерий.
- •Метод Пешкова:
- •Метод Виртца:
- •Ные капсулы.
- •Метод Михина:
- •Метод Ольта:
- •Контрольные вопросы:
- •Тема 1.4. Изучение морфологии грибов и актиномицетов.
- •Классификация
- •Тофтора).
- •Культивирование грибов
- •Контрольные вопросы:
- •Тема 1.5. Лабораторная аппаратура. Методы стерилизации.
- •Контрольные вопросы:
- •Тема 1.6.Приготовление питательных сред.
- •Классификация питательных сред
- •По назначению:
- •Специальные питательные среды
- •Методы создания анаэробных условий
- •Дифференциально-диагностические среды
- •Висмут-сульфит агар (среда Вильсон-Блера).
- •Среды накопления (обогащения)
- •Синтетические среды
- •Контрольные вопросы:
- •Тема 1.7.Посев и культивирование микроорганизмов. Методы выделения чистых культур микробов.
- •Техника посева на поверхность плотной питательной среды в чашках Петри
- •Техника посева на скошенный агар
- •Техника посева на жидкую
- •Техника пересевов культур микробов
- •Ной среды на другую.
- •Методы механического разделения микробов
- •Методы использования биологических особенностей микроорганизмов
- •Контрольные вопросы:
- •Тема 1.8.Изучение культуральных и биохимических (ферментативных)
- •Определение протеолитических ферментов
- •Определение сахаролитических свойств микробов
- •Определение окислительно-восстановительных ферментов
- •Определение редуцирующих свойств
- •Определение гемолитических свойств
- •Контрольные вопросы:
- •Тема 1.9.Изучение действия антибиотиков,антисептиков и бактерио-
- •Метод диффузии антибиотиков в агар с применением дисков
- •Метод серийных разведений антибиотика
- •Контрольные вопросы:
- •Способы заражения лабораторных животных
- •Вскрытие трупов лабораторных животных
- •Определение токсигенности микробов
- •Определение токсичности микробов
- •Методы лабораторных исследований
- •Отбор патматериала
- •Принципы организации и оборудование бактериологических лабораторий
- •Правила взятия, консервирования и транспортировки патологического материала
- •Контрольные вопросы:
- •Тема 1.11.Санитарно-бактериологическое исследование воды.
- •Контрольные вопросы:
- •Тема 1.12.Санитарно-бактериологическое исследование воздуха и почвы.
- •Санитарно-микробиологическое исследование почвы
- •Контрольные вопросы:
- •Тема 1.13.Изучение микрофлоры кормов. Коллоквиум №1 «Общая микро-
- •Контрольные вопросы:
- •Раздел 2. Инфекция и иммунитет Тема 2.1.Серологические реакции. Реакция агглютинации (ра).
- •Метод ра.
- •Контрольные вопросы:
- •Тема 2.2.Реакция преципитации (рп).
- •Контрольные вопросы:
- •Тема 2.3.Реакция связывания комплемента (рск).
- •Компоненты реакции:
- •Контрольные вопросы:
- •Тема 2.4.Реакция нейтрализации (рн), метод флуоресцирующих антител
- •Контрольные вопросы:
- •Тема 2.5.Биопрепараты. Коллоквиум № 2 «Серологические реакции в мик- робиологии».
- •Лиофилизация микроорганизмов
- •Правила использования и хранения биопрепаратов, их транспортировка
- •Контрольные вопросы:
- •Раздел 3. Частнаямикробиология Тема 3.1.Микробиологическая диагностика стафило- и стрептококкозов
- •Стафилококки.
- •Специфическая терапия и профилактика.
- •Стрептококкоза молодняка.
- •Контрольные вопросы:
- •Тема 3.2.Микробиологическая диагностика рожи свиней и листериоза Цель занятия: ознакомить студентов с возбудителями рожи свиней и листе-
- •Содержание:
- •Слева: гладкие s-формы (колонии возбудителя на пита- тельной среде и мазок под микроскопом); Справа: шероховатые r-формы (колонии возбудителя на питательной среде и мазок под микроскопом).
- •Контрольные вопросы:
- •Тема 3.3.Микробиологическая диагностика сибирской язвы.
- •Ная» дорожка.
- •Специфическая профилактика.
- •Контрольные вопросы:
- •Тема 3.4.Микробиологическая диагностика клостридиозов.
- •Контрольные вопросы:
- •Тема 3.5. Микробиологическая диагностика некробактериоза и копытной гнили овец.
- •Контрольные вопросы:
- •Тема 3.6. Коллоквиум № 3 «Грамположительные микроорганизмы». Цель занятия: выявить у студентов остаточные знания по пройденному ма-
- •Содержание:
- •Тема 3.7. Микробиологическая диагностика туберкулеза.
- •Контрольные вопросы:
- •Тема 3.8. Микробиологическая диагностика паратуберкулеза.
- •Тема 3.9. Микробиологическая диагностика эшерихиозов и сальмонелле-
- •Мпа; 2. Среда Эндо; 3. Среда Левина; 4. Среда Плоскирева.
- •Специфическая профилактика.
- •Специфическая профилактика.
- •Контрольные вопросы:
- •Тема 3.10. Микробиологическая диагностика бруцеллеза и туляремии.
- •Контрольные вопросы:
- •Тема 3.11.Микробиологическая диагностика пастереллеза и гемофилезов свиней.
- •Специфическая терапия.
- •Контрольные вопросы:
- •Тема 3.12. Микробиологическая диагностика сапа лошадей и мелиоидоза.
- •Контрольные вопросы:
- •Тема 3.13. Коллоквиум № 4 «Грамотрицательные микроорганизмы». Цель занятия: выявить у студентов остаточные знания по пройденному ма-
- •Содержание:
- •Тема 3.14. Микробиологическая диагностика лептоспироза и кампило-
- •Вакцины импортные для собак:
- •Контрольные вопросы:
- •Тема 3.15. Патогенные микоплазмы.
- •Контрольные вопросы:
- •Тема 3.16. Хламидии, риккетсии.
- •Контрольные вопросы:
- •Тема 3.17. Лабораторная диагностика микозов.
- •Лабораторная диагностика, специфическая терапия и профилактика.
- •Контрольные вопросы:
- •Тема 3.18. Лабораторная диагностика микотоксикозов.
- •Контрольные вопросы:
- •Форма промежуточного контроля знаний студентов
- •Список рекомендованной литературы
- •Дополнительная литература
- •Периодические издания
- •Перечень ресурсов информационно-телекоммуникационной сети «Интернет»
Определение гемолитических свойств
Проводят с целью определения вида и для диф- ференциации от непатогенных микробов на кровяном агаре (рисунок 61). При наличии у микроба гемоток- сина вокруг колонии образуется зона гемолиза. Раз- личают α-гемолиз, при котором вокруг колоний на-
блюдают непрозрачную зеленоватую зону свидетель- ствующую о неполном расщеплении гемоглобина
Рисунок 61 - Гемолиз во- круг колоний, растущих на агаре с кровью.
эритроцитов и β-гемолиз, характеризующийся полным растворением эритроцитов, зона вокруг колонии прозрачная. Например, патогенные стафилококки обладают β-гемолизом, непатогенные гемолизом не обладают. Исключением являются: воз- будитель сибирской язвы не имеет гемотоксина,непатогенные почвенные бацил- лы имеют гемотоксин.
Контрольные вопросы:
Что относится к культуральным свойствам микроорганизмов.
Что относится к биохимическим свойствам микроорганизмов.
Какой может быть характер роста микроорганизмов на плотных питатель- ных средах.
Каков может быть характер роста на жидких питательных средах.
Как определить протеолитическую активность микроорганизмов.
Как определить сахаролитическую активность.
Тема 1.9.Изучение действия антибиотиков,антисептиков и бактерио-
фагов на микроорганизмы.
Цель занятия: изучить антимикробный спектр действия антибиотиков; дей- ствие антисептиков и бактериофагов на микроорганизмы.
Содержание:
Действие антибиотиков на микроорганизмы.
Действие антисептиков на микроорганизмы.
Действие бактериофагов на микроорганизмы.
В настоящее время есть много антибиотиков, имеющих свой антимикробный спектр действия. Чувствительность микробов к антибиотику может снизиться или совсем исчезнуть за счет появления резистентных вариантов у данного вида мик- роба. Поэтому при назначении антибиотиков больным необходимо определить степень чувствительности к ним возбудителя с целью подбора самого эффектив- ного средства.
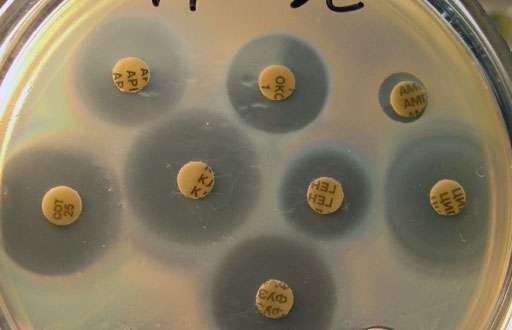
Метод диффузии антибиотиков в агар с применением дисков
Метод основан на формировании зоны задержки роста микроорганизмов во- круг бумажного диска, пропитанного антибиотиком, на плотной питательной сре- де.
Биологическая промышленность выпускает диски из фильтровального карто- на диаметром 6 мм, пропитанные растворами антибиотиков определенной концен- трации. Диски с различными антибиотиками отличаются друг от друга по цвету картона или кода, который представляет собой две-три буквы из названия анти- биотика, вытесненные на диске. Диски фасуют во флаконы по 100 штук. Учитывая гигроскопичность некоторых антибиотиков, на дно флакона помещают силика- гель, вещество, быстро поглощающее влагу и меняющий при этом свою окраску с синей на розовую. Изменение цвет силикагеля является показателем присутствия влаги во флаконе. Диски из флаконов, в которых силикагель окрашен в розовый цвет, использовать нельзя. После вскрытия флаконов диски можно хранить в ус- ловиях холодильника в течение срока. Указанного на этикетке набора. Перед ис- пользованием флаконы с дисками необходимо выдержать при комнатной темпера- туре в течение 1 часа для предотвращения образования конденсата на внутренней поверхности флаконов.
Для получения достоверных результатов используют стандартные среды, диски и условия проведения исследования.
Для определения чувствительности применяют следующие питательные сре-
ды:
среда АГВ (Андреева, Гивинталь, Гриднева, Ведьмина) – сухая готовая сре-
да, в состав которой входит питательный бульон, порошок агара, лизат кормовых дрожжей, крахмал растворимый, натрия фосфат двузамещенный;
диагностический агар ДОИ – рекомендованная ВОЗ сухая готовая среда. Для микроорганизмов, не растущих на обычных питательных средах, в среды до- бавляют 5 % дефибринированной крови.
Расплавленные среды разливают по 20 мл в стерильные чашки Петри. Глуби- на агарового слоя в чашках должна составлять 3-4 мм. После застывания агара их
подсушивают при комнатной температуре 30-40 минут с приоткрытыми крышка- ми. Готовые чашки со средой можно хранить при 10 °С не более 7-10 дней.
 Для
посева используют 12-20 часовые агаровые
культуры исследуемых мик- робов,которые
смывают физиологическим раствором и
по стандарту мутности го- товят
одномиллиардную взвесь. Для посева
можно использовать также чистую 20-
часовую бульонную культуру.
Для
посева используют 12-20 часовые агаровые
культуры исследуемых мик- робов,которые
смывают физиологическим раствором и
по стандарту мутности го- товят
одномиллиардную взвесь. Для посева
можно использовать также чистую 20-
часовую бульонную культуру.
На поверхность питательной среды наливают 1 мл взвеси культуры и покачиванием чашки равномерно распределяют ее по всей поверхности. Излишек жид- кости отсасывают пипеткой.
Приоткрытые чашки подсуши-
вают при комнатной температуре
10-15 минут.
Диски с различными анти-
Рисунок 62 - Тест на чувствительность бакте- рий к различным антибиотикам.
биотиками раскладывают стерильным пинцетом на поверхность засеянной среды на одинаковом расстоянии друг от друга и на расстоянии 2 см от края чашки. На одну чашку следует помещать не более 6 дисков для диффузии антибиотиков в агар чашки выдерживают в течение 2 часов при комнатной температуре, а затем помещают в термостат при 37 °С вверх дном.
Результаты учитывают через 16-18 часов по величине зоны задержки роста микробов вокруг диска (рисунок 62). Чашки помещают вверх дном на темную ма- товую поверхность так, чтобы свет настольной лампы падал на них под углом 45
°. Определяют диаметр зоны с помощью линейки, штангенциркуля или миллимет- ровой бумаги с учетом диаметра самого диска, с точностью до 1 мм. При диаметре зон в 15-25 мм микробы следует считать чувствительными к антибиотику, при зо- не до 15 мм – малочувствительны, отсутствие зон задержки роста указывает на нечувствительность культуры к данному антибиотику. При не резко очерченных краях зон или зонах с двойными контурами следует измерять диаметр зоны по
наиболее четкому контуру, не принимая во внимание мелкие колонии или едва заметный газон у края колонии.
