
- •Часть II рабочая тетрадь
- •Введение
- •1.1. Строение атома и периодическая система
- •1. 2. Химическая связь
- •2.1. Основы химической термодинамики
- •2.2. Химическая кинетика
- •Зависимость скорости реакции от температуры
- •2.3. Химическое равновесие
- •И стехиометрические расчёты
- •Характерные реакции оснóвных оксидов
- •4.1. Общие свойства растворов
- •4.2. Равновесия в растворах электролитов
- •Ионно-молекулярные реакции в растворах электролитов
- •Методы определения рН растворов
- •Гидролиз солей
- •5.1. Окислительно-восстановительные процессы
- •5.3. Электролиз
- •5.4. Коррозия металлов
- •Защитные покрытия
- •Электрохимические методы
- •6.1. Качественный химический анализ
- •6.2. Количественный химический анализ
- •6.3. Физико-химические и физические методы анализа
- •7.1. Общие сведения и методы получения полимеров
- •7.3. Природные полимеры
- •Библиографический список
- •Заключение
5.3. Электролиз
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Электролиз» [Конспект лекций, раздел 5.3].
Цель выполнения задания
· Усвоить основные закономерности процессов электролиза.
Теоретические сведения
Под электролизом понимается совокупность процессов, происходящих при пропускании постоянного тока через электрохимическую систему, состоящую из двух электродов и раствора или расплава электролита. Ограничимся рассмотрением электролиза растворов.
Электрод, подключённый к отрицательному полюсу источника тока, называется катодом, анод же подключается к положительному полюсу. Как во всех электрохимических системах на катоде идёт восстановление, а на аноде − окисление.
Выделение тех или иных продуктов на электродах происходит в результате окислительно-восстановительных процессов, которые в электрохимии называются процессами разряда или просто разрядом. Значение потенциала электрода, при котором происходит разряд называется потенциалом (напряжением) разложения. Из нескольких возможных процессов в первую очередь будет протекать тот, осуществление которого сопряжено с меньшей затратой энергии.
На катоде в первую очередь будут восстанавливаться те системы, потенциал разложения которых менее отрицателен (или более положителен), а на аноде в первую очередь будут окисляться системы с менее положительным напряжением разложения (рис. 5.5). Последовательность процессов идёт от начала стрелок.

Рис. 5.5. Направление последовательности процессов при электролизе
В случае водных растворов электролитов в электродных процессах принимает участие вода, причём, характер процесса зависит от реакции среды. В первом приближении, при электролизе воды, а также водных растворов щелочей и кислородсодержащих кислот на катоде выделяется водород, а на аноде ─ кислород.
На катоде при электролизе растворов солей наиболее активных металлов выделяется водород, эти металлы в свободном состоянии нельзя получить электролизом водных растворов их солей. Цинк и менее активные металлы можно получить при электролизе их водных растворов (табл. 5.3). Выделение менее активных металлов на катоде также может сопровождаться выделением водорода.
Анодный процесс в первую очередь определяется материалом анода. Очень часто в качестве анода используют Zn, Cr, Fe, Cd, Ni, Cu, Ag, это растворимые аноды, т.е. идёт окисление анода по схеме: Ме 0 ─ n ē → Ме n+ .
Применяются также нерастворимые (инертные) аноды: угольные, графитовые, платиновые. На таких анодах могут разряжаться простые анионы в следующей последовательности: S2‾, J‾ Br‾, Cl‾. Кислородсодержащие ионы, например: NO3‾, SO4‾, а также F‾ в водных растворах не разряжаются, вместо них окисляется Н2О или ОН ¯ (табл. 5.4).
Таблица 5.3
Последовательность процессов на катоде
Катионы раствора |
Li+ K+ Ca2+ Mg2+ Al3+ Mn2+ Ti2+ |
Zn2+ Cr3+ Fe2+ Cd2+ Ni2+ Sn2+ Cu2+ Ag+ |
Процесс на катоде |
2Н2О + 2ē → Н2 + 2ОН¯ |
Men+ + nē → Me0 |
Таблица 5.4
Последовательность процессов на аноде
Анод |
Вид аниона |
Процесс, продукты электролиза |
|
Растворимый (Fe, Ni, Cu, Ag …) |
любой |
Ме 0 − n ē → Ме n+ (Fe2+, Ni2+, Sn2+, Cu2+, Ag+, …) |
|
Нерастворимый (инертный) (C, Pt) |
S 2¯, J¯, Br ¯, Cl ¯
|
Эn− − nē → Э0 Последовательность разряда: S2‾→J‾→ Br‾→ Cl‾ S0, J2, Br2, Cl2 |
|
NO3¯, SO4¯, F ¯ |
кислая среда |
2Н2О − 4ē → О2 + 4Н+ |
|
щелочная среда |
4ОН¯− 4ē → О2 + 2Н2О |
||
Простейшая установка для проведения электролиза в лабораторных условиях имеет вид, показанный на рис. 5.6.

Рис. 5.6. Схема установки для проведения электролиза
Пример 5.6. Рассмотрим электролиз раствора хлорида железа (II) с угольными электродами (рис. 5.7). Это пример электролиза с инертным (нерастворимым) анодом.

Рис.5.7. Схема электролиза раствора хлорида железа (II)
В растворе соль диссоциирует на ионы: FeCl2 → Fe 2+ + 2 Cl‾. На катоде происходит разряд ионов Fe 2+ и выделение металлического железа Fe 2++ 2 ē → Fe 0. У анода разряжаются хлорид-ионы: 2 Cl‾ – 2 ē → Cl 2.
В зависимости от условий электролиза в качестве побочного продукта на катоде может выделяться водород.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Электролиз раствора хлорида олова (II) с угольными электродами
В электролизёр (рис. 5.6) с раствором SnCl2 помещаются два угольных электрода, включается прибор и пропускается постоянный электрический ток, под действием которого происходят процессы восстановления на катоде, подключённому к отрицательному полюсу и окисления на аноде, подключённому к положительному полюсу. По окончании электролиза на катоде видны большие кристаллы выделившегося металлического олова.
В растворе дихлорид олова диссоциирует на ионы олова и хлорид-ионы. Положительно заряженные ионы олова перемещаются к отрицательно заряженному катоду и на нём разряжаются, т.е. восстанавливаются до металлического олова. Следовательно, на катоде выделяется металл. Олово относится к не очень активным металлам, а поэтому может быть получено в свободном состоянии при электролизе водного раствора своей соли. При определённом режиме электролиза одновременно с оловом может выделяться водород вследствие разряда молекул воды.
К положительно заряженному аноду перемещаются хлорид-ионы, происходит их окисление до молекулярного хлора. Угольный анод относится к инертным анодам и не окисляется (рис. 5.8).

Рис. 5.8. Схема электролиза SnCl2 с инертным анодом
При электролизе водного раствора хлорида олова (II) с инертным анодом:
· на катоде выделяется металлическое олово,
· на аноде выделяется газообразный хлор.
Электролиз раствора йодида калия с угольными электродами
В раствор йодида калия, налитый в электролизёр, добавляется по несколько капель фенолфталеина и крахмала. В электролит помещаются угольные электроды, которые подключаются к источнику постоянного тока и проводится электролиз.
На катоде наблюдается выделение газа и через некоторое время в прикатодном пространстве появляется розовое окрашивание фенолфталеина, что свидетельствует о щелочной реакции среды. В то же время синяя окраска крахмала в прианодном пространстве указывает на выделение свободного йода.
К катоду перемещаются катионы калия, имеющие потенциал разряда значительно более отрицательный, чем потенциал разряда воды, поэтому на катоде происходит разряд воды. Наряду с выделением водорода происходит накопление в прикатодном пространстве гидроксильных ионов, окрашивающих фенолфталеин в розовый цвет.
На инертном (угольном) аноде разряжаются йодид-анионы, выделяется свободный йод, которому соответствует качественная реакция с крахмалом, сопровождающаяся синим окрашиванием (рис. 5.9).
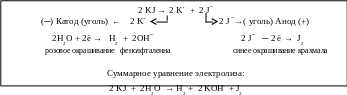
Рис. 5.9. Схема электролиза KJ с инертным анодом
Электролиз водного раствора йодида калия с инертным анодом сопровождается:
· на катоде выделением водорода и подщелачиванием раствора;
· на аноде выделением йода.
Электролиз раствора сульфата меди с медным анодом
В раствор сульфата меди помещаются медный (растворимый) анод, медный катод и проводится электролиз. Через несколько минут ток отключается и при осмотре угольного катода отмечается выделение на нём меди.
Составьте схему процесса электролиза сульфата меди с медным анодом: покажите направление движения ионов к электродам, составьте уравнения катодного и анодного процесса, напишите суммарное уравнение электролиза.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Какие изменения будут происходить с электродами в результате электролиза?
________________________________________________________________________________________________________________________________________________________________
Электролиз раствора сульфата меди с инертным анодом
В раствор сульфата меди помещаются угольный (нерастворимый) анод, угольный катод и проводится электролиз. На угольном аноде выделятся газ, а на катоде – медь.
Составьте схему процесса электролиза: покажите направление движения ионов к электродам, укажите, из какого материала состоят электроды, составьте уравнения катодного и анодного процесса, напишите суммарное уравнение электролиза.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оказывает ли материал катода на суть катодного процесса? ______________________
Какой процесс идёт на нерастворимом аноде? _________________________________
Как влияет природа аниона на процесс на аноде? ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 5.7. При электролизе раствора, содержащего нитраты серебра, меди (II), свинца и натрия в стандартных условиях последовательность выделения веществ на катоде следующая:
1) Ag, Pb, Cu, Na 2) Ag, Pb, Cu, H2, Na 3) Ag, Pb, Cu, H2 4) Ag, Cu, Pb, H2
Решение. Относительное положение металлов в ряду активности следующее:
Na … Pb… Cu … Ag.
Последовательность их разряда обратная, причём щелочной металл натрий из водных растворов не восстанавливается и вместо него выделяется водород (табл. 5.3)..
Правильный ответ: 4.
Упражнение 5.5. При электролизе раствора, содержащего нитраты меди (II), серебра, никеля и кальция в стандартных условиях, последовательность выделения веществ на катоде имеет вид …
1) Ag, Ni, Cu, Сa 2) Ag, Cu, Ni, H2, Сa 3) Ag, Cu, Ni, H2 4) Ag, Ni, Cu, H2
Упражнение 5.6. Продуктами, выделяющимися на инертных электродах при электролизе водного раствора серной кислоты, являются …
1) Н2 и SO2 2) O2 и SO2 3) H2 и S 4) H2 и O2
Для решения воспользуйтесь табл. 5.3 и табл. 5.4.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. Продуктами, выделяющимися на инертных электродах при электролизе водного раствора хлорида калия, являются …
1) K и Cl2 2) H2 и Сl2 3) H2 и O2 4) K и O2
2. Продуктами, выделяющимися на инертных электродах при электролизе водного раствора сульфата натрия, являются …
1) Na и SO2 2) H2 и S 3) H2 и O2 4) Na и O2
3. Металлом, который нельзя получить электролизом раствора его соли, является …
1) Al 2) Cr 3) Pb 4) Ag
4. Уравнение процесса протекающего на инертном катоде при электролизе водного раствора гидроксида натрия, имеет вид …
1) 2H+ + 2e → H2 2) 2H2O – 4e → O2 + 4H+
2) 2H2O + 2e → H2 + 2OH ˉ 4) Na+ + e → Na
5. Уравнение процесса, протекающего на инертном аноде при электролизе водного раствора CaCl2, имеет вид.. 1) 2H2O – 4e → O2 + 4H+ 2) 4OH ˉ − 4e → O2 + 2H2O
3) Сa2+ + 2e → Сa0 4) 2Cl ˉ − 2e →Cl2
