
- •Часть II рабочая тетрадь
- •Введение
- •1.1. Строение атома и периодическая система
- •1. 2. Химическая связь
- •2.1. Основы химической термодинамики
- •2.2. Химическая кинетика
- •Зависимость скорости реакции от температуры
- •2.3. Химическое равновесие
- •И стехиометрические расчёты
- •Характерные реакции оснóвных оксидов
- •4.1. Общие свойства растворов
- •4.2. Равновесия в растворах электролитов
- •Ионно-молекулярные реакции в растворах электролитов
- •Методы определения рН растворов
- •Гидролиз солей
- •5.1. Окислительно-восстановительные процессы
- •5.3. Электролиз
- •5.4. Коррозия металлов
- •Защитные покрытия
- •Электрохимические методы
- •6.1. Качественный химический анализ
- •6.2. Количественный химический анализ
- •6.3. Физико-химические и физические методы анализа
- •7.1. Общие сведения и методы получения полимеров
- •7.3. Природные полимеры
- •Библиографический список
- •Заключение
Методы определения рН растворов
Теоретические сведения
В любом водном растворе при 22 0С произведение концентраций ионов воды (ионное произведение воды – КW) является величиной постоянной:
КW = [Н+] ∙ [OH─] = 10–14, (4.8)
где [Н+] ─ равновесная концентрация ионов Н+;
[OH─] ─ равновесная концентрация ионов ОН─.
В нейтральной среде [Н+] = [OH‾] = 10–7 моль/л;
в кислой среде [Н+] > [OH─] , т.е. [Н+] >10–7 моль/л, например [Н+] = 10–6 моль/л;
в щелочной среде [Н+] < [OH─], т.е. [Н+] < 10–7 моль/л, например [Н+] = 10–8 моль/л.
Реакция среды характеризуется через водородный показатель pH = ─ lg [Н+]. (4.9)
При решении задач будем пользоваться формулой pН = – lg сH+ . В более точных расчётах следует пользоваться активностью ─ pН = – lg аH+ , где аH+ − активность ионов водорода.
Если подставить значения концентраций ионов водорода сH+, полученные в вышеприведённом примере, в формулу для вычисления рН, то получим:
в нейтральной среде: рН = ─ lg 10–7 = 7;
в кислой среде: рН = ─ lg 10–6 = 6, (рН < 7);
в щелочной среде: рН = ─ lg 10–8 = 8, (рН > 7).
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Колориметрический метод определения рН
В пробирки с водой (нейтральная среда) добавляются растворы индикаторов и наблюдается соответствующая окраска растворов. Затем содержимое пробирок делится на две части и в одних пробирках среду делают кислой, добавляя кислоту, а в других − щелочной. Наблюдаемое изменение цвета (лат. color цвет) растворов показано на рис. 4.4.
Более точные результаты определения рН среды даёт универсальная индикаторная бумага, где точность определения составляет ± единица рН. Современные приборы: иономеры и рН-метры имеют погрешность измерения ± 0,05 рН и меньше.
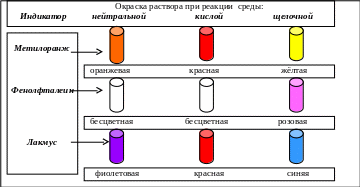
Рис. 4.4. Окраска некоторых индикаторов в нейтральной, кислой и щелочной среде
Пример 4.11. При разбавлении 0,5 М раствора соляной кислоты в пять раз, рН будет иметь значение, равное ... 1) 1 2) 10 3) 12 4) 5
Решение. После разбавления раствора соляной кислоты, имеющей концентрацию 0,5 моль/л в пять раз, концентрация раствора будет 0,1 моль/л. Соляная кислота является кислотой сильной, для неё степень диссоциации α = 1, поэтому концентрация ионов водорода сH+ = 0,1 моль/л = 10 ‾1 моль/л. Тогда в соответствии с формулой 4.9:
pН = – lg сH+ = – lg 10 ‾1 = 1.
Правильный ответ: 1.
Упражнение 4.8. При разбавлении 0,2 М раствора соляной кислоты в два раза, рН будет иметь значение, равное ... 1) 1 2) 13 3) 14 4) 4
________________________________________________________________________________________________________________________________________________________________
Пример 4.12. В 0,1 М растворе гидроксида калия рН будет иметь значение, равное ...
1) 1 2) 14 3) 13 4) 0,1
Решение. В соответствии со схемой диссоциации сильного основания
КОН → К+ + ОН‾
с ОН‾ = 0,1 моль/л. По формуле 4.8 находим концентрацию ионов водорода:
сH+ = (10 ‾14) : с ОН‾ = (10 ‾14) : 10 ‾1 = 10 ‾13.
Значение рН вычисляем по формуле 4.9: pН = – lg сH+ = – lg 10 ‾13 = 13.
Правильный ответ: 3.
Упражнение 4.9. При разбавлении 0,03 М раствора гидроксида натрия в три раза, рН будет иметь значение, равное ... 1) 3 2) 12 3) 13 4) 14
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
