
- •Часть II рабочая тетрадь
- •Введение
- •1.1. Строение атома и периодическая система
- •1. 2. Химическая связь
- •2.1. Основы химической термодинамики
- •2.2. Химическая кинетика
- •Зависимость скорости реакции от температуры
- •2.3. Химическое равновесие
- •И стехиометрические расчёты
- •Характерные реакции оснóвных оксидов
- •4.1. Общие свойства растворов
- •4.2. Равновесия в растворах электролитов
- •Ионно-молекулярные реакции в растворах электролитов
- •Методы определения рН растворов
- •Гидролиз солей
- •5.1. Окислительно-восстановительные процессы
- •5.3. Электролиз
- •5.4. Коррозия металлов
- •Защитные покрытия
- •Электрохимические методы
- •6.1. Качественный химический анализ
- •6.2. Количественный химический анализ
- •6.3. Физико-химические и физические методы анализа
- •7.1. Общие сведения и методы получения полимеров
- •7.3. Природные полимеры
- •Библиографический список
- •Заключение
4.1. Общие свойства растворов
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Общие свойства растворов» [Конспект лекций, раздел 4.1]
Цель выполнения задания
· Ознакомиться со способами выражения состава растворов.
· Научиться вести простейшие расчёты по приготовлению растворов.
· Рассмотреть причины, приводящие к изменению температур кипения и замерзания растворов, а также суть осмоса.
Теоретические сведения
Растворами называются гомогенные, самопроизвольно образовавшиеся системы переменного состава. Растворы состоят из растворителя и одного или нескольких растворённых веществ, особенно важное значение имеют водные растворы. Образование растворов ─ сложный физико-химический процесс, в котором наблюдаются как физические (непостоянство состава, диффузия), так и химические (образование неустойчивых соединений непостоянного состава) явления.
Вся совокупность процессов, приводящих к появлению растворяемого вещества в растворе, называется сольватацией. Если растворителем является вода, то говорят о гидратации.
Состав раствора выражается через соотношение растворителя и растворённого вещества. Ниже приводятся наиболее часто используемые способы выражения состава раствора.
Молярная концентрация:
![]() Например, 0,1 M
HCl.
(4.1)
Например, 0,1 M
HCl.
(4.1)
Массовая доля:
![]() .
(4.2)
.
(4.2)
Сумма: m1 + m2 = m раствора
Моляльность:
![]() (4.3)
(4.3)
Условные обозначения:
m1 − масса растворителя, г; m2 − масса растворённого вещества, г;
М2 ─ молярная масса растворённого вещества, г/ моль; V ─ объём раствора, л.
Общими называют свойства растворов, которые зависят от концентрации и практически не зависят от природы растворённых веществ. При рассмотрении общих свойств растворов условно принимается, что растворённое вещество является нелетучим неэлектролитом, т.е. не испаряется и не диссоциирует на ионы.
Давление насыщенного пара растворителя (воды) над чистым растворителем повышается с ростом температуры (рис. 4.1). Условием кипения жидкости является равенство давления её насыщенных паров атмосферному давлению, вода закипает при 100 0С.
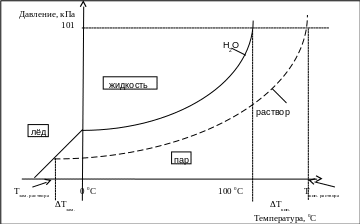
Рис. 4.1. Схема, поясняющая понижение температуры замерзания и
повышение температуры кипения раствора
Ф. Рауль установил, что давление насыщенного пара растворителя над раствором нелетучего вещества ниже, чем над чистым растворителем, что приводит к повышению температуры кипения таких растворов:
![]() (4.4)
(4.4)
где ΔТ кипения − повышение температуры кипения, градус;
Е (Н2О) − эбулиоскопическая постоянная воды, (градус · кг) / моль;
сm − моляльная концентрация раствора, моль/кг.
Условием кристаллизации является равенство давления насыщенного пара над твёрдой и жидкой фазой. Над растворами давление пара ниже, чем над чистым растворителем и поэтому растворы замерзают при более низкой температуре (рис. 4.1). Понижение температуры замерзания пропорционально моляльной концентрации растворённого вещества (с m ):
![]() (4.5)
(4.5)
где ΔТ замерзания − понижение температуры кипения, градус;
К (Н2О) − криоскопическая постоянная воды, (градус · кг) / моль;
сm − моляльная концентрация раствора, моль/кг.
Осмос ─ это диффузия вещества через полупроницаемую мембрану, через которую проходит растворитель, но не проходят растворённые вещества. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, который разбавляется и высота его столба (h) увеличивается (рис. 4.2).
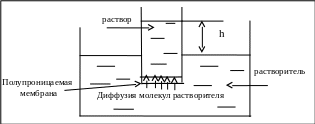
Рис. 4.2. Схема осмометра
Внешнее давление, которое нужно приложить, чтобы осмос прекратился, называется осмотическим и обозначается π (или росмот.). Экспериментально было найдено, что осмотическое давление пропорционально молярной концентрации раствора (см) и температуре (Т, К):
π = cм R T, (4.6)
где R ─ универсальная газовая постоянная, равная 8,31 Дж/(моль·К).
Это уравнение называют законом Вант-Гоффа. В таком виде оно применимо только к растворам неэлектролитов.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Пример 4.1. Для приготовления 700 г раствора с массовой долей иодида калия 5 % необходимо растворить ___ граммов соли 1) 84 2) 50 3) 35 4) 65
Решение. Из формулы 4.2 следует, что
m2 = (ω · m раствора ) : 100 % = (5 % · 700 г) : 100 % = 35 г.
Правильный ответ 3.
Упражнение 4.1. Для приготовления 200 г раствора с массовой долей хлорида калия 8 % навеску соли необходимо растворить в ___ граммах воды
1) 84 2) 192 3) 184 4) 92
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.2. В растворе хлорида калия объёмом 1,0 л и концентрацией 0,01 моль/л содержится ___ граммов вещества
1) 0,75 2) 7,5 3) 0,075 4) 75
Решение. Молярная масса хлорида калия равна 75 г/моль. В соответствии с формулой 4.1:
m KCl = CM· V· M2 = 0.01 моль/л · 1,0 л · 75 г/моль = 0.75 г.
Правильный ответ 1.
Упражнение 4.2. Молярная концентрация раствора сульфата натрия, в 50 мл раствора которого содержится 14,2 г данной соли, равна ________ моль/л
1) 0,02 2) 2 3) 0,2 4) 0,1
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.3. Рассчитать массу мочевины СО(NH2)2, необходимую для удаления с дорожного полотна льда массой, соответствующей 50 кг жидкой воды, если криоскопическая постоянная воды (КН2О) равна 1,86 (градус · кг) / моль. Температура окружающей среды минус 5 0С.
Решение. Понижение температуры Δ Т замерзания = 0 0С ─ (─ 5 0С) = 5 0С.
Для расчёта воспользуемся формулой
4.5:
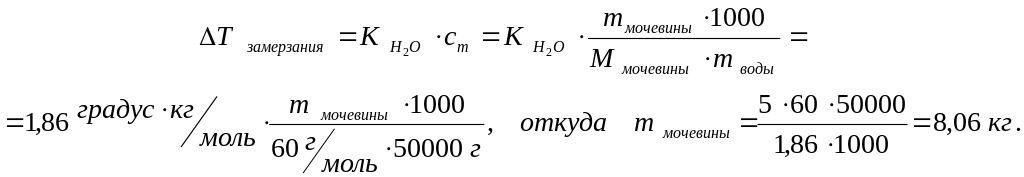
Упражнение 4.3. Для повышения температуры кипения раствора на 1,04 0С, необходимо, чтобы концентрация растворённого в нём неэлектролита составляла ___ моль/кг
(Е (Н2О)) = 0,52 (град · кг)/моль)
1) 0,2 2) 2 3) 1 4) 0,1
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.4. Для понижения температуры замерзания раствора на 3,72 0С, необходимо, чтобы концентрация растворённого в нём неэлектролита составляла ________ моль/кг (К (Н2О) = 1,86 (град · кг)/моль) 1) 1 2) 2 3) 0,2 4) 0,1
Решение. Понижение температуры замерзания неэлектролита вычисляется по формуле 4.5:
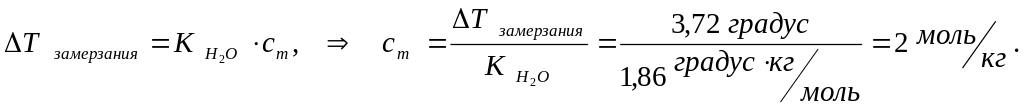
Правильный ответ 2.
Упражнение 4.4. Раствор, содержащий 18 г глюкозы (Мr = 180) в 100 г воды замерзает при температуре _______ 0С (К (Н2О) = 1,86 (град · кг)/моль)
1) + 1,86 2) 0,93 3) − 1,86 4) − 0,93
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.5. Осмотическое давление раствора этанола с молярной концентрацией 1,0 моль/л при 25 0С равно ____ кПа
1) 207,8 2) 2476 3) 247,6 4) 2078
Решение. В соответствии с формулой 4.6:
π = cм R T = 1,0 моль/л · 8,31 Дж/(моль·К) · (273 + 25) К = 2476 Дж/л = 2476 кПа.
Правильный ответ 2.
Упражнение 4.5. Осмотическое давление раствора неэлектролита с молярной концентрацией 0,2 моль/л при 20 0С равно __________ кПа
1) 487 2) 33.2 3) 332 4) 4870
________________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. Моляльная концентрация растворённого вещества может быть выражена в
1) моль/кг 2) моль/л 3) г/моль 4) процентах
2. В 50 мл 1 М ZnSO4 содержится ___ грамм(ов) вещества
1) 161 2) 8,05 3) 80,5 4) 16,1
3. Понижение температуры замерзания раствора неэлектролита может быть рассчитано по формуле:
1) ΔТ = i · К Н2О ·cm 2) p = с·R·Т 3) p = i ·с·R·Т 4) ΔТ = К Н2О ·cm
4. Уравнение р осмот. = с·R·Т (закон Вант-Гоффа), характеризующее зависимость осмотического давления от концентрации и температуры, применимо
1) только к растворам сильных электролитов 2) к любым растворам
3) к растворам слабых электролитов 4) только к растворам неэлектролитов
5. Температура кипения ацетона 56 0С. Если в 250 г ацетона растворить 6,4 г метанола (Мr = 32, Е ацетона = 1,5 (град · кг)/моль), то температура кипения раствора составит
1) 55,4 2) 57,2 3) 54,8 4) 56,6
6. Температура замерзания раствора, содержащего 46 г глицерина (Мr = 92) в 250 г воды (К Н2О = 1,86 (град · кг)/моль) равна _____ 0С
1) − 3,72 2) +3,72 3) − 0,186 4) − 0,93
