
Учебники / Лекции по термодинамике неравновесных систем. Пармон
.pdf4.6. (3 / 8–02). Могут ли возникнуть осцилляции или иные виды неустойчивости по интермедиатам при протекании автокаталитической брутто-реакции А + 2 В → 3 В, осуществляющейся по схеме
А 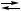 X,
X,
X 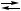 Y,
Y,
Y + 2 B 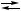 3 B,
3 B,
где X и Y – интермедиаты? Реакция протекает при температуре 300 К; сродство брутто-реакции 20 кДж / моль. Ответ аргументируйте.
4.7. (3 / 12–02). Могут ли возникнуть осцилляции или иные виды неустойчивости по интермедиатам при протекании автокаталитической брутто-реакции А + В → 2 В + C, осуществляющейся по схеме
А 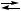 2 X + C,
2 X + C,
2 X + B 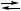 2 B,
2 B,
где X – интермедиат? Реакция протекает при температуре 300 К; сродство брутто-реакции 20 кДж / моль. Ответ аргументируйте.
4.8. (3 / 10–02). Могут ли возникнуть осцилляции или иные виды неустойчивости по интермедиатам при протекании автокаталитической брутто-реакции А + В → 2 В + С, осуществляющейся по схеме
А  2 X,
2 X,
2 X 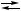 Y + С,
Y + С,
Y + B  2 B,
2 B,
где X и Y – интермедиаты? Реакция протекает при температуре 300 К; сродство брутто-реакции 20 кДж / моль. Ответ аргументируйте.
270


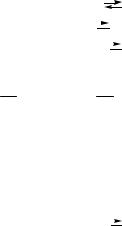


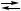 3 X,
3 X,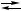 B,
B,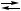 X,
X,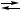 Y + 2 B,
Y + 2 B,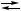 X + B,
X + B, X,
X, 3 B,
3 B,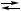 X,
X,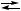 Y + 2 B,
Y + 2 B, X + B,
X + B, X,
X, Y,
Y, 2 X + B,
2 X + B,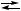 X,
X,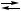 Y + B,
Y + B, 2 X + B,
2 X + B,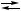 X + Y,
X + Y,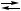 2 X + B,
2 X + B,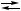 CO + 3 H
CO + 3 H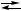 CO
CO
 CO
CO AgCl↓ + NO
AgCl↓ + NO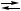 {X
{X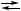 2 Ag + 2H
2 Ag + 2H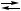 AgCl↓,
AgCl↓,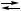 {X
{X Ag + H
Ag + H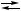 C + 2 H
C + 2 H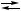 C + CO
C + CO
 B + C,
B + C,


 B + C,
B + C,

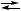 B + C + D,
B + C + D,
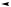
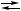 B + C + D,
B + C + D, B + C,
B + C,