
- •Лекции №13-15 алкены
- •Изомерия и номенклатура алкенов
- •Методы получения алкенов
- •Физические свойства алкенов
- •Химические свойства
- •Реакция гидрирования.
- •2. Реакции электрофильного присоединения по двойной связи алкенов.
- •С другой стороны, ряд реакционной способности галогеноводородов
- •3. Взаимодействие с катионами металлов.
- •4. Гидроборирование алкенов.
- •5. Взаимодействие с с-электрофилами.
- •6. Реакции циклоприсоединения.
- •7. Реакции окисления алкенов.
- •8. Реакции полимеризации.
- •9. Гидроформилирование или оксосинтез
- •10. Радикальные реакции алкенов.
С другой стороны, ряд реакционной способности галогеноводородов
HI > HBr > HCl > HF
определяется кислотностью этих реагентов. Действительно, из рассмотрения скорость-определяющей стадии можно видеть, что при образовании -комплексов реализуется кислотность этих реагентов.
В случае Н-электрофилов, обладающих слабой кислотностью (Н2О, ROH, RSH и др.) для эффективного осуществления реакций присоединения используется кислотный катализ и более жесткие условия реакций. Так, например, реакции гидратации алкенов, осуществляемые в промышленном масштабе (синтез этанола и изопропанола), проводит в паровой фазе при температура около 300оС, давлениях 5-7мПа в присутствии фосфорной кислоты на Al2O3 или другом носителе. Роль катализатора может выполнять -Al2O3, содержащий протонные кислотные центры. Механизм этих реакций может быть проиллюстрирован на примере гидратации пропена

Суммирование левых и правых частей этих стадий приводит к стехиометрическому уравнению реакции гидратации
CH3CH=CH2 + H2O CH3CH-OH-CH3
Основная реакция осложняется протеканием двух побочных реакций:
- полимеризации
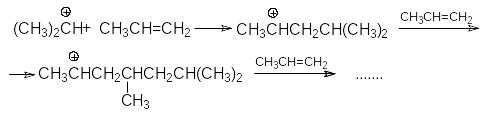
-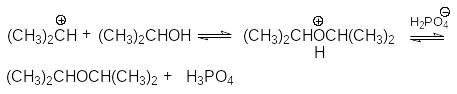 и образование простых эфиров
и образование простых эфиров
В кратком виде основную и побочные реакции можно представить системой конкурирующих реакций.
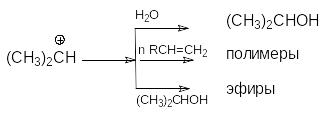
Из приведенной схемы видно, что факторами подавления побочных реакций являются: использование избытка водяного пара и снижение конверсии (концентрации спирта).
П орядок
присоединения Н-электрофилов определяется
правилом Марковникова, согласно которому
водород Н-электрофила присоединяется
к наиболее гидрированному атому. Причиной
такого характера присоединения является
большая энергетическая стабильность
карбокатиона, образующегося при
присоединении протона к более
гидрированному углеродному атому
двойной связи. Можно видеть, что дилемма
образования карбокатионов в рассмотренном
примере
орядок
присоединения Н-электрофилов определяется
правилом Марковникова, согласно которому
водород Н-электрофила присоединяется
к наиболее гидрированному атому. Причиной
такого характера присоединения является
большая энергетическая стабильность
карбокатиона, образующегося при
присоединении протона к более
гидрированному углеродному атому
двойной связи. Можно видеть, что дилемма
образования карбокатионов в рассмотренном
примере
решается в пользу первого, стабилизированного индуктивным эффектом алкильных групп и эффектом снятия стерических напряжений. Соответственно, более предпочтительное образование карбокатиона R-CH-CH3 обусловливает образование продукта R-CHX-CH3.
В связи с этим современная трактовка правила Марковникова звучит следующим образом: присоединение протона электрофила к алкену происходит в направлении образования наиболее стабильного карбкатиона. Такая формулировка объясняет, почему алкены, содержащие сильные электроноакцепторные заместители присоединяют Н-электрофилы против правила Морковникова в его классическом понимании.
CH2=CH-COOH + HBr Br-CH2CH2-COOH
акриловая кислота -бромпропионовая кислота
П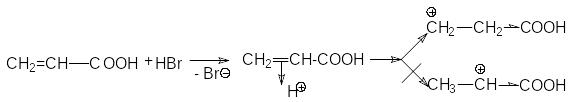 ри
взаимодействии акриловой кислоты с HBr
можно представить два варианта
присоединения протона.
ри
взаимодействии акриловой кислоты с HBr
можно представить два варианта
присоединения протона.
Можно
видеть, что второй карбкатион существенно
дестабилизирован электроноакцепторной
карбоксильной группой, поэтому его
образование энергетически невыгодно.
Предпочтительным является образование
карбкатиона
![]() ,
который и дает продукт присоединения
Br-CH2CH2COOH.
,
который и дает продукт присоединения
Br-CH2CH2COOH.
Обращение правила Мaрковникова имеет место в случае свободнорадикального гидробромирования алкенов. Условием свободнорадикального процесса является использования инициаторов радикальных реакций, таких как пероксид водорода, органические гидропероксиды, пероксиды и др.
RCH=CH2 +HBr H2O2[ROOH];((((((((( RCH2CH2Br
Характер образующегося продукта может быть обоснован в рамках свободнорадикального механизма гидробромирования.
H2O2 2HO
HO+ HBr H2O + Br
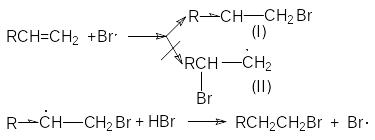
Можно видеть, что радикал I обладает большей стабильностью за счет действия двух эффектов: индуктивного и снятия стерических напряжений. Это обусловливает его предпочтительное образование и, как следствие, образование продукта присоединения против правила Мaрковникова.
