
- •Лекции №13-15 алкены
- •Изомерия и номенклатура алкенов
- •Методы получения алкенов
- •Физические свойства алкенов
- •Химические свойства
- •Реакция гидрирования.
- •2. Реакции электрофильного присоединения по двойной связи алкенов.
- •С другой стороны, ряд реакционной способности галогеноводородов
- •3. Взаимодействие с катионами металлов.
- •4. Гидроборирование алкенов.
- •5. Взаимодействие с с-электрофилами.
- •6. Реакции циклоприсоединения.
- •7. Реакции окисления алкенов.
- •8. Реакции полимеризации.
- •9. Гидроформилирование или оксосинтез
- •10. Радикальные реакции алкенов.
Физические свойства алкенов
Алкены С2-С4- газы, следующие за ними члены гомологического ряда - бесцветные жидкости или кристаллические вещества.
Плотность алкенов выше по сравнению с алканами с тем же числом углеродных атомов. Это обусловлено более сильными межмолекулярными взаимодействиями в алкенах причиной которых являются высокая поляризуемость двойной связи: так RC-C=1,29 a RC=C=4,17.
В![]() ысокая
поляризуемость двойной связи обусловливает
ее значительное поляризацию под действием
полярных групп.
ысокая
поляризуемость двойной связи обусловливает
ее значительное поляризацию под действием
полярных групп.
Введение алкильных групп у двойной связи увеличивает стабильность молекул алкенов. Это можно проиллюстрировать различием в теплотах гидрирования соответствующих алкенов.
CH2=CH-CH2CH3 + H2 CH3CH2CH2CH3 + 127 кДж
Транс- CH3-CH=CH-CH3 + H2 CH3CH2CH2CH3 + 115 кДж
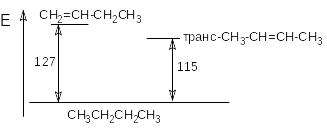
Такое различие можно проиллюстрировать энергетической диаграммой.
Можно видеть, что транс-псевдобутилену соответствует более низкий уровень энергии и, следовательно, более высокая стабильность.
Электронографическое изучение этилена показало, что геометрия молекулы резко отличается от пространственного строения алканов. Молекула этилена плоская. Углы между связями близки к 120о, связь С=С намного короче связи С-С. Потенциал ионизации в алкенах на 1-1,5 эв меньше, чем у соответствующих алканов, что свидетельствует об электронодонорных свойствах двойной связи.
Подвижность -электронной системы отражается в электронных спектрах поглощения. Максимум поглощения находится в более длинноволновой области спектра (180-200 нм), чем у алканов. Это связано с переходом электронов со связывающей на разрыхляющую -орбиталь *.
В колебательных спектрах кроме поглощения алкильных групп наблюдаются валентные колебания двойной связи при 1640-1660 см-1 и связи =С-Н при 3000-3100 см-1, а также деформационные колебания =С-Н - связи при 890-980 см-1. В спектрах ПМР характерны сигналы при 5,5-6 м.д. соответствующие протонам
Н -С=.
-С=.
Химические свойства
Химические свойства алкенов определяются рядом факторов: относительно слабой -связью в двойной связи, поляризуемостью последней, электронодонорными свойствами двойной связи, способностью ее к сопряжению с реакционным центром, возникающим при -углеродном атоме.
Поэтому естественными реакциями алкенов являются реакции присоединения, среди которых наиболее представительными являются реакции электрофильного присоединения, а также реакции замещения, в которых подвижными являются атомы и группы при -углеродном атоме по отношению к двойной связи.
Реакция гидрирования.
Реакции гидрирования алкенов являются иллюстрацией ненасыщенного характера алкенов в силу отмеченной выше слабости -связи. Последняя легко рвется под действием гидрирующего агента и по освобождающимся валентностям присоединяются атомы водорода.
RCH=CH2 + H2 cat;((( R-CH2-CH3
В качестве катализаторов используют Pd, Pt, Ni, нанесенные на пористые носители: -AI2O3, SiO2, алюмосиликаты, активированный уголь.
П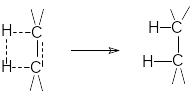 рисоединение
водорода происходит в цис-положение.
Такой характер присоединения обусловлен
геометрией активированного комплекса
на реакции гидрирования на поверхности
катализатора:
рисоединение
водорода происходит в цис-положение.
Такой характер присоединения обусловлен
геометрией активированного комплекса
на реакции гидрирования на поверхности
катализатора:
Экспериментальное подтверждение этого является образование цис-1,2-диметилциклогексана при гидрировании 1,2-диметилциклогексена
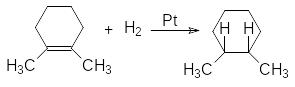
Гидрирование на металлических катализаторов часто осложняется изомеризацией алкенов и разрывом простых углерод-углеродных связей.
Более удобными в этом отношении являются катализаторы гомогенного гидрирования – комплексы хлоридов родия или рутения с трифенилфосфином (C6H5)3P (катализаторы Уилкинcона), например, хлорид трис-(трифенилфосфин)родия, получаемый при взаимодействии хлорида родия (III) с трифенилфосфином.
RhCl3 + 3(C6H5)3P этанол;t;((((( [(C6H5)3P]3RhCl
Л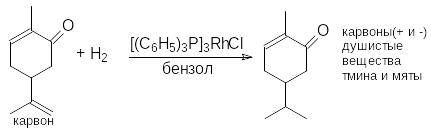 егкость
гидрирования в этих реакциях зависит
от степени замещения при двойной связи:
чем больше степень замещения, тем
медленнее гидририруется двойная связь.
Это открывает возможность селективного
гидрирования соединений, содержащих
различные по степени замещенности
двойные связи:
егкость
гидрирования в этих реакциях зависит
от степени замещения при двойной связи:
чем больше степень замещения, тем
медленнее гидририруется двойная связь.
Это открывает возможность селективного
гидрирования соединений, содержащих
различные по степени замещенности
двойные связи:
Можно видеть, что замещенная двойная связь и карбонильная группа не подвергаются гидированию.
Показано, что гомогенное гидрирование в присутствии указанных катализаторов происходит в цис-положение.
Недостаток катализаторов Уилкинсона – невозможность его использования для гидрирования соединений, содержащих альдегидную группу из-за осложнений основной реакции декарбонилированием
RCHO RH + CO
