
Лекции / Лекция_10
.DOC
Лекция № 10
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ И РЕАГЕНТОВ
План
Классификация органических реакций по степени сложности.
Элементарные реакции, их классификация.
Классификация реагентов.
Типы интермедиатов.
Понятие о скорость-определяющей стадии и переходном состоянии реакции.
Органические реакции характеризуются различными сторонами. Соответственно, эти реакции могут быть по-разному классифицированы в зависимости от того, какая из сторон взята за основу.
В зависимости от степени сложности органические (да и другие) реакции могут быть подразделены на простые и сложные.
Простыми называются реакции, в которых не образуются в измеримых количествах какие-либо вещества, кроме тех, которые фигурируют в стехиометрическом уравнении:
AA + BB + XX + YY (1)
Простые реакции могут быть обратимыми и необратимыми.
Сложные реакции представляют собой совокупность простых реакций. Очевидно, что соотношение между реагентами и продуктами каждой простой реакции, входящей в сложную, не подчиняются ее стехиометрическому уравнению, поскольку продукты или реагенты этой реакции одновременно вовлекаются в другие простые реакции.
Иллюстрацией сложной реакции является схема:
1 2
AA BB CC
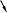 3
3
DD
в которой реакции 1 и 2 являются последовательными, а реакции 1 и 3 – параллельными. Можно видеть, что последовательными реакциями являются такие, в которых продукт одной реакции является реагентом для следующей за ней другой реакции. В то же время параллельные – это такие реакции, в которых участвует один и тот же реагент. Последовательно-параллельные реакции имеют признаки обеих реакций:
![]()
В свою очередь простые реакции подразделяются на элементарные и неэлементарные. Элементарные реакции протекают через одну микростадию и характеризуются единственным переходным состоянием. Неэлементарные реакции протекают через ряд химических микростадий, в которых участвуют промежуточные комплексы, ионы и другие частицы (интермедиаты), не фигурирующие в стехиометрическом уравнении, например
![]()
Концентрация интермедиатов X* и Y* пренебрежимо мала и реакции с достаточной степенью точности описывается стехиометрическим уравнением
A + Y B + Z
Каждая микростадия, входящая а неэлементарную реакцию, является элементарной.
Совокупность элементарных стадий, через которые протекает реакция, включая детали каждой из этих стадий (природа интермедиатов и характер разрыва и образования химических связей) составляет механизм этой реакции. В зависимости от числа частиц (молекул, комплексов, ионов, других интермедиатов), участвующих в элементарных реакциях, различают мономолекулярные и бимолекулярные реакции. К мономолекулярным относятся элементарные реакции изомеризации (перегруппировки) и расщепления. При гомолитическом расщеплении химической связи ее пара электронов претерпевает симметричный распад, в результате которого к каждой из образующихся частиц отходит по одному электрону, например:
![]()
H : CH2-CH2 H + CH2=CH2
При гетеролитическом расщеплении разрыв связи в реагенте происходит несимметрично с отходом пары электронов этой связи к одному из образующихся фрагментов:
R:Cl R + :Cl
R:CH2CH2 R + CH2=CH2
Бимолекулярные элементарные реакции классифицируют по типу разрыва старой и образования новой химической связи, а также по природе атакующего реагента. В зависимости от последнего они бывают нуклеофильными (N), электрофильными (Е) и радикальными (R). Кроме этого, каждая из них может быть реакцией замещения (S) или присоединения (Ad).
В нуклеофильных реакциях атакующий реагент (нуклеофил) имеет на одном из своих атомов свободную пару электронов и является нейтральной молекулой
![]() или
отрицательно заряженным ионом
или
отрицательно заряженным ионом
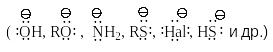
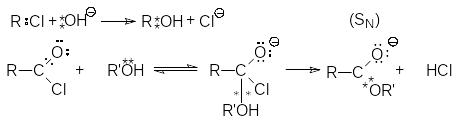 .
Этот реагент атакует в субстрате атом
с наименьшей электронной плотностью
(т.е. с частичным положительным зарядом).
При этом новая связь образуется за счет
электронной пары нуклеофила, а старая
претерпевает несимметричный
(гетеролитический) разрыв с отходом ее
электронной пары к другому атому:
.
Этот реагент атакует в субстрате атом
с наименьшей электронной плотностью
(т.е. с частичным положительным зарядом).
При этом новая связь образуется за счет
электронной пары нуклеофила, а старая
претерпевает несимметричный
(гетеролитический) разрыв с отходом ее
электронной пары к другому атому:
В электрофильных реакциях атакующий реагент (электрофил) имеет у одного из своих атомов незаполненную орбиталь и является нейтральной молекулой (Cl2, SO3, BH3 и др.) или положительно заряженным ионом
(R, NO2, Cl, SO3H и др.). Он атакует в органическом субстрате атом с наибольшей электронной плотностью, причем старая связь претерпевает гетеролитический распад с образованием новой связи между атакуемым атомом и электрофилом за счет пары электронов старой связи:
R + (CH3)3C:H R:H (CH3)3C (SE)
 H+
RCHCH2
RCH–CH2:H
(AdE)
H+
RCHCH2
RCH–CH2:H
(AdE)
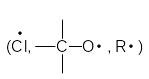
В радикальных реакциях атакующий реагент имеет на одном из атомов неспаренный электрон и является свободным атомом или радикалом
При реализации радикальных реакций рвущаяся связь органической молекулы претерпевает симметричный (гомолитический) разрыв, а новая связь образуется за счет неспаренного электрона свободного радикала и одного из электронов прежней связи. При этом второй электрон прежней связи дает начало новому свободному радикалу:
R:H + Cl*
R
+
![]() Cl
Cl
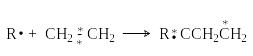
Из рассмотренных примеров можно видеть, что по типу разрыва прежней связи бимолекулярные реакции можно подразделить на гомолитические (радикальные) и гетеролитические или ионные (нуклеофильные и электрофильные).
Имеется особый класс органический реакций, в которых происходит одновременный разрыв и образование нескольких связей за счет синхронного перемещения электронов в циклическом комплексе. В этом случае говорить о гомолитическом или гетеролитическом характере реакций не имеет смысла, и такие процессы называются согласованными или многоцентровыми. Примером такого согласованного процесса является реакция Дильса-Альдера.
Взаимодействующие в органических реакциях вещества подразделяются на реагенты и субстраты. Реагент – это субъект атаки, молекулы которого либо сами выступают в роли атакующих частиц, либо при реализации механизма реакции продуцируют атакующие частицы. Признаком частицы–реагента является наличие в ней электрофильного, нуклеофильного или радикального характера. Субстрат – объект атаки. Так, при реакции брома с этиленом бром рассматривается как реагент, а этилен – как субстрат, поскольку молекула брома имеет вакантную разрыхляющую орбиталь, обладающую низкой энергией и поэтому является электрофильным агентом. В реакции метана с хлором реагентом является хлор, а субстратом метан, поскольку молекулярный хлор является источником хлор-радикалов, выступающих в роли атакующих частиц по отношению к метану.
В свою очередь в элементарных бимолекулярных реакциях различают пару “реагент-субстрат”, причем в качестве реагента выступает нуклеофильная, электрофильная или радикальная частица, а в роли субстрата – атакуемая молекула.
Интермедиаты
Только незначительное число наблюдаемых химических реакций являются элементарными. Большинство реакций протекают через ряд элементарных стадий. При реализации механизма таких неэлементарных реакций образуются высокореакционные способные промежуточные частицы – интермедиаты, которые играют ключевую роль в образовании продуктов реакций. В качестве интермедиатов в органических реакциях выступают карбкатионы, карбанионы, ионные пары, свободные радикалы, карбены, дегидробензол и его производные, тетраэдрические интермедиаты и стабильные молекулы.
Карбкатионы представляют собой частицы с тремя заместителями при центральном атоме углерода, имеющем одну вакантную несвязывающую орбиталь. Отсутствие электронов на орбитали обусловливает наличие положительного заряда на атоме углерода.
П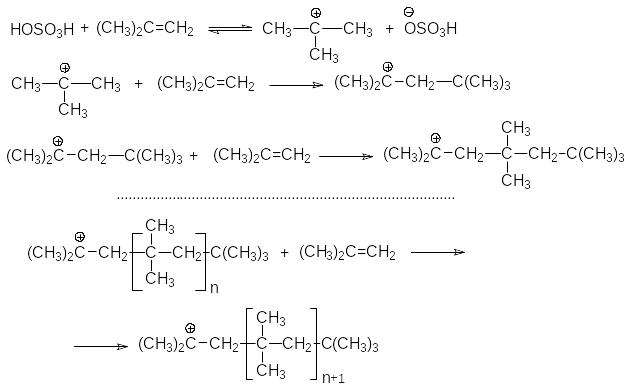 римером
реакции, протекающей через образование
карбкатиона, является катионная
полимеризация изобутена.
римером
реакции, протекающей через образование
карбкатиона, является катионная
полимеризация изобутена.
Можно видеть, что рост полимерной цепи осуществляется путем многократно повторяющихся актов присоединения растущего карбкатиона к очередной молекуле изобутена.
Карбанионы – частицы с тремя заместителями при центральном атоме углерода, имеющем несвязывающую орбиталь с двумя электронами.
Примером реакции, протекающей через образование карбаниона, является конденсация нитрометана с формальдегидом, катализируемая сильными основаниями
CH3NO2 +CH2O HOCH2CH2NO2 (2)
М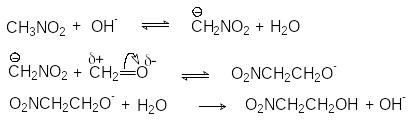 еханизм
реакции:
еханизм
реакции:
Суммирование всех реакций приведенного механизма приводит к стехиометрическому уравнению (2).
Можно видеть, что предпосылкой для присоединения нитрометана к карбониль-ному углероду формальдегида является образование карбаниона СН2NO2, эффективно атакующего положительно заряженный реакционной центр формальдегида.
Радикалы с радикальным центром на углероде – частицы с тремя заместителями при центральном атоме углерода, имеющем несвязывающую полувакантную орбиталь.
Классическим примером радикальной реакции является хлорирование алканов, инициируемое УФ-светом:
Cl2
![]() 2Cl
(инициирование)
2Cl
(инициирование)
Cl + RH Hcl + R (развитие цепей)
R + Cl2 Rcl + Cl
Cl + Cl Cl2
R + Cl RСl (обрыв цепей)
R + R R–R
Из этого примера видно, что высокореакционноспособные хлор-радикалы и алкильные радикалы обусловливают развитие цепного процесса хлорирования, реализуемое через многократное возобновление актов развития цепей.
Карбены представляют собой нейтральные реакционноспособные частицы, в которых центральный атом углерода связан лишь с двумя группами, и содержит два несвязанных электрона. Эти два электрона могут быть спаренными или неспаренными, что обусловливает некоторые различия в их реакционной способности. Карбены могут быть генерированы фотолизом диазоалканов:
RCH = N=N R–CH: + N2
В присутствии соответствующего реагента, например, алкена образующиеся карбены присоединяются по кратной связи, продуцируя циклопропаны
>
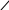 C=C<
+ R–CH:
>C–C<
C=C<
+ R–CH:
>C–C<
CH–R
Другие типы интермедиатов будут рассмотрены в соответствующих разделах курса органической химии.
Понятие скорость-определяющая стадия и переходное состояние
При анализе влияния различных факторов на скорость неэлементарных реакций (структура реагентов, растворитель и др.) необходимо во всей цепи элементарных реакций, составляющих механизм брутто-реакции, выделять лимитирующую или скорость-определяющую стадию. По своей природе эта стадия протекает энергетически наиболее трудно и поэтому ее скорость определяет скорость неэлементарного процесса в целом. Выделение в механизме реакций скорость-определяющей стадии имеет принципиальное значение, поскольку все факторы, влияющие на эту стадию, аналогичным образом влияют на скорость реакции в целом.
При анализе влияние различных факторов на скорость-определяющую стадию необходимо использовать метод активированного комплекса (переходного состояния). Согласно теории абсолютных скоростей реакций активированный комплекс рассматривается как молекула, обладающая обычными термодинамическими свойствами. Принято, что реагенты находятся в равновесии с активированным комплексом, представляющим собой высшую точку на диаграмме потенциальный энергией, изображающей переход реагентов в продукты. Координату реакции можно рассматривать как расстояние между любыми двумя атомами в реагирующей системе, между которыми завязывается или рвется химическая связь
E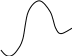





H
В большинстве случаев успех реакции определяется высотой энергетического барьера (энергией активации Е), который должна преодолеть система на своем пути от реагентов к продуктам реакции. Можно видеть, что энергия активации представляет собой разность между энергией переходного и исходного состояний
Е = Н – Нисх
Из этого следует, что зная, как влияет тот или иной фактор на энергию исходного и переходного состояний можно предсказать изменение величины Е от действия этого фактора, а следовательно, и изменение скорости реакций.
Анализируя подобным образом влияние структурных и других факторов на скорость скорость-определяющей стадии можно полученные выводы распространить на реакцию в целом.
