
- •Лекции №51-52 гетероциклические соединения
- •Классификация
- •П ятичленные ароматические гетероциклы с одним гетероатомом
- •Пятичленные ароматические гетероциклы с одним гетероатомом Пиррол, фуран, тиофен
- •Методы получения
- •Физические свойства и строение
- •Химические свойства
- •Основные свойства
- •Кислотные свойства пиррола
- •Р еакции электрофильного замещения
- •Реакции присоединения
- •Методы получения
- •Физические свойства и строение
- •Химические свойства
- •Основные свойства
- •Реакции электрофильного замещения
Лекции №51-52 гетероциклические соединения
План
Классификация.
Пятичленные гетероциклы с одним гетероатомом.
Шестичленные гетероциклы с одним гетероатомом.
Гетероциклическими называют соединения, молекулы которых содержат циклы, включающие наряду с атомами углерода один или несколько гетероатомов. Гетероциклы – самый многочисленный класс органических соединений, включающий около 2/3 всех известных природных и синтетических органических веществ.
Классификация
Гетероциклы классифицируют по следующим основным признакам:
по природе и числу гетероатомов;
по размеру цикла;
по степени ненасыщенности.
Наибольшее распространение имеют пяти- и шестичленные гетероциклы, содержащие в качестве гетероатомов азот, кислород и серу.
По степени ненасыщенности различают насыщенные и ненасыщенные, в том числе ароматические гетероциклы. Гетероциклы неароматического характера по своим свойствам сходны с соответствующими ациклическими соединениями (аминами, амидами, простыми и сложными эфирами и т.д.). Ароматические гетероциклические соединения по свойствам близки к бензолу. Для них, как и для бензоидных систем, наиболее характерны реакции замещения. При этом гетероатом выполняет роль «внутренней функции», определяющей скорость и направление реакций замещения.
Систематическая номенклатура гетероциклов сложна. Для многих гетероциклических соединений сохраняются тривиальные названия. Ниже приведены некоторые группы ароматических гетероциклических соединений и их тривиальные названия.
П ятичленные ароматические гетероциклы с одним гетероатомом
П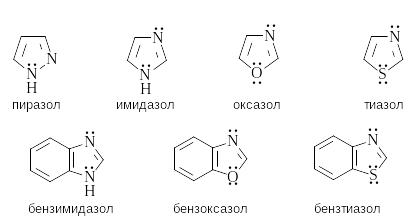 ятичленные
ароматические гетероциклы с двумя
гетероатомами
ятичленные
ароматические гетероциклы с двумя
гетероатомами
Шестичленные ароматические гетероциклы с одним гетероатомом
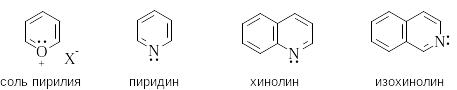
Ш естичленые
ароматические гетероциклы с двумя
гетероатомами
естичленые
ароматические гетероциклы с двумя
гетероатомами
Далее будут рассмотрены пяти- и шестичленные ароматические гетероциклы с одним гетероатомом.
Пятичленные ароматические гетероциклы с одним гетероатомом Пиррол, фуран, тиофен
П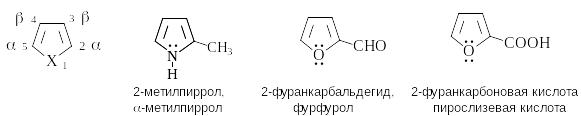 ри
составлении названий производных
пиррола, фурана и тиофена атомы цикла
нумеруют, начиная с гетероатома. Положение
заместителя в кольце может быть указано
также буквами греческого алфавита.
ри
составлении названий производных
пиррола, фурана и тиофена атомы цикла
нумеруют, начиная с гетероатома. Положение
заместителя в кольце может быть указано
также буквами греческого алфавита.
Методы получения
Синтез из 1,4-дикарбонильных соединений по Паалю-Кнорру.
П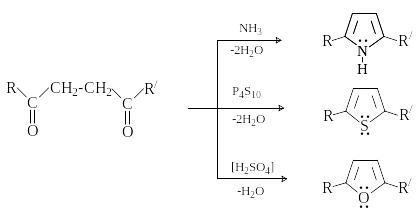 ри
нагревании 1,4—дикарбонильных соединений
с такими нуклеофильными реагентами,
как аммиак или сульфиды, образуются
соответственно производные пиррола и
тиофена. Нагревание 1,4—дикарбонильных
соединений в присутствии кислотного
катализатора дает производные фурана.
ри
нагревании 1,4—дикарбонильных соединений
с такими нуклеофильными реагентами,
как аммиак или сульфиды, образуются
соответственно производные пиррола и
тиофена. Нагревание 1,4—дикарбонильных
соединений в присутствии кислотного
катализатора дает производные фурана.
Синтез пирролов по Кнорру.
М етод
состоит в конденсации -аминокетонов
с -дикарбонильными
соединениями в присутствии кислотного
или основного катализатора.
етод
состоит в конденсации -аминокетонов
с -дикарбонильными
соединениями в присутствии кислотного
или основного катализатора.
В
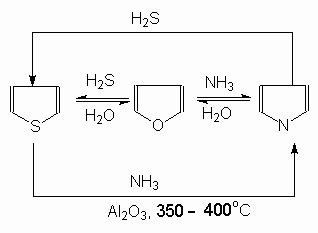 заимные
превращения (реакция Юрьева).
заимные
превращения (реакция Юрьева).
При нагревании (~4000С) над катализатором Al2O3 происходят превращения фурана, пиррола и тиофена друг в друга. Практическое значение имеют получение пиррола и тиофена из фурана.
Физические свойства и строение
Пиррол, фуран и тиофен – бесцветные жидкости с приятным запахом. Температура кипения пиррола (130-1310С) значительно превышает температуры кипения фурана (320С) и тиофена (840С), что обусловлено его ассоциацией за счет образования водородных связей.
Пиррол, фуран и тиофен могут быть отнесены к ароматическим соединениям, так как их молекулы содержат циклическую сопряженную систему, включающую 6 -электронов. Они являются электронными аналогами ароматического карбоцикла – циклопентадиенил-аниона (см. лек. №17). В молекуле пиррола атом азота находится в состоянии sp2-гибридизации и образует три -связи, лежащие в плоскости кольца. р-Орбиталь атома азота со свободной парой электронов взаимодействует с четырьмя р-орбиталями атомов углерода с образованием циклической -системы, содержащей секстет -электронов.

 -МО
пиррола качественно похожи на орбитали
циклопентадиенил-аниона. Возмущение,
вызванное введением гетероатома,
выражается в расщеплении уровней 2
и 3, которые
в циклопентадиенил-анионе являются
вырожденными (имеют одинаковую энергию).
Более низкую энергию имеет орбиталь
2, которая
имеет больший коэффициент на атоме
азота. Такое расщепление уровней является
отражением частичной локализации
неподеленной пары электронов на атоме
азота. Ниже приведена схема -МО
пиррола. Диаметр кружка пропорционален
коэффициенту данной атомной орбитали
в молекулярной орбитали, а наличие или
отсутствие штриховки соответствует
знаку волновой функции.
-МО
пиррола качественно похожи на орбитали
циклопентадиенил-аниона. Возмущение,
вызванное введением гетероатома,
выражается в расщеплении уровней 2
и 3, которые
в циклопентадиенил-анионе являются
вырожденными (имеют одинаковую энергию).
Более низкую энергию имеет орбиталь
2, которая
имеет больший коэффициент на атоме
азота. Такое расщепление уровней является
отражением частичной локализации
неподеленной пары электронов на атоме
азота. Ниже приведена схема -МО
пиррола. Диаметр кружка пропорционален
коэффициенту данной атомной орбитали
в молекулярной орбитали, а наличие или
отсутствие штриховки соответствует
знаку волновой функции.
Атом азота в пирроле действует как электронодонор по мезомерному механизму, поэтому -электронная плотность на атомах углерода пиррола повышена по сравнению с бензолом. Такие гетероциклы называют -избыточными (на пять атомов приходится шесть -электронов).
Гетероциклы фуран и тиофен имеют аналогичную -систему, в которой одна из неподеленных пар электронов кислорода и серы соответственно участвуют в образовании ароматического секстета. Фуран и тиофен также относятся к -избыточными гетероциклическим соединениям.
Подтверждением ароматического характера пиррола, фурана и тиофена является их плоское строение и длины связей, которые имеют промежуточные значения между обычными простыми и двойными связями С-С, C-N, C-O и C-S. Эмпирические оценки и квантово-механические расчеты показывают, что пятичленные гетероциклы стабилизированы за счет делокализации -электронов, однако энергия делокализации у них ниже, чем у бензола. В наименьшей степени стабилизирован фуран, который, таким образом, обладает меньшей ароматичностью, чем пиррол и тиофен.
М олекулы
пиррола, фурана и тиофена полярны. У
пиррола дипольный момент направлен от
атома азота на цикл. У фурана и тиофена
отрицательный конец диполя, напротив,
находится на гетероатоме.
олекулы
пиррола, фурана и тиофена полярны. У
пиррола дипольный момент направлен от
атома азота на цикл. У фурана и тиофена
отрицательный конец диполя, напротив,
находится на гетероатоме.
=1,75D =1,95D
Пиррол, фуран и тиофен являются электронодонорными соединениями с энергиями ионизации соответственно 8,2; 8,9 и 9,0 эВ, что ниже, чем у бензола (9,24 эВ).
