
Лекции №30-31 гидроксилпроизводные углеводородов
План.
Классификация. Номенклатура.
Методы получения.
Строение.
Физические и химические свойства.
Гидроксилпроизводные следует рассматривать как результат замещения атомов водорода в углеводороде на гидроксильную группу.
Гидроксилпроизводные могут быть подразделены по типу атомов углерода, связанных с гидроксильной группой:
1) гидроксилпроизводные С (SP3) - ОН;
2) гидроксилпроизводные С (SP2) - ОН.
Гидроксилпроизводные С (SP) - ОН неизвестны, известны только их производные - эфиры С(SP) - OR.
Гидроксилпроизводные со связью С (SP3) - ОН.
К ним относятся:
а) гидроксилпроизводные алканов и циклоалканов - алканолов и циклоалканолов;
б) гидроксилпроизводные алкенов, алкинов, циклоалкенов, если СС и СС - группы отделены от группы ОН по крайней мере одним атомом углерода в состоянии sp3, например:
СН2 СН СНОН СН С СН2 СН2ОН

в) гидроксилпроизводные алкиларенов в которых гидроксильная группа находится в алкильном заместителе
ArCH2OH Ar(CH2)nOH
Алканолы (спирты)
Алканолы - результат замещения атомов водорода в алканах на ОН - группы.
Различают одноатомные и многоатомные алканолы. Последние представляют собой результат замещения атомов водорода в алканах при различных углеродных атомах, например:
СН2 СН2 НОСН2СНОНСН2ОН
ОН ОН
Эмпирическая формула одноатомных спиртов СnH2n+2O.
Изомерия и номенклатура одноатомных алканолов
В зависимости от типа углеродного атома, с которым связана гидроксильная группа, различают первичные, вторичные и третичные алканолы (спирты):
RCH2OH - первичные

- вторичные
- третичные
Согласно заместительной номенклатуре, углеродные атомы цепи нумеруют таким образом, чтобы гидроксильная группа обозначалась меньшим номером. Если гидроксильная группа старшая, то ее обозначают суффиксом “-ол”. Если в молекуле имеются более старшие группы ( С = О, СООН), то гидроксильную группу обозначают префиксом “гидрокси-“ (иногда “окси-”). По радикально-функциональной номенклатуре алканолы называются спиртами, например:
4 3 2 1
СН3 СН2СН СН2ОН - 2-метилбутанол - 1
СН3
5 4 3 2 1
СН3СН СН СН2СООН - 3-гидрокси-4-метилпентановая кислота
СН3 ОН
Изомерия алканолов определяется местонахождением гидроксильных групп и разветвлением углеродной цепи. Начиная с бутанола -2, имеет место также стереоизомерия, т.к. появляется хиральный атом углерода.
Методы получения
1. Гидратация алкенов
RCH CH2 + H2O [Al2O3или H3PO4];(((((((((((( RCH CH3
OH
2. Гидроборирование алкенов
RCH
CH2
![]()
RCH2CH2OH
RCH2CH2OH
3. Гидролиз галогеналканов
2RCl + Na2CO3 +H2O 2ROH + 2CO2 + 2NaCl
4. Гидрирование карбонильных соединений.
а) Восстановление водородом
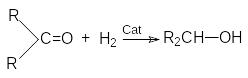 RCHO
+ H2
Cat;(((
RCH2OH
RCHO
+ H2
Cat;(((
RCH2OH
RCOOR + H2 Cat;((( RCH2OH + ROH
Катализаторами этих процессов являются Ni, Pt, Pd.
б) Восстановление алкоголятами
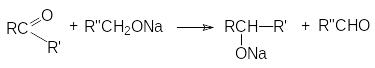
Восстановление осуществляется благодаря переносу гидрид - аниона от алкоголята к карбонильному углероду

Поэтому в качестве восстанавливающих агентов могут использоваться только первичные или вторичные спирты.
Для смещения равновесия реакцию ведут в режиме выкипания легкокипящего продукта реакции – карбонилсодержащего соединения.
Благодаря этому подавляются также побочные реакции конденсации карбонильных соединений, катализируемые алкоголят-анионами.
Более мягкими восстанавливающими агентами являются алкоголяты алюминия, в которых связи Al О близки к ковалентным, поэтому они плохо диссоциируют на алкоголят - анионы, оказывающие побочное осмоляющее действие:
3R2CO + Al OCH(CH3)23 (R2CH)3Al 3(CH3)2CO
Этот метод известен как реакция Меервейна - Понндорфа - Оппеанауэра – Верлея.
в) Восстановление неорганическими гидридами.
Исключительно важное препаративное значение при восстановлении карбонильных соединений приобрели неорганические гидриды – литий алюминий-гидрид LiAlH4 и натрий боргидрид NaBH4. Эти реагенты находят широкое применение, особенно в случае неустойчивых и дорогостоящих карбонильных производных. Хорошим примером может служить восстановление циклобутанона в циклобутанол.
П
 ри
действии гидридов металлов ключевая
стадия состоит в переносе гидрид-иона
к карбонильному углероду восстанавливаемого
соединения:
ри
действии гидридов металлов ключевая
стадия состоит в переносе гидрид-иона
к карбонильному углероду восстанавливаемого
соединения:
В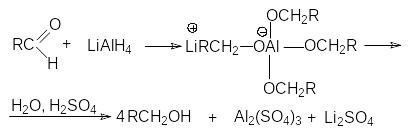 таких превращениях могут быть использованы
все четыре водорода, связанные с
алюминием:
таких превращениях могут быть использованы
все четыре водорода, связанные с
алюминием:
или суммарно:

Избыточный литийалюминий гидрид разлагается при действии водной кислоты с выделением водорода:
2LiAlH4 + 4H2SO4 Li2SO4 + Al2(SO4)3 + 4H2
Литийалюминийгидрид обычно восстанавливает карбонильные группы, не затрагивая двойные углерод-углеродные связи. Он, кроме того, является эффективным восстановителем карбонильных групп карбоновых кислот и сложных эфиров, например:
4RCOOH + 3LiAlH4 + 12HCl [H2O];((((((((((((((((4RCH2OH + 3AlCl3 + 3LiCl + 4H2 + 4H2O
В отличие от карбоновых кислот сложные эфиры реагируют без выделения водорода
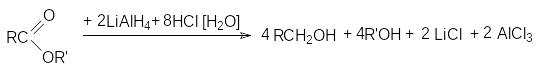
Натрийборгидрид более мягкий восстанавливающий агент: он восстанавливает альдегиды и кетоны, но не кислоты и сложные эфиры. Он сравнительно медленно реагирует с водой в нейтральном или щелочном растворе, что позволяет проводить восстановление в водном растворе без сколько-нибудь значительного гидролиза восстанавливающего агента
NaBH4 + 4CH2=O + 3H2O 4CH3OH + NaH2BO3
5. Взаимодействие карбонильных соединений с реактивом Гриньяра
а) CH2 O + RMgX RCH2 OMgX H2O;(((( RCH2OH + Mg(OH)X
Можно видеть, что используя в качестве реагента формальдегид получают первичные спирты, содержащие на один атом углерода больше, чем исходное карбонильное соединение.
б )
В то же время, конденсация альдегидов
(кроме формальдегида) с реактивами
Гриньяра с последующим гидролизом
приводит к образованию вторичных
спиртов.
)
В то же время, конденсация альдегидов
(кроме формальдегида) с реактивами
Гриньяра с последующим гидролизом
приводит к образованию вторичных
спиртов.
в ) В
свою очередь, конденсация кетонов с
реактивами Гриньяра и последующий
гидролиз приводит к образованию третичных
спиртов.
) В
свою очередь, конденсация кетонов с
реактивами Гриньяра и последующий
гидролиз приводит к образованию третичных
спиртов.
6. Синтез спиртов из синтез-газа
СO + 2H2 [ZnO.Cr2O3];(((((((( CH3OH
CO + H2 [Co CH3CH2CH2OH + CH3CHCH3
OH
