
metodichka_Lipidy_2020
.pdf
4) холин |
5) метионин |
6) глицин |
Задания для самостоятельной работы (выполнить письменно и отправить ответы преподавателю на электронную
почту).
Задание 1
Сравните β –окисление и биосинтез ВЖК и заполните таблицу:
|
Процессы |
β –окисление |
Биосинтез |
Локализация процесса |
|
|
|
Исходный субстрат |
|
|
|
Переносчик |
субстрата |
через |
|
митохондриальную мембрану |
|
|
|
Коферменты |
окислительно- |
|
|
восстановительных реакций |
|
|
|
Регуляторные ферменты |
|
|
|
Регуляторные факторы: Активаторы ингибиторы
Задача 2
При синтезе триацилглицеридов исходными субстратами, кроме ацил-КоА, могут выступать: диоксиацетонфосфат, глицерол, β-моноглицерид. Укажите, какие из них могут использоваться для синтеза жиров и запишите схемы их синтеза:
А) в кишечнике; Б) в печени; В) жировой ткани.
Задача 3
Популярная безуглеводная диета доктора Аткинса и ее разновидность - «кремлевская» предполагают резкое ограничение поступления углеводов с пищей (не более 15 г в день) при умеренном потреблении жиров и белков. Почему, несмотря на потребление жиров, человек «сбрасывает вес». Для ответа:
А) объясните, как повлияет диета на секрецию инсулина и почему; Б) изобразите схему синтеза и гидролиза ТАГ в жировой ткани. Покажите на схемах,
какие процессы усиливаются и какие подавляются у человека, соблюдающего такую диету.
В) опишите влияние инсулина на обмен ТАГ.
Задача 4
Поясните и представьте в виде схемы изменение метаболизма ТАГ при А) высокоуглеводной диете; Б) диете с высоким содержанием жира;
В) диете с низким содержанием жира;
Задача 5
Полагают, что раковые клетки увеличивают экспрессию фермента холинкиназы.
А) напишите уравнение реакции с участием этого фермента; Б) представьте в виде схемы дальнейшую судьбу продукта реакции с участием
холинкиназы; В) в чем преимущество повышенной экспрессии данного фермента в раковой
клетке?
Занятие 14 (04.05-09.05)
Тема: «Обмен холестерина, желчных кислот и эйкозаноидов»
Вопросы:
1.Холеестерол: биологическая роль, баланс.
2.Синтез холестерола: локализация, субстраты, этапы, последовательность реакций, ферменты.
3.Регуляция синтеза холестерола.
4.Желчные кислоты: структура, синтез, регуляция, нарушение.
5.Эйкозаноиды: строение, номенклатура, пути синтеза, биологическая роль. Лекарственные препараты как ингибиторы синтеза эйказоноидов.
6.ЛПНП и ДПВП: образование, роль в транспорте холестерола.
7.Строение и синтез рецепторов ЛПНП. Роль фермента ЛХАТ в обмене холестерола.
Баланс холестерина в организме человека и пути его использования. Биологическая роль холестерина.

Холестерол - стероид, характерный только для животных организмов, содержится только в жирах животного происхождения в свободном виде и в виде эфиров. В растительных маслах его нет.
У взрослого человека содержание холестерола составляет 140–150 г. Около 93% стероида входит в состав мембран и 7% находится в жидкостях организма.
Концентрация холестерола в сыворотке крови взрослого человека в норме равна ~ 200 мг/дл или 5,2 ммоль/л, что соответствует холестериновому равновесию, когда количество холестерола, поступающего в организм, равно количеству холестерола выводимому из организма.
Холестериновое равновесие (баланс холестерина) поддерживается благодаря тому, что с одной стороны:
-холестерол поступает с пищей (~ 0,3 — 0,5
г⁄ с ) и
-синтезируется в организме (~ 1 г ⁄с ),
а с другой: |
|
- окисляется |
в желчные кислоты в |
последующей экскрецией желчных кислот с
калом (0,5 г/сутки) |
|
- выводится с калом в виде |
холестерола |
желчи, продуктов катаболизма |
стероидных |
гормонов, с кожным салом, в составе мембран слущенного эпителия.
Ежесуточный расход холестерина (экскреция, использование для синтеза других стероидов) равен примерно 1,3 г.
Встационарном состоянии суммарное количество холестерина, поступающего
вкишечник с пищей, и холестерина, синтезированного в тканях, равно суммарному количеству экскретируемых холестерина и желчных кислот:
(холестеринэнд+ холестеринэкз)= холестеринэкскрет. +желчные кислотыэкскр.

У здоровых людей при обычном питании баланс равен нулю. При переходе на бесхолестериновую диеты баланс в первые дни становится отрицательным, затем, через несколько дней, устанавливается новое стационарное равновесие за счет увеличения синтеза холестерина (максимальный синтез – 1,5 г) и уменьшения его экскреции. При обратном переходе с бесхолестериновой диеты на обычное питание, в первые дни холестериновый баланс будет положительным, пока вновь не установится стационарное равновесие. Чем больше поступление холестерина, тем меньше его синтезируется в тканях.
Рис. 4-1. Фонд холестерола в организме, пути его использования и выведения.
Холестерин – является:
•структурным компонентом мембран клеток
•предшественником:
-стероидных гормонов: половых, коры надпочечников, кальцитриола,
-желчных кислот
-витамина Д3
Схема биосинтеза холестерина в организме человека: локализация, субстраты, ферменты, этапы.
Локализация |
▪ печень - до 80% |
синтеза |
▪ тонкий кишечник - 15-20%, |
|
холестерола

Субстраты
Этапы
▪другие ткани (кожа, кора надпочечников, половые железы) – до 5%
▪ацетил-КоА
▪НАДФН+Н+
Первые стадии синтеза идут в цитозоле клеток, а более поздние на мембранах ЭПР в три этапа:
•I-й этап –образование мевалоновой кислоты
•II-й этап –образование сквалена
•III-й этап – циклизация сквалена и образование холестерина.
Исходным субстратом для синтеза холестерина, как и ВЖК, является ацетил-
СоА.
На |
этапе синтеза мевалоновой |
кислоты:
• происходит конденсация двух молекул ацетил-СоА с участием фермента тиолаза, что приводит к образованию ацетоацетила-СоА,
• который конденсируется с третьей молекулой ацетил-СоА (фермент ГМГ-СоА-синтаза) с образованием шести-углеродного соединения â- гидрокси-â-метилглутарил-СоА (HMG-СоА).

• Далее происходит восстановление ГМГ-СоА до мевалоната, на которое каждая молекула НАФН предоставляет по два электрона.
Катализирует реакцию регуляторный фермент ГМГ– редуктаза –интегральный белок гладкого ЭР.
Последовательность реакций I этапа сходна с начальными этапами синтеза кетоновых тел. Однако синтез кетоновых тел протекает в матриксе митохондрий гепатоцитов, а синтез холестерола - в цитозоле клеток.
На этапе образования сквалена: мевалоновая кислота в ходе фосфорилирования и декарбоксилирования превращается в активированную структурную единицу – изопентенилпирофосфат, при полимеризации которого образуется 30-углеродное нециклическое соединение - сквален
Далее линейная молекула сквалена превращается в циклическое соединение ланостерол, от которого отщепляются 3 углеродных атома в форме СО2 и образуется холестерин.
Реакция, лимитирующая скорость биосинтеза холестерина, регуляция активности ГМГ-КоА-редуктазы.
Синтез холестерина требует больших затрат энергии, поэтому организму выгодно иметь механизм регуляции холестерина, который пополняет его количество в дополнение к тому, что поступает с пищей. Синтез холестерина в организме регулируется:
•внутриклеточной концентрацией холестерина и
•гормонально: глюкагоном и инсулином.
Реакция, лимитирующая скорость биосинтеза холестерина - превращение β- гидрооксиметилглутарил-КоА в мевалонат, которую катализирует регуляторный фермент гидрооксиметилглутарил-КоА-редуктаза (ГМГ-КоА-редуктаза или HMG-СоА-редуктаза).
•Регуляция в ответ на изменение концентрации холестерина – это регуляция по типу экспрессии гена: избыток стероидов: холестерола и желчных кислот - подавляют транскрипцию гена ГМГ-КоА-редуктазы и синтез этого фермента при участии семейства белков. Когда концентрация холестерола снижается, белки расщепляются при участии протеазы, ген активируется и индуцируется синтез ГМГ-КоА-редуктазы.
•Гормональный контроль опосредуется ковалентной модификацией по типу
фосфорилирования-дефосфорилирования. |
Глюкагон |
(гормон |
|
постабсорбтивного состояния) |
взаимодействуют с мембранными рецепторами |
||
аденилатциклазной системы и |
активируют |
протеинкиназу А (ПКА), которая |
|
фосфорилирует фермент-посредник – киназу ГМГ -КоА редуктазы, а та – ГМГКоА редуктазу, переводя ее в неактивное фосфорилированное состояние. Поэтому в постабсорбтивный период или при голодании более суток скорость синтеза
холестерола в печени снижена. |
|
Инсулин, активируя протеинфосфатазу, вызывает |
каскадное |
дефосфорилирование: киназы ГМГ-КоА редуктазы-> ГМГ-КоА редуктазы, дефосфорилированная форма которой является активной. В абсорбтивный период ГМГ-КоАредуктаза дефосфорилирована и активна, поэтому в печени синтез холестерола идет с высокой скоростью.

Рис. 4-2. Регуляция синтеза холестерола. Обозначения: + активация; -/х ингибирование ГМГ-КоА- редуктазы.
Высокие внутриклеточные концентрации холестерина активируют процессы:
•этерификации холестерина и его депонировании в виде эфиров за счет активации фермента АХАТ
•снижение синтеза рецепторов ЛПНП за счет подавление транскрипции гена, кодирующего их синтез, и захват холестерина из крови уменьшается.
Формирование в печени транспортной формы холестерола для доставки его в ткани.
В печени пул холестерина составляется из холестерина:
• синтезированного самими клетками и
• поступившего из остаточных хиломикронов.
Этот пул холестерина существует не только для собственных нужд печени, но и для снабжения других тканей. Большая часть синтезированного холестерола и его эфиров вместе с жирами, синтезированными из глюкозы, удаляется из печени в составе ЛПОНП незрелых. В кровеносном русле ЛПВП передают на ЛПОНП апобелки С-II и Е, и ЛОНП переходят в ЛОНПзрелые. Эти частицы содержат 55% ТАГ, фосфолипиды и апобелки, основным из которых является апопротеин В-100, в меньшей степени содержатся белки: апоС-I, ароС-II, ароС-III и аро Е.

Рис. 4-3. Транспорт эндогенного холестерина в ткани
ЛПОНП переносятся кровью от печени в мышечную и жировую ткани, где после активации липопротеин липазы белком аро-CII, происходит высвобождение свободных жирных кислот из триацилглицеринов. Адипоциты захватывают жирные кислоты и вновь переводят их в жиры, а миоциты сразу же окисляют жирные кислоты с целью получения энергии.
При потере триацилглицеринов часть ЛПОНП превращается в остаточные ЛПОНП, называемые липопротеинами промежуточной плотности (ЛППП), при дальнейшем удалении триацилглицеролов из состава ЛПОНП образуются липопротеины низкой плотности (ЛПНП), которые содержат много холестерина и его эфиров.
Поступление холестерина в клетку.
Каждая частица ЛПНП в кровяном русле содержит ароВ-100, который распознается рецепторами на мембране клеток, которым требуется холестерин.
После связывания ЛПНП с рецептором инициируется эндоцитоз, ЛПНП перемещаются в клетку внутри эндосомы, которая далее сливается с лизосомой. Ферменты лизосомы гидролизуют эфиры холестерина до холестерина и жирных кислот, которые далее попадают в цитозоль. АпоВ-100 из ЛПНП также распадается с образованием аминокислот, а рецептор ЛПНП избегает деградации и вновь попадает цитозоль. Количество рецепторов к ЛПНП (апоВ-100-рецепторов) в мембране клеток регулируется холестеролом: чем выше содержание холестерола в клетке, тем меньше рецепторов в мембране У здоровых людей период полураспада ЛПНП в крови составляет от 21/2 до 5 сут.
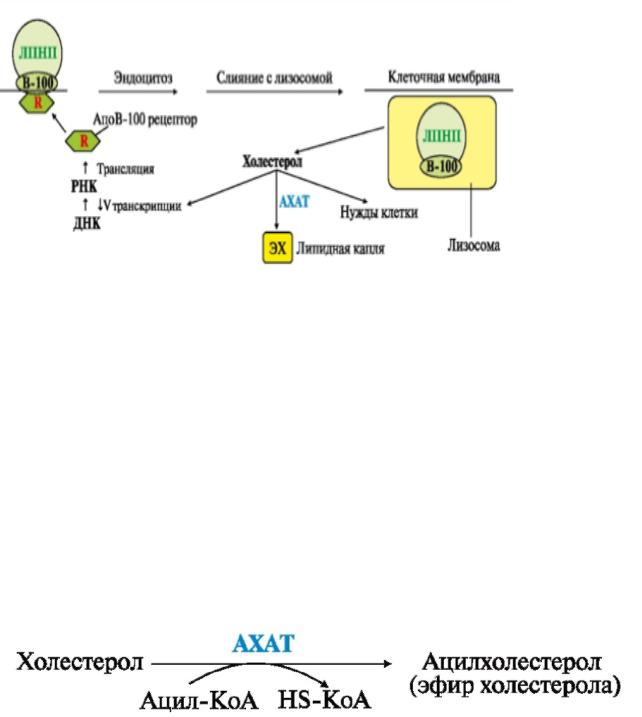
Рис. 4-4. Рецептор-зависимый эндоцитоз ЛПНП клетками тканей
Высвободившийся из лизосом холестерол способен:
•идти на построение мембран, использоваться, для синтеза других стероидов;
•подавлять синтез холестерола в клетке, выступая в роли регуляторного фактора экспрессии гена ГМГ-КоА-редуктазы, а также активировать деградацию этого фермента;
•уменьшать количество апоВ-100-рецепторов в плазматической мембране, снижая экспрессию гена этого рецептора;
•частично этерифицироваться под действием фермента АХАТ и в форме эфиров сохраняться в липидных каплях цитоплазмы:
Липопротеины высокой плотности незрелые (ЛВПнезрелые) синтезируются в печени и тонком кишечнике (незначительно) в виде маленьких частиц, богатых белком и фосфолипидами. Они содержат мало холестерина и совсем не содержат эфиров холестерина и имеют дисковидную форму. В состав ЛПВП входят апобелки (апоА-I, апоС-I, апоС-II, апоЕ и др.) и фермент лецитин-холестерин-ацилтрансфераза (ЛХАТ или LCAT), катализирующий образование эфиров холестерина из лецитина (фосфатидилхолина) и холестерина, входящих в состав хиломикронов и ЛПОНП (остаточных):
