
metodichka_Lipidy_2020
.pdf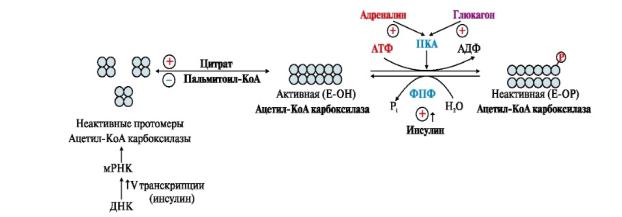
Влияние гормонов на скорость окисления жирных кислот
• индукцией синтеза фермента: инсулин в абсорбтивный период индуцирует синтез ферментов: ацетил-КоАкарбоксилазы, синтазы жирных кислот, цитратлиазы.
Общая регуляция представлена на рис. :
Регуляция активности Ацетил-СоА карбоксилазы
Координированная регуляция синтеза и распада жирных кислот
Если в рационе питания в качестве источника энергии присутствуют углеводы, β- окисление тормозится. Ключевую роль в координации играют два фермента: ацетил-СоА карбоксилаза (АСС) – первый фермент в синтезе жирных кислот и карнитинацилтрансфераза I, ограничивающая поступление ВЖК в матрикс (рис. ). При поступлении пищи с высоким содержанием углеводов, в крови повышается уровень глюкозы (1) и инсулина (2). Инсулинзависимый фермент фосфатаза, дефосфорилирует ацетил-СоА карбоксилазу (АСС) и в активной форме катализирует образование малонил-СоА, который является ингибитором (4) карнитинацилтрансферазы I, препятствуя транспорту ВЖК и самому процессу окисления.
Когда между приемами пищи уровень глюкозы падает, выделение глюкагона
(5) активирует сАМФ-зависимую протеинкиназу (РКА) (6), которая фосфорилирует и инактивирует ацетил-СоА карбоксилазу (АСС). Концентрация малонил-СоА падает, ингибирование поступления жирных кислот в митохондрию ослабляется (7), они попадают в матрикс и становятся основным источником энергии.
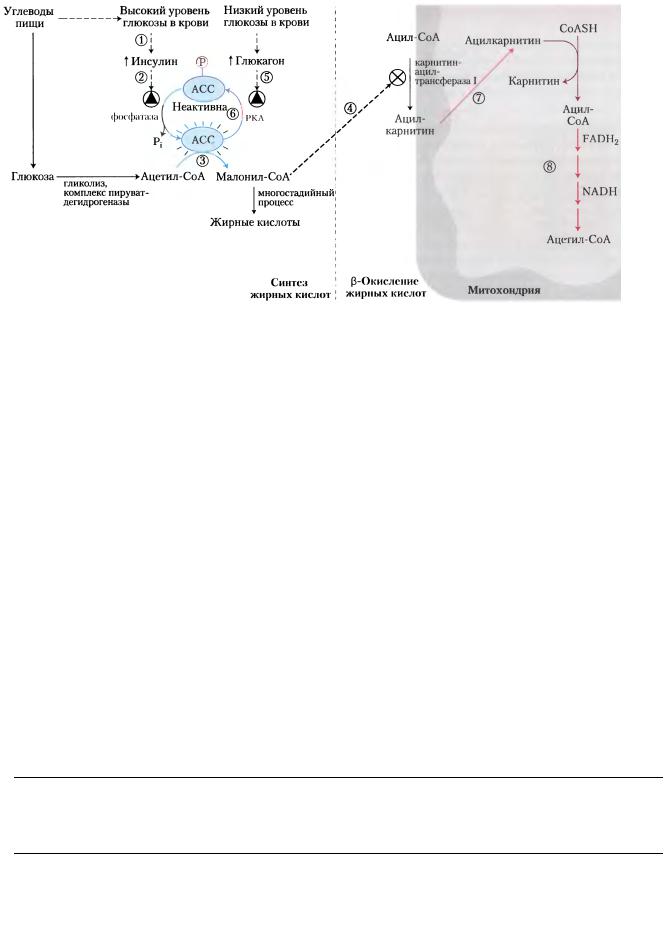
Координированная регуляция синтеза и распада жирных кислот.
Таким образом, соотношение скорости ферментативных реакций β- окисления и синтеза жирных кислот и их переключение с одного процесса на другой определяется в первую очередь уровнем глюкозы и гормонов.
Биосинтез ТАГ
Запасание жиров в жировой ткани - основная форма депонирования источников энергии в организме человека. Жиры являются самыми высококалорийными веществами в организме, так как жирные кислоты, входящие в их состав, являются наиболее восстановленными молекулами (т.е. содержащими много связей -СН2-), при окислении которых выделяется большое количество энергии.
Характеристика синтеза ТАГ (липогенеза):
Период активации |
абсорбтивный, при при избыточном поступлении в организм |
|
углеводов |
Локализация: |
цитозоль клеток: печени, жировой ткани, лактирующей |
|
молочной железы |
Субстраты |
• глицерол в виде глицерол-3-фосфат и |
для синтеза ТАГ |
• активные формы жирных кислот - ацил-КоА |
Основными источниками ВЖК являются:
• хиломикроны, доставляющие экзогенные жиры из кишечника
• ЛОНП, транспортирующие эндогенные жиры, синтезированные в печени из глюкозы
• Ацетил-КоА, образовавшийся при распаде глюкозы.
Скорость освобождения ВЖК из состава липопротеинов зависит от количества и активности липопротеинлипазы (ЛПЛ), которая выходит из адипоцита и фиксируется на поверхности стенки капилляра с помощью гепарансульфата.
Глицерофосфат образуется:
•восстановлением дигидроксиацетонфосфата (метаболита гликолиза) – в печени и жировой ткани;
•из глицерола – только в печени, а в жировой ткани из-за отсутствия глицеролкиназы глицерин не используется.
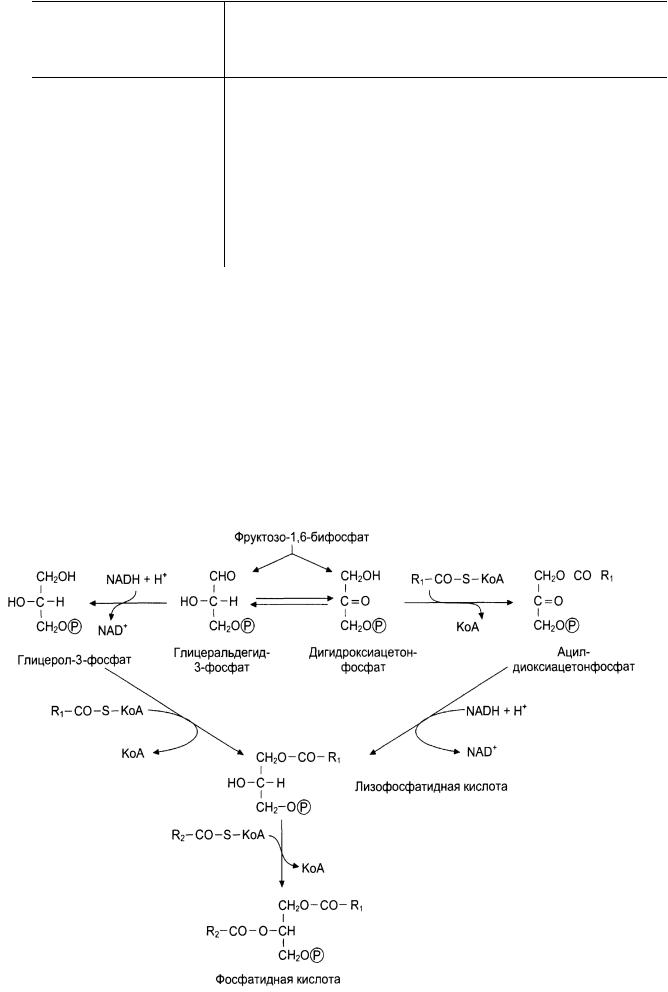
Триацилглицеролы образуются при взаимодействии двух молекул ацил-СоА жирных кислот с глицерол-3-фосфатом c выделением фосфатидной кислоты. К первому углеродному атому глицерол-3-фосфата в большинстве случаев присоединяется насыщенная жирная кислота, а ко второму углеродному атому переносится остаток насыщенной или ненасыщенной жирной кислоты. Далее фосфатидная кислота дефосфорилируется до диацилглицерина, который затем ацилируется третьей молекулой ацил-СоА с образованием триацилглицеринов:
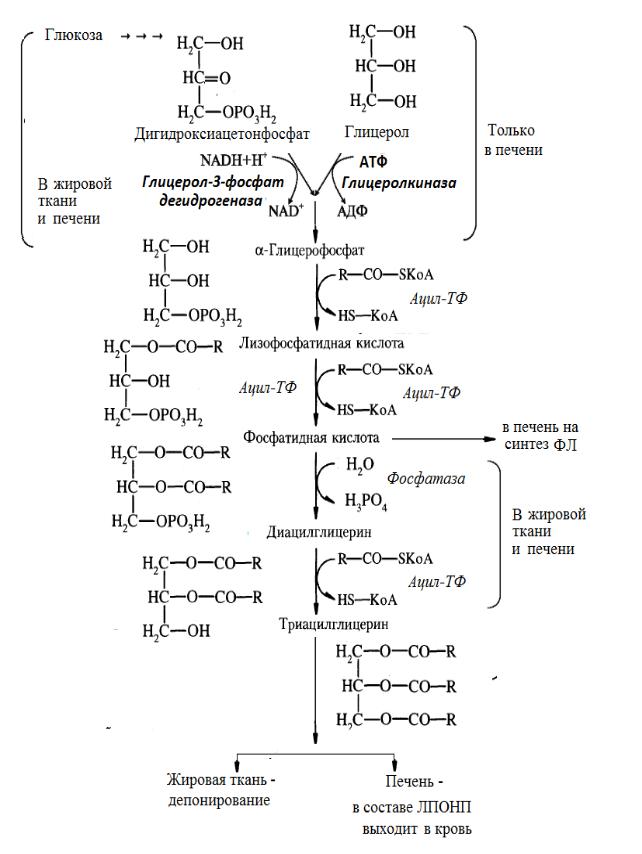
Синтез ТАГ в жировой ткани и печени.
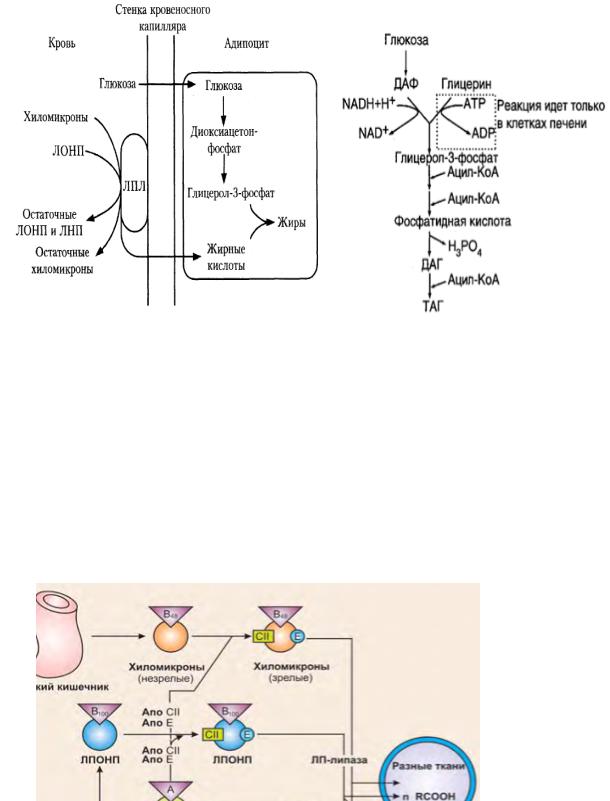
Депонирование жиров в адипоцитах
Жиры, синтезированные в печени, упаковываются в ЛПОНП (липопротеины очень низкой плотности) и секретируются в кровь. В кровотоке ЛПОНП не-зрелые получают от ЛПВП мембранные белки АпоСII и АпоЕ и становятся зрелыми, т.е. способными взаимодействовать с ЛП-липазой, которая гидролизует ТАГ в составе ЛПОНП до ВЖК и глицерола. Частицы, теряя жи-ры, уменьшаются в размере, но возрастают по плотности и превращаются сначала в ЛППП, а затем в ЛПНП:
Гормональная регуляция биосинтеза и распада ТАГ (влияние инсулина, глюкагона, адреналина). Действие лептина на жировую ткань.
Жиры, как и гликоген, являются формами депонирования энергетического материала. Жиры, депонированные в адипоцитах в абсорбтивный период, используются как источник энергии в период голодания и при длительной физической нагрузке.
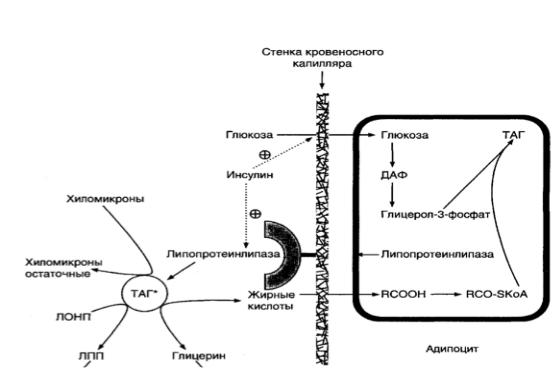
Депонирование жиров происходит в абсорбтивный период, когда увеличивается соотношение инсулин/глюкагон. В печени и в жировой ткани в этот период пищеварения одновременно активируются гликолиз и синтез жиров из АсСоА (их источник - глюкоза). В результате образуются все необходимые компоненты для синтеза жиров: глицерол-3-фосфат и активные формы жирных кислот. А β-окисление жирных кислот снижается, так как вследствие высокой концентрации малонил-КоА ингибируется карнитинацилтрансфераза, которая катализирует транспорт ацил-КоА в митохондрии для синтеза ВЖК.
В жировой ткани в абсорбтивный период повышение синтеза ТАГ происходит, так как инсулин активирует:
•синтез ЛП-липазы и ее экспонирование на поверхности капилляров жировой ткани. ЛП-липаза обеспечивает быстрое поступление жирных кислот в адипоциты, где они депонируются в составе триацилглицеринов.
•включение ГЛЮТ-4 в плазматическую мембрану. Это обеспечивает транспорт
глюкозы внутрь адипоцитов (жировая ткань является инсулинзависимой);
•гликолиз, что обеспечивает образование глицерол-3-фосфата и АТФ, необходимых для синтеза жиров;
•пентозофосфатный путь, в ходе которого образуется NADPН, необходимый для синтеза жирных кислот.
Депонирование жира в абсорбтивный период
Результат действия инсулина на обмен углеводов и жиров в печени - увеличение синтеза жиров и секреция их в кровь в составе ЛПОНП.
Мобилизация жиров, т.е. гидролиз до глицерола и жирных кислот, происходит в постабсорбтивный период, при голодании и активной физической работе.
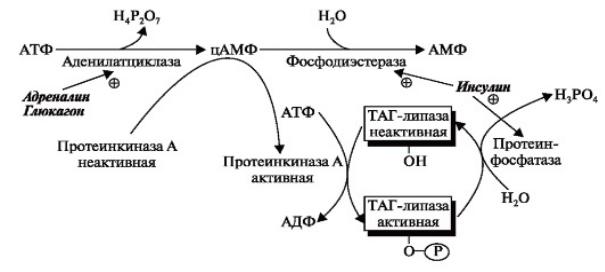
Гидролиз депонированных жиров стимулируется глюкагоном и адреналином и, в меньшей степени, некоторыми другими гормонами (соматот-ропным, кортизолом, лептином). В постабсорбтивный период и при голодании глюкагон, действуя на адипоциты через аденилатциклазную систему, активирует протеинкиназу А, которая фосфорилирует и, таким образом, активирует гормон чувствительную липазу, что инициирует липолиз и выделение жирных кислот и глицерина в кровь. При физической активности увеличивается секреция адреналина, который действует через β-адренергические рецепторы адипоцитов,
также активирует аденилатциклазную систему. Инсулин активирует специфическую протеинфосфатазу, которая дефосфорилирует гормончувствительную липазу, и распад жиров останавливается (рис. 3-7):
Гормональная регуляция распада ТАГ
Действие лептина на жировую ткань
Лептин (от лат. Leptos - тонкий, худой). Лептин - гормон жировой ткани, по химической природе - полипептид, синтезируется в адипоцитах. Рецепторы к лептину расположены в гипоталамусе и в тканях репродуктивной системы.
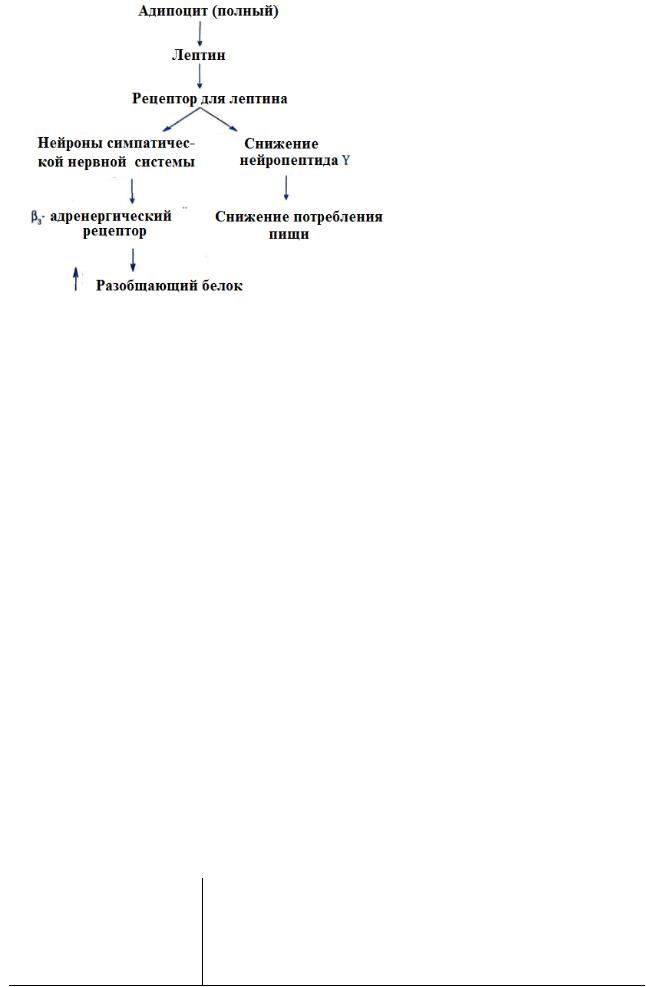
Лептин снижает выработку нейропептида Y, который вызывает повышение аппетита и усиливает синтез жира (точные механизмы воздействия Лептин также стимулирует выработку разобщающих
Механизм действия лептина
белков бурого жира пока неясны). Суммарный эффект лептина: снижение аппетита и усиление липолиза. Концентрация лептина в крови пропорциональна количеству жировых клеток. Поэтому, можно считать, что лептин передает в головной мозг информацию о количестве жира в организме. Лептин также усиливает репродуктивную функцию человека. В настоящее время ведутся работы над созданием рекомбинантного лептина для лечения ожирения. Cнижение массы тела на 10% приводит к уменьшению уровня лептина на 53%. Напротив, увеличение массы тела на 10% сопровождается повышением концентрации лептина в крови на 300%. Высокий уровень лептина объясняют неспособностью этого белка проникать в гипоталамус, где он связывается со специфическими рецепторами и подавляет секрецию нейропептида Y, вызывающего чувство голода и потребность в приеме пищи.
5. Биосинтез фосфолипидов (фосфатидил-этаноламина,-серина, -холина, сфингомиелана) путем активации полярного соединения: субстраты, общие пути биосинтеза ТАГ и фосфолипидов, активация субстратов, ферменты, последовательность реакций.
Локализация |
эндоплазматическая сеть клеток многих |
тканей, |
|
особенно: печени, кишечника, семенников, |
молочной |
|
железы |
|
Период |
быстрого роста, когда для производства новых мембран |
|
требуются фосфолипиды. |
Субстраты |
- глицеролфосфат, ацил-СоА, из которых синтезируется |
|
общий предшественник – диацилглицерол, |
|
- полярные соединения (полярная «головка»): |
|
этаноламин, фосфатидилхолин, серин, инозит |
|
- ЦТФ (цитидинтрифосфат) |
В зависимости от вида используемых ВЖК, образующаяся фосфатидная кислота направляется на синтез:
• ТАГ, если в ее состав вошли кислоты: пальмитиновая, стеариновая, пальмитоолеиновая, олеиновая кислоты,
• фосфолипидов при наличии в ее составе полиненасыщенных жирных кислот.
Первые стадии синтеза глицерофосфолипидов и ТАГ протекают одинаково до образования фосфатидной кислоты.
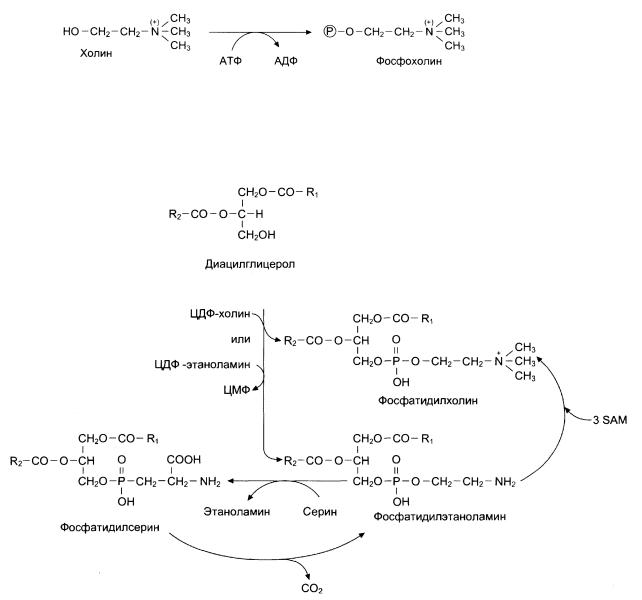
На следующем этапе цитидинтрифосфат (ЦТФ) активирует либо фосфорилированное полярное соединение, либо фосфатидную кислоту.
• Активация фосфорилированного полярного соединения («головки») используется для синтеза фосфатидилхолина, фосфатидилэтаноламина (R-OH), фермент цитидилилтрансфераза:
ROH + ЦТФ -> Н4Р2О7 + ЦДФ-R (цитидилдил-R), например:
Е: холинкиназа
Образовавшееся активированное полярное соединение - ЦДФ-R далее реагирует с диацилглицеролом с образованием соответствующего фосфолипида (рис.3-9):
Синтез фосфолипидов: фосфатидилэтаноламина, фосфатидилхолина, фосфатидилсерина.
