
metodichka_Lipidy_2020
.pdf
В результате β-окисления ВЖК полностью расщепляются до ацетил-СоА. Для полного распада, например, 16-углеродной молекулы пальмитиновой кислоты требуется семь таких повторяющихся циклов.
Окисление происходит по β-атому углерода и включает четыре последовательные реакции:
•дегидрирование (окисление)
•гидратация
•дегидрирование (окисление)
•тиолазная реакция
Субстраты: свободные насыщенные жирные кислоты с четным числом атомов углерода.
Локализация: митохондрии. Ферменты, катализирующие реакции окисления:
•длинноцепочечных жирных кислот, связаны с внутренней мембраной митохондрий.
•средне- и короткоцепочечных жирных кислот, локализованы в матриксе митохондрий.
1.дегидрирование ацил-СоА с участием кофермента FAD (используется, когда отщепляются «Н» от атомов с одинаковой
электроотрицательностью) с появлением двойной связи при С2 и образованием транс-изомера (природные ВЖК – цис-изомеры).
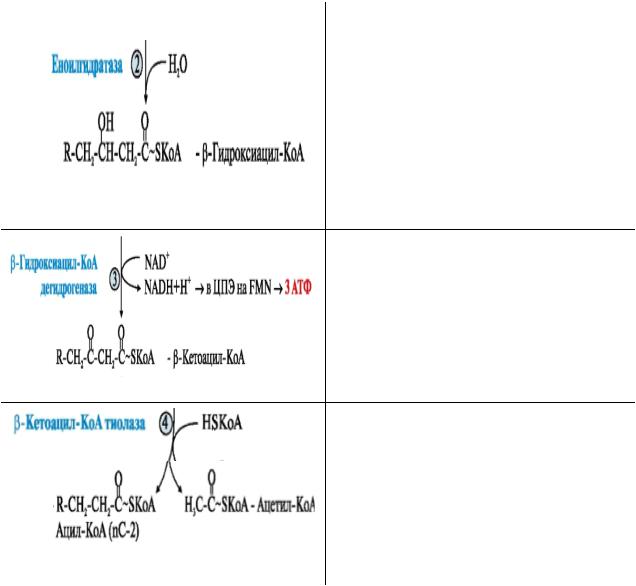
2. Гидратация протекает против правила Марковникова (из-за эффекта сопряжения электронная плотность смещается к электроотрицательному атому кислорода и на β-С возникает частично положительный заряд): ОН-группа присоединяется к β-С (отсюда название процесса).
3. Дегидрирование при β-С с участием NAD+ (отщепляет водороды от атомов с различной электроотрицательностью) приводит к образованию оксосоединения.
4.Расщепление дестабилизированной С-С связи при участии НSСоА (тиолиз), которое приводит к образованию: АсСоА и укороченного ацилСоА.
Далее цикл повторяется до полного расщепления ацилСоА на двухуглеродные фрагменты.
Суммарное уравнение β-окисления, например пальмитоил-КоА может быть представлено таким образом:
С15Н31СО-КоА + 7 FAD + 7 NAD+ + 7 HSKoA +7Н2О→
→8 CH3-CO-KoA + 7 FADH2 + 7 (NADH + H+)
Далее восстановленные эквиваленты окисляются в цепи переноса электронов: НАДН+Н+ +1/2О2 ->НАД+ +Н2О;
Биологическое значение окисления жирных кислот заключается в обеспечении организма энергией, теплом и водой.
Карнитинацилтрансфераза I - регуляторный фермент β-окисления: активаторы - АДФ, АМФ, ацил-КоА
ингибиторы - АТФ, малонил-КоА (печень).
Регуляция окисления ВЖК устроена так, что процесс окисления происходит только при недостатке энергии. Скорость окисления ВЖК зависит от скорости их транспорта из цитозоля в митохондрии, которой контролируется регуляторным ферментом – карнитинацилтрансферазой I и зависит от соотношения количества малонил-КоА/ацил-КоА. Чем выше в клетке концентрация малонил-КоА, тем ниже скорость переноса жирных кислот в матрикс митохондрий, так как малонил-КоА — аллостерический ингибитор карнитинацилтрансферазы I, а ацил-КоА —его активатор. Ингибированием карнитинацилтрансферазы I малонил-СоА обеспечивает подавление окисления жирных кислот каждый раз, когда в печень поступает слишком много глюкозы, из избытка которой активно синтезируются ТАГ.
Два фермента β-окисления: β-оксиацил-СоА дегидрогеназа и тиолаза
ингибируются по типу отрицательной обратной связи: избыток НАДН -ингибитор β- оксиацил-СоА дегидрогеназы, а высокие концентрации ацетил-СоА ингибируют тиолазу.
Катаболизм жирных кислот в мышцах регулируется соотношением АТФ/АДФ, т.е. при повышении АТФ в клетке активность карнитинацилтрансферазы I снижается. Жирные кислоты не поступают в митохондрии и β-окисления не происходит.
Энергетический эффект окисления насыщенной жирной кислоты.
Митохондиральное окисление жирных кислот протекает в три стадии:
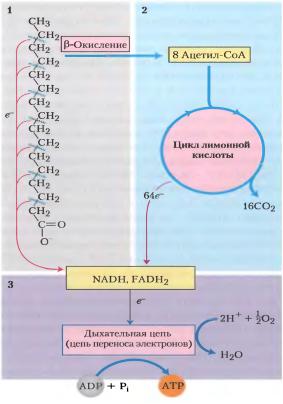
•на первой стадии происходит – окисление, где жирные кислоты подвергаются последовательному окислительному отщеплению двухуглеродных фрагментов в виде АсСоА.
•на второй стадии окисления АсСоА окисляются до СО2 в ЦТК, который также протекает в матриксе.
•Восстановленные эквиваленты (НАДН и ФАД.Н2), полученные на первой стадии, далее окисляются в цепи переноса электронов.
За один цикл β-окисления образуются:
•1 моль ацетил-КоА, окисление которого в цитратном цикле обеспечивает синтез 12 моль АТФ.
•1 моль FADH2 и 1 моль NADH, окисление которых в дыхательной цепи дает 2 и 3 моль АТФ соответственно.
При окислении пальмитиновой кислоты проходит 7 циклов β-окисления и образуется 8 моль ацетил-КоА, 7 моль FADH2 и 7 моль NADH+Н+. Следовательно, выход АТФ составляет 35 АТФ при β-окислении и 96 АТФ в результате цитратного цикла, что в сумме дает 131 моль АТФ. Поскольку активация ЖК требует затраты 1 АТФ, то из 131 следует вычесть 1 моль АТФ.
Общая формула для подсчета выхода АТФ при полном окислении насыщенных ВЖК записывается следующим образом:
[(n/2.10)] + (n/2-1).5]-1 = число моль АТФ при катаболизме 1 моль жирной кислоты
где n — число С атомов в молекуле ВЖК; n/2 — 1 — число циклов β-окисления;
5 — выход АТФ в одном цикле β-окисления;
n/2 — число ацетильных остатков;
10 — выход АТФ при полном окислении ацетил-КоА в цитратном цикле до СО2 и Н2О.
-1АТФ – затрачена на активацию ацилКоА.
Окисление ВЖК: с нечетным числом атомов углерода в радикале и ненасыщенных. Окисление ВЖК в пероксисомах.
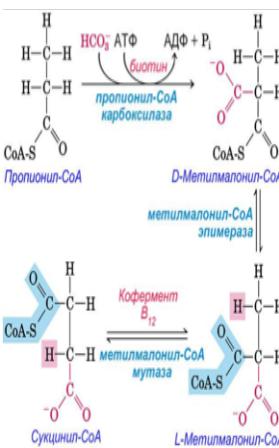
Процесс β-окисления предполагает распад высших жирных кислот с чётным числом углеродных атомов. Однако в клетках в определённых количествах содержатся и жирные кислоты с нечётным числом углеродных атомов. Для таких кислот циклическое двухуглеродное отщепление по типу β-окисления происходит до образования трёхуглеродного пропионил-СоА. Далее, в несколько стадий пропионил-СоА превращается сукцинил-СоА.
• На первой стадии происходит карбоксилирование пропионил-СоА с участием: энергии гидролиза АТФ, биотина (витамина Н) в качестве простетической группы и фермента пропионил-СоА-карбоксилазы,
• Затем фермент метилмалонил-СоА- эпимераза изомеризует D- метилмалонил-СоА в L-стереоизомер L- метилмалонил-СоА.
• Далее фермент метилмалонил-СоА- мутаза и кофермент витамин В12 превращают L-метилмалонил-СоА в сукцинил-СоА, который может: поступать в цитратный цикл, расщепляться до АсСоА, участвовать в синтезе гема.
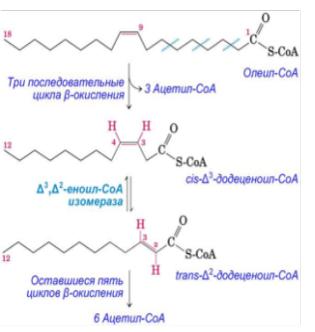
Окисление ненасыщенных ВЖК идет по пути β-окисления до получения жирной кислоты с –НС=СН- связью в положении С3. Эти связи находятся в цисконфигурации, изолированно (отсутствует эффект сопряжения и связи более стабильны), поэтому не могут подвергаться действию еноил-СоА гидратазы. Требуются дополнительные ферменты: еноил-КоА-изомераза и редуктаза, которые двойную связь: смещают к β-С и переводят в транс-конфигурацию. Далее β- окисление продолжается с участием ферментов, описанных ранее. Например, олеилСоА вступает в три последовательные цикла β-окисления с образованием АсСоА и ацильного радикала с двойной связью при С3. Далее происходит реакции изомеризации: смещение двойной связи к С2 и переход в транс-форму:
При расчете выхода АТФ за счет окисления ненасыщенных ВЖК можно пользоваться формулой для расчета выхода энергии при окислении насыщенных ВЖК, вычитая 2АТФ на каждую двойную связь.
Окисление ВЖК в пероксисомах
Основным местом окисления жирных кислот служит матрикс, однако у некоторых клеток в других компартментах также содержатся ферменты, способные окислять жирные кислоты до ацетил-СоА по пути, подобному митохондриальному.

Митохондрия |
Пероксисома |
В |
пероксисомах, |
|
заключенных |
в |
|
|
мембрану органелл клеток, в роли |
||||
|
|
промежуточных |
соединений |
– |
||
|
|
окисления выступают тиоэфиры , а |
||||
|
|
сам |
процесс |
|
идетничен |
|
|
|
митохондриальному |
–окислению: |
|||
|
|
дегидрированию, |
|
присоединение |
||
|
|
воды к образующейся двойной связи, |
||||
|
|
окисление –оксиацил-СоА до кетона |
||||
|
|
и |
его тиолитический разрыв |
|||
|
|
коферментом А. |
|
|
|
|
Пероксисомальная система отличается от митохондиальной тем, что:
• на первой стадии окисления электроны попадают непосредственно на О2, образуя Н2О2 и выделяемая энергия рассеивается в виде тепла (в митохондриях электроны попадают на О2 через дыхательную цепь, образуя Н2О и этот процесс сопровождается синтезом АТФ).
•НАДН, образованный на втором шаге окисления, не может быть вновь окислен в пероксисоме, поэтому восстановленные эквиваленты выводятся в цитозоль, вновь проникая со временем в митохондрии.
•АсКоА служит биосинтетическим предшественником, а митохондриальный –
окисляется в ЦТК.
Синтез и использование кетоновых тел: локализация, этапы, ферменты. Биологическая роль кетоновых тел. Кетонемия, кетонурия, причины их возникновения.
Кетоновые тела (историческое название) являются важными метаболитами во многих периферических тканях, в частности в сердечных и скелетных мышцах. Мозг при нормальных условиях в качестве источника энергии использует только глюкозу (жирные кислоты не проходят через гематоэнцефалический барьер), однако в период голодания малые водорастворимые кетоновые тела становятся главным источником энергии для мозга.
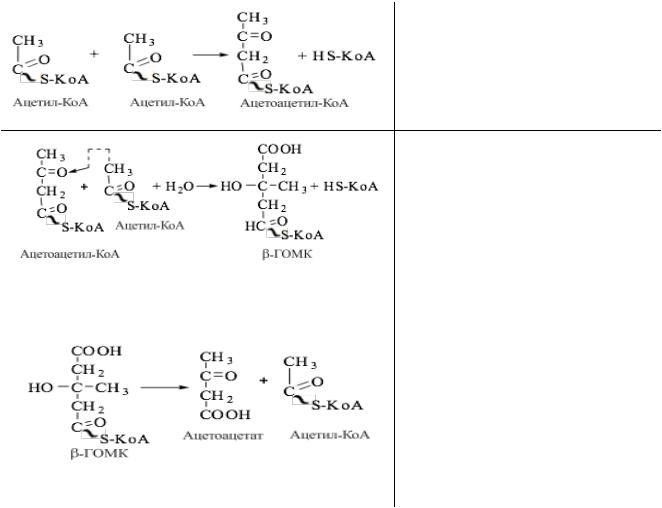
У здоровых нормально питающихся людей кетоновые тела синтезируются только в митохондриях гепатоцитов в незначительном количестве из АсКоА, который может либо поступить в ЦТК, либо превратиться в кетоновые тела: ацетон, ацетоацетат, β-гидроксибутират.
Синтез кетоновых тел протекает в несколько стадий:
фермент тиолаза катализирует конденсацию 2 молекул АсСоА в ацетоацетилСоА.
ГМГ-КоА-синтаза (индуцируемый фермент) присоединяет еще один ацетильный остаток к молекуле ацетоацетил-КоА и образуется гидроксиметилглутарил КоА(ГМГ КоА)
ГМГ-КоА-лиаза (есть только в митохондриальном матриксе) отрезает ацетильный остаток, включенный в молекулу ГМГКоА в 1-й реакции.
Образованный ацетоацетат может выходить в кровь и использоваться в других тканях в качестве источника энергии.
В клетках печени при активном β-окислении создаётся высокая концентрация NADH, поэтому большая часть ацетоацетата превращается в β-гидроксибутират. Эта реакция легко обратима и относительные количества образующихся ацетоацетата и β-гидроксибутирата зависят от соотношения NADH/NAD в матриксе митохондрий. В норме в сыворотке крови соотношение β-гидроксибутирата к ацетоацетату приблизительно равно 1:1.
При высокой концентрации ацетоацетата часть его неферментативно декарбоксилируется с образованием ацетона, который полностью удаляется из
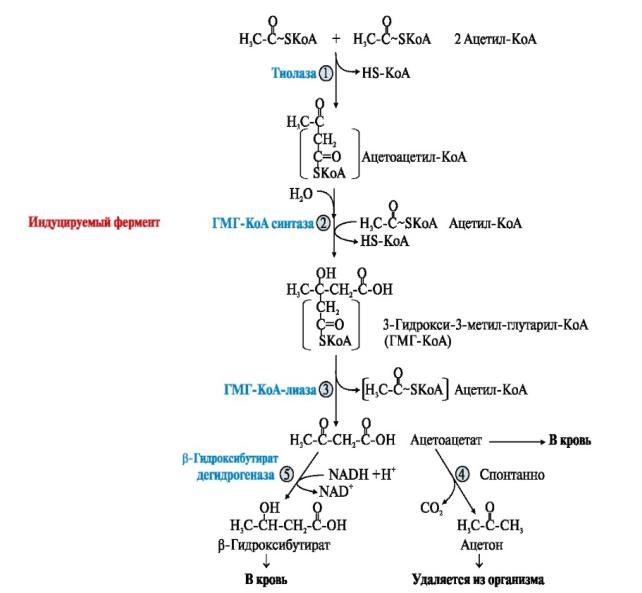
организма с потом, мочой и выдыхаемым воздухомУ здорового человека ацетон образуется в очень малых количествах.
Синтез кетоновых тел Регуляторный фермент синтеза кетоновых тел – гидроксиметилглутарил-
КоА синтаза (ГМГ-КоА синтаза). Это индуцируемый фермент, синтез которого увеличивается при повышении концентрации жирных кислот в крови. Это происходит при увеличении мобилизации жиров из жировой ткани под действием глюкагона, адреналина, секреция которых усиливается при голодании или физической нагрузке. Синтез ГМГ-КоА-синтазы репрессируется (выключается) при высоких концентрациях в клетке СоАSН.
Окисление кетоновых тел
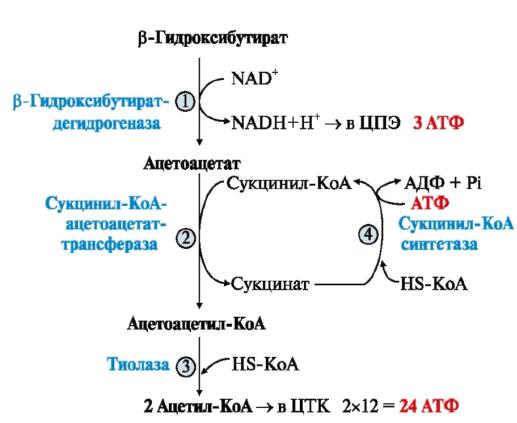
Молекулы β-гидроксибутирата и ацетоацетата из печени с током крови транспортируются в другие органы и ткани, проходят через гематоэнцефалический барьер и являются топливными молекулами.
β-гидроксибутират вновь окисляется до ацетоацетата (рис. 2-9).
Метаболизм ацетоацетата начинается с превращения его в активную молекулу, в основном, за счет переноса -S-КоА от молекулы сукцинил-КоА (2). Катализирует реакцию сукцинил-КоА-ацетоацетат-трансфераза (β-кетоацил-СоАтрансфераза),
этот фермент отсутствует в печени, поэтому кетоновые |
тела печенью не |
|
используются). Сукцинил-СоА, |
используемый в качестве донора кофермента А, |
|
удаляется из цикла Кребса, где |
снижается синтез ГТФ. |
Образовавшийся |
ацетоацетил-СоА под действием тиолазы и участии НSСоА |
расцепляется на 2 |
|
молекулы ацетил-КоА (3), которые затем включаются в цикл Кребса:
Метаболизм кетоновых тел во внепеченочных тканях Энергетический эффект полного окисления каждой молекулы
•ацетоацетата равен 23 АТФ (12 АТФ образуется при окислении каждой молекулы АсСоА, -1АТФ – на активацию)
•β-гидроксибутирата - 26 моль АТФ (за счет окисления НАДН+Н+)
