
УП- Биоорганическая химия
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ ИНСТИУТ БИОФИЗИКИ ФИЦ КНЦ СО РАН
Л.А. ФРАНК
БИООРГАНИЧЕСКАЯ ХИМИЯ
Учебное пособие
Красноярск
2017
УДК
Рецензенты:
В.А. Кратасюк, д-р биол. наук, зав. кафедры биофизики Института фундаментальной биологии и биотехнологии СФУ
Т.А. Верещагина, д-р хим. наук, вед. научн. сотр. Института химии и химической технологии СО РАН
Биоорганическая химия: учеб. пособие / Л.А. Франк. – Красноярск: Сиб. федер. ун-т, ИБФ СО РАН, 2017. – стр.
В учебном пособии рассмотрены строение и свойства важнейших биологических молекул
– биополимеров (белков, нуклеиновых кислот, углеводов, липидов, смешанных биополимеров), их структурных компонентов, а также низкомолекулярных биолочиски активных соединений. Показаны закономерности и связи между строением органических соединений и их биологической функцией. Изложены принципы ряда основных методов применяемых в биоорганической химии для изучения структуры и свойств биомолекул.
Пособие предназначено для студентов, обучающихся по направлению «Биология», профили подготовки: 06.03.01.07 – Биофизика; 06.03.01.08 – Биохимия; 06.03.01.10 – Биоэкология; 06.03.01.11 – Биоинженерия и биотехнология
2
ОГЛАВЛЕНИЕ |
|
ВВЕДЕНИЕ .................................................................................................................................... |
4 |
ЧАСТЬ 1. БЕЛКИ: СТРОЕНИЕ, СВОЙСТВА, ФУНКЦИИ .................................................. |
15 |
1.1Аминокислоты ........................................................................................................................ |
15 |
1.1.1 Строение, номенклатура, свойства ............................................................................... |
15 |
1.1.2 Стереоизомерия α-аминокислот .................................................................................... |
25 |
1.2 Пептидная связь, пространственная организация полипептидов..................................... |
32 |
1.3Связь пространственная структура–функция белка ........................................................... |
42 |
Задачи и упражнения к Части 1.................................................................................................. |
69 |
2.1. Нуклеиновые основания, нуклеозиды, нуклеотиды ......................................................... |
74 |
2.2. Строение молекулы ДНК..................................................................................................... |
79 |
2.4. Денатурация ДНК................................................................................................................. |
84 |
2.7. Определение первичной структуры ДНК .......................................................................... |
89 |
2.8. Химический синтез олигонуклеотидов .............................................................................. |
98 |
2.9. Синтетические олигонуклеотиды с особыми свойствами.............................................. |
102 |
ЦИТИРУЕМАЯ ЛИТЕРАТУРА .............................................................................................. |
109 |
ЧАСТЬ 3. УГЛЕВОДЫ ............................................................................................................. |
111 |
3.1. Моносахариды .................................................................................................................... |
111 |
3.2. Химические свойства моносахаридов .............................................................................. |
118 |
3.3. Полисахариды ..................................................................................................................... |
122 |
3.4. Гликоконъюгаты: протеогликаны и гликопротеины ...................................................... |
127 |
3.5. Анализ структуры углеводов ............................................................................................ |
132 |
ЦИТИРУЕМАЯ ЛИТЕРАТУРА .............................................................................................. |
137 |
ЧАСТЬ 4. ЛИПИДЫ.................................................................................................................. |
138 |
4.1. Запасные липиды ................................................................................................................ |
138 |
4.2. Структурные липиды ......................................................................................................... |
145 |
4.3. Определение структуры липидов ..................................................................................... |
149 |
4.4. Неомыляемые липиды........................................................................................................ |
153 |
3
ВВЕДЕНИЕ
Биоорганическая химия – это фундаментальная наука, которая изучает компоненты живой материи, устанавливая связь между строением и функцией важнейших биомолекул.
Объектом ее изучения являются макромолекулы – биополимеры (белки, нуклеиновые кислоты, углеводы, липиды), биополимеры смешанного типа (гликопротеины,
нуклеопротеины, липопротеины и пр.), а также низкомолекулярные соединения,
выполняющие важные биологические функции, как правило, регуляторного характера
(гормоны, витамины, токсины, антибиотики и пр.). Фактически биоорганическая химия охватывает химию всех веществ живой природы, представляя собой химический фундамент современной биологии.
Основными задачами биоорганической химии являются:
выделение объекта в индивидуальном состоянии;
установление его структуры;
проведение химического синтеза или направленной модификации для подтверждения структуры соединения, выявления связи структура-функция, а также получения практически ценных продуктов;
тестирование in vivo и in vitro
Возникнув на стыке нескольких дисциплин – органической и физической химии,
биологии и физики, биоорганическая химия для решения своих задач использует практически весь арсенал современных методов исследования: химические, физические,
физико-химические, биологические, математические.
Круг интересов этой науки чрезвычайно широк – только перечисление всех веществ,
находящихся в живой природе, и описание их свойств составляет громадный объем информации, иногда представляющей интерес лишь для узких специалистов. В рамках данного курса будут изложены основы биоорганической химии важнейших биомолекул – белков, нуклеиновых кислот, углеводов и липидов, а также ряда биологически активных низкомолекулярных соединений.
4

Некоторые сведения из органической химии, которые надо знать, прежде чем приступить к изучению биологических макромолекул
Углеводороды – соединения, в состав которых входят 2 элемента – углерод и водород. В зависимости от строения все они делятся на два основных класса – алифатические и ароматические углеводороды. Алифатические углеводороды, в свою очередь, делятся на 4 основных класса – алканы, алкены, алкины и их циклические аналоги (циклоалканы, циклоалкены, циклоалкины). Предельные углеводороды – алканы,
имеют общую формулу СnH2n+2. Номенклатура (названия) этих соединений лежит в основе номенклатуры всех органических соединений. Это: метан, этан, бутан, пентан, гексан,
гептан, октан, нонан, декан, додекан и т.д. для значений n=1, 2,…11 и т.д., соответственно.
Изучая строение этих соединений, вы узнали, что атом углерода в них образует 4
равнозначных энергетически ковалентных связи, несмотря на то, что его внешняя электронная оболочка содержит энергетически разные электроны – 2s22p2. Оказалось, что в предельных углеводородах эти электроны находятся на «обобществленных»,
энергетически равнозначных sp3-гибридных орбиталях, направленных от ядра к углам тетраэдра (Рис. В-1).
Рис. 1. Электроны на внешней оболочке атома углерода находятся на энергетически равных гибридных орбиталях sp3-типа. Это определяет пространственное расположение электронов относительно ядра атома и направление ковалентных связей С-С и С-Н (показано на примере молекулы пропана).
Отсюда следует пространственное расположение ковалентных связей, образуемых этими электронами: атом углерода находится в центре тетраэдра, а четыре его заместителя
– в углах тетраэдра. Плоские углы между орбиталями составляют около 109°. Изображая
5
структуры органических молекул на плоскости, мы всегда помним, что часть связей направлена за плоскость рисунка, а часть – к читателю, над плоскостью рисунка.
Изучая структурные особенности этих соединений, вы встретились с понятием
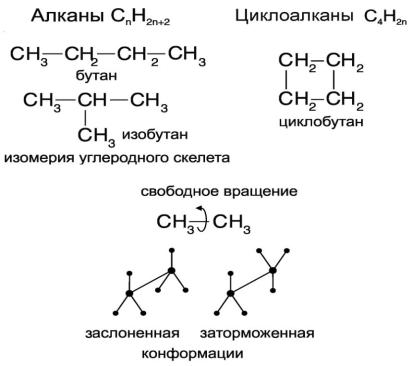
изомерии – случаями, когда соединения имеют одинаковую брутто-формулу, но разные пространственные структуры. Для углеводородов характерны изомерия углеродного скелета, а также варианты структур, связанные с вращением атомов вокруг ковалентных
δ-связей С–С – разные конформационные состояния. Примеры таких пространственных изомеров приведены на Рис. 2. Пространственные изомеры отличаются по структуре и,
потому обладают различными физическими свойствами (температурой плавления,
кипения и пр.), а также химической реакционной способностью (направление реакций в ту или иную сторону и, как следствие, образование разных продуктов).
Рис. 2. Для алканов характерна изомерия углеводородного скелета. Вращение вокруг одинарных связей свободное, однако из-за стерических препятствий радикалов или электростатического отталкивания протонов существуют более или менее энергетически выгодные положения.
Еще один вариант устройства углеродного скелета – это циклические углеводороды,
когда атомы углерода соединены в цикл (общая формула циклоалканов совпадает с формулой алкенов – СnH2n). Самым маленьким циклом является, естественно,
циклопропан. Отметим, что 3-х и 4-членные циклоалканы – соединения нестойкие,
поскольку углы между атомами С в них существенно отличаются от 109°.
6
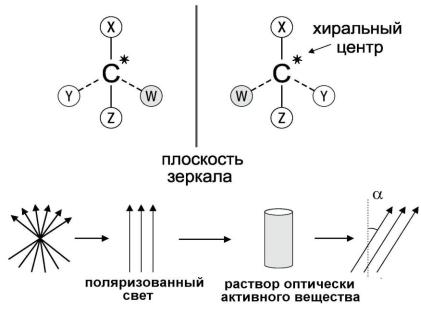
Особым случаем изомерии является так называемая пространственная изомерия или
энантиомерия. Энантиомеры – это молекулы, представляющие собой зеркальные отражения друг друга, которые невозможно совместить путем вращения или перемещения в пространстве, не допуская разрыва связей (Рис. 3). Все физико-химические свойства энантиомеров одинаковы за исключением способности вращать плоскополяризованный свет в разные стороны. Эту способность называют оптической активностью.
Рис. 3. Оптические изомеры представляют собой зеркальное отображение друг друга. Оптически активные вещества поворачивают поляризованный свет на угол α.
Различия в химических свойствах энантиомеров наблюдаются только в
реакциях с оптически активными реагентами. Оптически активными являются соединения, в которых есть хотя бы один атом углерода с четырьмя различными заместителями (атомами или группами атомов). Этот атом углерода называют хиральным
центром. Оптическая изомерия очень важна при рассмотрении биологических молекул,
как мы увидим далее при изучении белков и углеводов.
Непредельные углеводороды – алкены (общая формула СnH2n, n≥2) и алкины (общая формула СnH2n-2, n≥2) – соединения, в которых часть электронов внешней оболочки углерода не образуют ковалентной связи с другими атомами, а находятся в сопряжении друг с другом. При этом остальные электроны, образующие сигма-связи, пространственно и энергетически находятся на sp2-гибридных орбиталях или sp-гибридных орбиталях (Рис.
4). Графически это изображается двойными или тройными связями, которые образуются за счет перекрытия орбиталей (называемых π-орбиталями) этих «свободных» электронов.
7
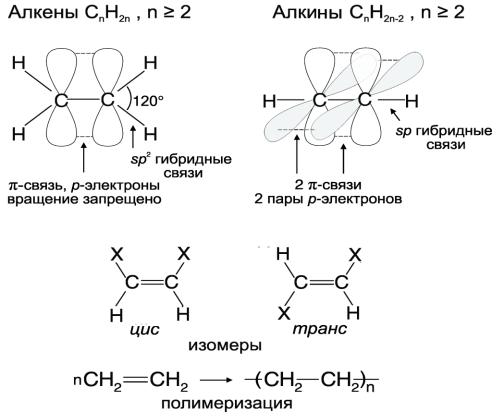
Для обозначения этих соединений используют названия соответствующих алканов с суффиксами -ен (этен, пропен и т.д.) или -ин (этин, более известный как ацетилен, пропин и т.д.).
Характерным свойством непредельных углеводородов, которое отличает их от алканов, является способность вступать в реакцию присоединения по двойным и тройным связям. Одной из важных реакций непредельных соединений является реакция
полимеризации, в результате которой из множества одинаковых молекул образуются очень большие молекулы – полимеры, состоящие из повторяющихся звеньев – мономеров
(Рис. 4). Важнейшие биологические молекулы – белки, нуклеиновые кислоты и углеводы
– являются полимерными молекулами.
Рис. 4. Образование двойных и тройных связей. Цис-транс изомерия и полимеризация этена (этилена).
Изучая свойства непредельных углеводородов вы познакомились с другим видом изомерии, а именно геометрической цис-транс изомерией, которая обусловлена наличием кратных связей С=С, запрещающих свободное вращение атомов и радикалов вокруг них
(Рис. 4).
Особое место среди непредельных углеводородов занимают ароматические соединения – арены. Это циклические соединения с несколькими (в случае бензола –
8
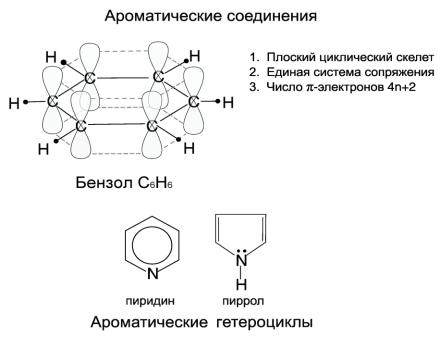
тремя) двойными связями, которые образуют общую систему сопряженных π-электронов
(Рис. 5). Ароматические соединения в силу своего строения обладают рядом физико-
химических свойств, отличающих их от циклических непредельных соединений:
склонностью к реакции замещения вместо присоединения, характерными спектрами поглощения УФ и видимого света и пр. Помимо циклического строения (все атомы цикла должны лежать в одной плоскости), характерным признаком ароматических соединений является количество делокализованных р-электронов – их должно быть 4n+2, и все они должны быть в общей системе сопряжения (правила Хюккеля).
Рис. 5. Структура молекула бензола, правила Хюккеля. Ароматическими могут быть и гетероциклы, например пиридин и пиррол. Вопрос: Отвечают ли они правилам Хюккеля?
Вспомним соединения, содержащие помимо углерода и водорода кислород: спирты,
карбонильные (альдегиды и кетоны) и карбоксильные соединения – карбоновые кислоты
(Рис. 6).
Спирты – соединения общей формулы R-OH, где R – углеводородный остаток, ОН – гидроксильная группа, являющаяся функциональной и определяющей свойства,
характерные для данного класса соединений. К названию этих соединений добавляют суффикс -ол (метанол, этанол и т.д.). Соединения, в которых гидроксильная группа непосредственно связана с ароматическим кольцом, называются фенолами, их свойства сильно отличаются от свойств алифатических спиртов. Спирты проявляют свойства
9
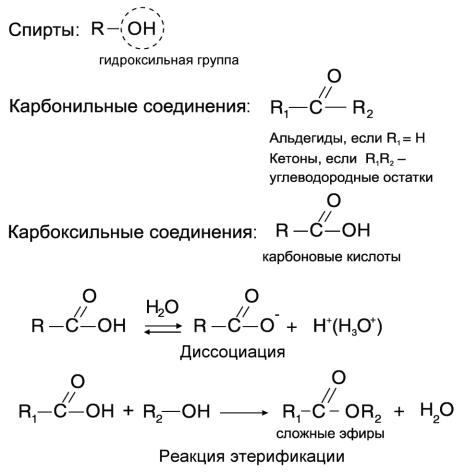
оснований, присоединяя протон в присутствии сильных кислот c образованием соединений R-OH2+. В то же время, атом кислорода обладает высокой электроoтрицательностью, что приводит к поляризации связей С-Oδ--Hδ+. В
Рис. 6. Общие структурные формулы спиртов, карбонильных и карбоксильных соединений. Карбоновые кислоты, как и неорганические кислоты, диссоциируют с образованием протона (в водной среде он находится в виде иона гидроксония Н3О+). При взаимодействии спиртов и карбоновых кислот происходит реакция этерификации с образованием сложных эфиров.
присутствии сильных оснований (например, щелочных металлов) они проявляют кислотные свойства и образуют соответствующие соли (алкоголяты) формулы R-C-O-Me+.
В присутствии сильных кислот спирты проявляют свойства оснований, присоединяя протон c образованием соединений R-OH2+. Таким образом, в зависимости от условий спирты могут быть как кислотами, так и основаниями.
Рассмотрим подробнее вопрос о кислотности и оснóвности химических соединений.
Существует несколько определений терминов кислота и основание. В рамках нашего
10
