
УП- Биоорганическая химия
.pdfНа следующем этапе все четыре реакционных смеси наносят в лунки геля и проводят электрофорез. Полосы фрагментов с радиоактивной меткой проявляют с помощью фотобумаги.
Сборку молекулы проводят с самого короткого фрагмента (того, что имеет самый большой пробег на картинке фореза). В нашем случае это pG в первой лунке и pG во второй. В случае такого совпадения в последовательности указывается нуклеотид из первой лунки, где проводилось расщепление только по одному из оснований. Следующая полоса – это фрагмент из 3-й пробирки, и он соответствует двойке рGT, т.е. в нашей последовательности следующая буква – Т. Далее на форезной картинке мы видим две полоски с одинаковым пробегом – в лунках 3 и 4. Это тринуклеотиды рGTC (они есть в обеих пробирках – см. выше), оба заканчиваются на С, т.е. в нашей последовательности следующая буква – С. И так далее. Таким образом, прочтение последовательности происходит при продвижении по полосам на этой картинке снизу вверх, как по лесенке и в результате восстанавливают всю последовательность исходного олигонуклеотида.
Этот способ секвенирования был разработан в 1977 г. А. Максамом и У. Гилбертом и назван их именем (Maxam-Gilbert method). За исследования в этой области в 1980 г. они были удостоены Нобелевской премии по химии совместно с Ф. Сенгером и П. Бергом.
В основе ферментативного способа секвенирования ДНК лежит способность фермента ДНК полимеразы синтезировать новую цепь нуклеотида, соответствующую
(комплементарную) материнской цепи.
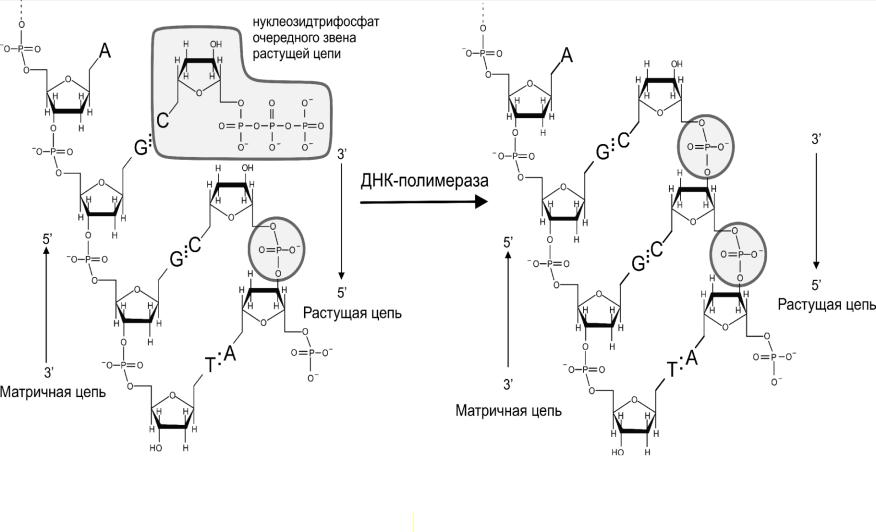
ДНК-полимераза 1 (Pol1, 928 а.к.) является ключевым ферментом при репликации ДНК. Этот фермент, «двигаясь» по одноцепочечной молекуле ДНК, катализирует образование фосфодиэфирных связей, между 3’ гидроксилом предыдущего нуклеозида и
5’ фосфатной группой следующего (Рис. 2-15). Т.е. рост новой цепи, комплементарной материнской, происходит в направлении от 5’ к 3’ концу. В качестве «строительного материала» используются 5’ нуклеозидтрифосфаты ТТP, АТP, GТP и СТP. Скорость синтеза комплементарного полимера велика, например, у прокариот она составляет 1000
н.о. в секунду. Открытие этого фермента принадлежит американскому биохимику Артуру Корнбергу, за которое он получил Нобелевскую премию 1959 г. ДНК-полимераза 1
используется как ключевой элемент полимеразной цепной реакции (ПЦР), применяемой в генетической инженерии и молекулярном анализе, когда необходимо получить определенный фрагмент ДНК в больших количествах – амплифицировать, т.е.
размножить его. Схема этой реакции приведена на рисунке 2.16.
91
92
Рис. 2.15. Схема реакции, катализируемой ДНК-полимеразой.
В пробирку вносят: а) молекулу ДНК, которую надо размножить, она называется матрицей; б) 2 праймера – олигонуклеотиды длиной 20-25 н.о., комплементарные крайним участкам цепей ДНК, которые будет размножены; в) набор 5’-нуклеозидтрифосфатов
(NTP) и г) фермент Pol1. Праймеры необходимы, поскольку полимераза не работает с
«пустого» места, она катализирует реакцию конденсации между 3’ гидроксилом предыдущего нуклеотида, который является последним в сдвоенной материнской цепи с
5’ фосфатной группой последующего нуклеотида, комплементарного первому нуклеотиду одноцепочечной матрицы. Вначале сдвоенную молекулу ДНК денатурируют плавлением при повышенной температуре (на Рис 2.16 это 94°С). Затем температуру реакционной смеси понижают (на Рис. 2.16 до 52°С). При этом с 3’-концов каждой одноцепочки присоединяются соответствующие праймеры. Этот процесс называется «отжиг праймеров». ДНК-полимераза синтезирует на каждой материнской цепи комплементарную дочернюю, удлинняя праймеры в направлении 5’→3’. Далее полученные 2 двойные молекулы вновь плавят, отжигают праймеры, и затем они
«прирастают» уже на 4-х копиях. И так далее. С каждым циклом в смеси количество копий увеличивается в 2n раз, где n – количество циклов реакции.
Используемая в ПЦР полимераза должна сохранять активность при высокой температуре длительное время, что для обычных белков не характерно. Настоящим подарком для молекулярных биологов стала полимераза, выделенная из термофильных батерий Thermus aquaticus (Taq-полимераза), обитающих в горячих источниках (данный фермент упоминался в Части 1 данного учебника). В отличие от обычных ферментов,
температурный оптимум которых находится в диапазоне 35-40ºС, Taq-полимераза сохраняет свою функциональную активность при температуре около 100 ºС.
Ф. Сенгер разработал способ секвенирования ДНК на основе ПЦР, за что в 1980 г.
был удостоен Нобелевской премии повторно (первую он получил за установление структуры молекулы инсулина в 1958 г.). Этот способ секвенирования назвали егоименем.
Другие названия этого метода — метод обрыва цепи или метод дидезокситерминаторов.
Обрыв цепи, или терминация, происходит, когда в дочернюю цепь включается
93

Рис.2.16. Схема полимеразной цепной реакции (ПЦР).
нуклеозидтрифосфат без 3’-гидроксильной группы – дидезоксирибонуклеозидтрифосфат ddNTP Принцип секвенирования по Сенгеру приведен на рисунке 2.17. В реакционную смесь вносят все необходимые компоненты ПЦР. Затем делят ее на 4 части и в каждую дополнительно вносят один из дидезоксинуклеозидтрифосфатов. Каждый раз, когда при.
синтезе межнуклеотидной связи в цепь включается такой остаток, дальнейший синтез полимера останавливается – в нем нет 3’-ОН. Таким образом, в пробирке с ddATP
накапливаются олигонуклеотиды разной длины, каждый из которых оканчивается на аденозин, в пробирке с ddСТP – на цитидин, в пробирке с ddGТP – на гуанозин, а с ddTTP
– на тимидин. Далее реакционные смеси анализируют с помощью гель-электрофореза в денатурирующих условиях. В зависимости от размера продукты ПЦР двигаются в геле с разной скоростью. Полученную картинку проявляют радиоавтографией. Для этого
94

Рис. 2.17. Принцип секвенирования по Сэнгеру.
продукты метят изотопной меткой, используя в реакционной смеси добавку радиоактивно-меченного 32Р АТР.
Полученное изображение читают снизу вверх по полоскам, начиная от полосы самого маленького молекулярного веса (Рис. 2.17). Прочитанная таким образом последовательность комплементарна исходной матрице.
В наше время секвенирование проводят в автоматическом режиме, а для анализа используют флуоресцентные метки, которые присоединяют к молекулам дидезокситрифосфатов. Каждая флуоресцентная метка имеет свой спектр свечения
(окраску). Для электрофореза используют капилляры, заполненные гелем. Свечение инициируется лазерным лучом и по цвету соотносится с соответствующим основанием..Пример получаемой при этом картинки приведен на рисунке 2.18
95

Рис. 2.18. Фрагмент гена рецептора MC1R. Каждая буква отражается своим цветом. Этот образец имеет гетерозиготный генотип, когда в аллелях на одном и том же месте находятся разные нуклеотиды C и T (показано стрелкой). Такая мутация называется однонуклеотидным полиморфизмом. Таким образом, секвенирование позволяет выявлять в том числе и наличие мутаций.
Центр коллективного пользования "Геномика" СО РАН (Новосибирск) обладает
широкими возможностями как для высокопроизводительного параллельного секвенирования (Next Generation Sequencing) геномов, митогеномов или отдельных
локусов, так и для классического секвенирования ДНК по Сэнгеру. Так, автоматический
генный анализатор ABI 3130XL производства фирмы Applied Biosystems (США) способен
достоверно определять последовательности ДНК длиной до 1000 нуклеотидов (Рис. 2.19).
Прибор одновременно анализирует 16 образцов, разделяя продукты реакции Сэнгера в
капиллярах диаметром около 50 мкм и длиной до 80 см, заполненных полимером
(модифицированным линейным полиакриламидом). Идентификация конкретного нуклеотида на определенной позиции секвенируемой последовательности ДНКпроисходит благодаря флуоресценции включенных в продукты реакции Сэнгера и связанных с соответствующими дидезоксинуклеозидтрифосфатами меток BigDye,
облучаемых лазером при прохождении фрагмента ДНК через кварцевый участок капилляра
96

Рис. 2.19. Вверху – фото зала с автоматическими генными анализаторами ABI 3130XL; внизу – один из этих приборов с открытой дверцей термостатируемой камеры, в которой находятся: 1) 16 капилляров длиной 80 см, заполненных полимером для электрофоретического разделения продуктов реакции Сэнгера с точностью в один нуклеотид; 2) камера, где происходит облучение лазером кварцевого окна каждого капилляра движущихся в среде полимера продуктов реакции Сэнгера и регистрация флуоресценции включенных в них BigDye красителей; 3) блок автоматического позиционирования для электрокинетического нанесения образцов в капилляры. Показаны 96-луночные планшеты с образцами для анализа, закрытые протыкаемыми резиновыми ковриками и белыми крышками, и четыре емкости, одна с буфером для электрофореза и три с водой для замены использованного полимера с помощью продавливания через капилляры и ополаскивания электродов.
.Материал любезно предоставлен к.х.н. Бондарем А.А., ИХБиФМ, Новосибирск.
97
2.8. Химический синтез олигонуклеотидов
Химический синтез олигонуклеотидов еще 20 лет назад представлял собой сложную экспериментальную задачу, связанную с большими затратами времени и реактивов, в
результате чего олигонуклеотиды были достаточно дороги. Сегодня их получение осуществляется с помощью автоматических синтезаторов, и исследователь должен только правильно определить, какая именно нуклеотидная последовательность необходима для решения поставленной задачи.
Для обеспечения направленного синтеза необходимо так же, как и в случае пептидного синтеза, блокировать функциональные группы нуклеозида, не участвующие на данном этапе синтеза. Это, например, 5’-гидроксильная группа и всегда экзоциклические аминогруппы гетероциклических оснований цитидина, гуанозина и аденозина. Как правило, для этого используют ацильные остатки, которые удаляются в щелочных условиях по окончании синтеза.
Во всех синтезаторах синтез осуществляется твердофазным методом – то есть первый нуклеозид иммобилизован на поверхности нерастворимых полимерных частиц, а
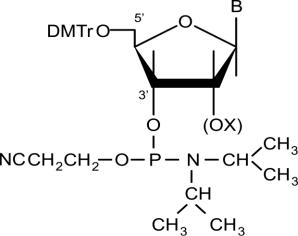
растущая цепочка экспонирована к реакционной смеси, в которой находятся все необходимые реагенты. Частицы упакованы в колоночных реакторах, через которые последовательно прокачиваются растворы веществ, обеспечивающих протекание процессов синтеза. Для обеспечения оптимальных гидродинамических параметров колонки частицы имеют сферическую форму и одинаковые размеры. Ключевыми мономерами для синтеза во многих случаях являются четыре производных нуклеозид фосфорамидита (Рис. 2.20),
Рис. 2.20. Мономеры для твердофазного фосфитамидного синтеза олигонуклеотидов (синтоны). (ОХ) – защищенный 2’-гидроксил в случае синтонов риборяда. В – производное гетероциклического основания с блокированной аминогруппой, DMTr – диметокситритил, защитная группа 5’-гидроксила.
98

в которых все функциональные группы заблокированы защитными группами. 5'-
гидроксильная группа каждого мономера защищена диметокситритильной группировкой
(DMTr), легко удаляемой при кислотной обработке, например, трихлоруксусной кислотой
(ТХУ). По 3'-положению находится метилированная фосфитамидная группа. В этом соединении фосфор находится в степени окисления 3 и отличается высокой реакционной способностью к нуклеофилам, в нашем случае это 5’-гидроксильная группа предыдущего нуклеозида. Конденсация проходит в течение нескольких минут. Экзоцикличные аминогруппы, находящиеся в составе гетероциклических оснований В (гуанина, аденина и цитидина), заблокированы группировками (ацетильными остатками), которые удаляются в щелочных условиях по окончании синтеза. Такие мономеры называются синтонами.
На рисунке 2.21 показана схема проведения твердофазного синтеза олигонукдеотидов,
Рис. 2.21. Схема химического синтеза олигонуклеотидов на полимере. Р – нерастворимый полимерные или стеклочастицы, на поверхности которых фиксированы первый нуклеотид и растущая олигонуклеотидная цепь; В1, В2… – блокированные основания, DMTr – диметокситритил, защитная группа 5’-гидроксила.
99
включающая четыре стадии: 1) освобождение кислотной обработкой 5'-гидроксила первого нуклеозида, иммобилизованного на поверхности частиц, и промывка реактора для удаления всех веществ, оказавшихся в растворе (детритилирование); 2) внесение в реактор смеси следующего мономера – синтона и активатора (тетразола), при этом происходит присоединение фосфорамидита (удлинение цепи на одно звено); 3) после промывок внесение в реактор уксусного ангидрида для ацетилирования непрореагировавших гидроксильных групп (кэпирование); 4) после промывок окисление межнуклеотидного фосфита до фосфата действием иодной смеси. Затем производят промывку реактора и начинают следующий цикл реакций с детритилирования уже второго нуклеозида. В
современных синтезаторах каждый цикл происходит за 5-7 минут. Чтобы выход конечного олигонуклеотида был достаточно высок, выход продукта на каждом цикле должен быть очень высоким. Например, если при синтезе 20-членного олигонуклеотида выход каждого цикла составляет 99%, то целевой олигонуклеотид получится с выходом
82%. Как правило, реальная эффективность каждого цикла составляет 95% и «двадцатку» получают с выходом около 36%.
Повышению эффективности синтеза значительно способствует высокая степень чистоты всех реагентов и химикатов. Исключительно важной для получения заданной последовательности является стадия кэпирования, когда не прореагировавшие 1-5% 5'-
гидроксильных групп предыдущего синтона блокируются, чтобы по ним не накапливались ложные последовательности. После окончания синтеза проводят удаление всех защитных групп, отсоединение полученного продукта от полимерной частицы и его элюцию с колонки (реактора). Целевой олигонуклеотид, обладающий максимальной молекулярной массой, выделяют с помощью высокоэффективной жидкостной хроматографии либо электрофореза в полиакриламидном геле.
Сегодня химический синтез олигонуклеотидов, как природных, так и модифицированных, проводится рядом биотехнологических фирм, в том числе и российских. Стоимость синтеза невелика и зависит от длины и состава олигонуклеотида, а
также от качества его очистки. На Рис. 2.22 показан один из простейших ДНК/РНК синтезаторов отечественного производства ASM-800 (Биоссет, Новосибирск). Прибор способен синтезировать олигонуклеотиды длиной до 100 н.о. одновременно в 8-ми колонках-реакторах. Выход продукта на каждой стадии наращивания олигонуклеотидной
цепи для ДНК-олигонуклеотидов составляет более 98,5%.
100
