
УП- Биоорганическая химия
.pdf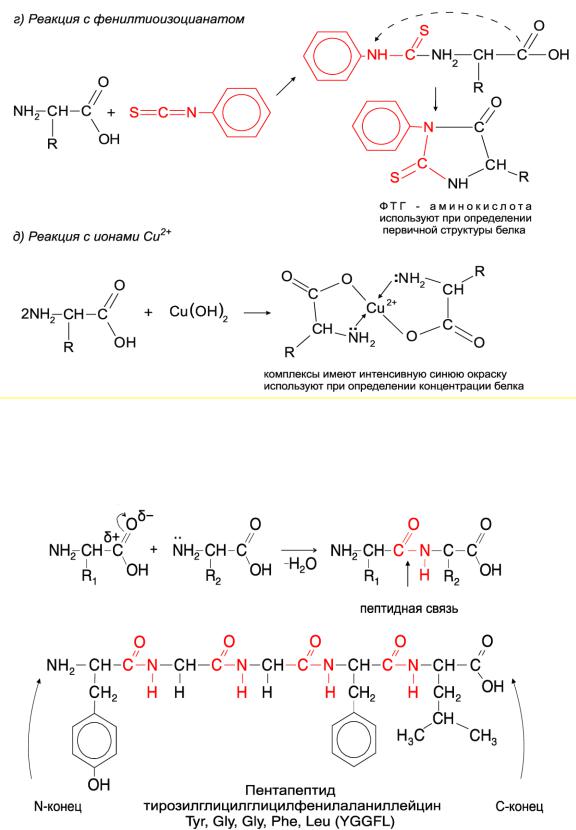
Рис. 1.11. Некоторые реакции карбоксильной и аминогрупп, характерные для аминокислот.
Рис. 1.12. Образование пептидной связи можно рассматривать как атаку свободной пары электронов аминогруппы на обедненный электронной плотностью углерод карбоксильной группы.
31
Главным свойством аминокислот является способность соединяться в длинные цепи через образование пептидной связи. Формально эту реакцию можно представить как поликонденсацию аминокислот с получением длинной линейной полимерной молекулы и выделением молекулы воды на каждом этапе роста цепи (Рис. 1.12). Получаемая при этом амидная связь между альфа-карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты называется пептидной, а получаемые при этом полимеры –
полипептидами. В обычных условиях при простом смешивании аминокислот в растворе эта реакция не происходит. С тем, как проводят химический синтез полипептидов, мы познакомимся позднее. В клетке, как вы знаете из курса биологии, синтез полипептида осуществляется на специальных органеллах – рибосомах, при участии целого комплекса соединений: ферментов, кофакторов, матричной и транспортной РНК, а для образования одной пептидной связи требуется энергия нескольких молекул АТФ и ГТФ.
Каждый полипептид имеет свободную аминогруппу на одном конце (амино-, N-
конец) и карбоксильную группу на другом (карбоксильный-, С-конец). Полипептиды принято изображать в направлении от N- к С-концу.
В зависимости от длины полипептидной цепи пептидами условились называть полимеры, состоящие из не более 100 аминокислотных остатков. Более крупные полипептиды принято называть белками. Отметим, что это разграничение весьма условно, и некоторые авторы предлагают считать белками полипептиды, в состав которых входит более 50 аминокислот, по величине молекулы инсулина, признанной самым маленьким белком. Для коротких полимеров (не более 15 аминокислотных остатков)
принято название олигопептиды. Аминокислотный состав полипептида и порядок, в
котором следуют аминокислоты, определяют первичную структуру белка.
Пептидная связь – прочная, для ее гидролиза используют очень жесткие условия,
например, многочасовое инкубирование при 106°С в 6М растворе соляной кислоты. В
клетке этот гидролиз происходит гораздо легче при катализе соответствующими ферментами – различными протеазами. Некоторые из них обладают определенной избирательностью к полипептидной цепи, т.е. гидролизуют расщепление пептидной связи между определенными аминокислотными остатками. Такие протеазы используют при определении первичной структуры полипептида, как мы увидим далее.
1.2Пептидная связь, пространственная организация полипептидов
Рассмотрим подробнее строение пептидной связи. Как и у всякой амидной связи,
здесь имеет место сопряжение свободной пары электронов у атома азота и π-электронами
32

карбонильной группы C=O. В результате, как мы отмечали ранее, аминогруппа теряет свою электронно-донорную способность (как при присоединении протона в случае свободной аминокислоты), и связь C-N имеет частично двойной характер (иногда говорят
«полуторный» характер). На рисунке 1.13 показаны крайние состояния, когда неподеленная электронная пара находится целиком на атоме азота или когда она целиком локализована на атоме кислорода. На самом деле, очевидно, имеет место некое среднее состояние, и между О, С и N сосредоточено делокализованное электронное облако.
Рентгеноструктурным анализом показано, что длина связи С-N здесь равняется 0,132
нм, что короче, чем в алифатической аминогруппе (0,147 нм). Все атомы, принимающие участие в образовании пептидной связи, расположены в одной плоскости (говорят
«пептидная связь планарна»). Подобное распределение электронной плотности привело к
Рис. 1.13. Свойства пептидной связи.
тому, что вращение вокруг пептидной связи затруднено, как и вокруг двойной связи С=С
в олефинах. Как видно из рисунка 1.13, вращение возможно только вокруг связей N–Cα и Cα–C=O. Однако поскольку боковые радикалы R могут, как мы знаем, быть довольно
33

громоздкими, взаимное положение их в полипептидной цепи не может быть каким угодно
из-за возникновения стерических затруднений. Двугранные (торсионные) углы, под
которыми находятся эти фрагменты, называют φ и ψ, соответственно.
Все возможные значения углов были рассчитаны, и оказалось, что большинство из
них являются запрещенными, поскольку приводят к структурам, в которых атомы
находятся в положениях взаимного отталкивания. На рисунке 1.14 приведена диаграмма,
где представлены значения, которые могут принимать углы φ и ψ.
Такие диаграммы были предложены в 1963 г. группой индийских ученых во главе с
Г.Н. Рамачандраном (G.N Ramachanran) и носят его имя. Показано, что значения углов,
которые приводят к энергетически и стерически выгодным структурам, соответствуют
вполне определенному пространственному устройству полипептидной цепи. Выделяют
несколько основных структур, которые принимает полипептидная цепь – α-спираль (alpha
helix, англ.), β-листы или слои (beta sheets, англ.), а также повороты и неупорядоченные
петли. Особая пространственная организация небольшого участка полипептидной цепи
называется вторичной структурой белка.
Рис. 1.14. Карта (диаграмма) Рамачандрана. Углы φ и ψ могут принимать только определенные значения (зеленые зоны на диаграмме), что приводит к образованию локальных упорядоченных участков полипептидной цепи. Для α-спиралей характерные значения торсионных углов находятся в зеленых зонах 2 и 3 (концы спирали), для β- листов – в зеленой зоне 1. Серые кружки – атомы С (пронумерованы Сα), красные – атомы О, голубые – N, белые – H.
34

Существование участков полипептида в виде спирали было показано американским
химиком, дважды лауреатом Нобелевской премии (по химии в 1954 г. и мира в 1962 г.)
Лайнусом Полингом.Альфа-спираль представляет собой правозакрученный участок
полипептида, каждый ее шаг включает 3,6 аминокислотных остатка (Рис. 1.15). Спирали в
Рис. 1.15. Вторичные структуры полипептида стабилизируются сетью водородных связей, между NH и C=O основной цепи (показаны штрихом). Боковые радикалы (серые кружки, R) в организации вторичных структур не участвуют. На изображении складчатой структуры ß-листов видно, что все атомы пептидной связи располагаются в одной плоскости.
среднем включают около 12 аминокислотных остатков, однако встречаются и более длинные, включающие до 50 аминокислот. Спиральная структура поддерживается
35
благодаря образованию сети водородных связей вдоль ее оси: все карбонильные группы пептидных связей обращены к С-концу спирали, а NH-группы – к N-концу, навстречу карбонильным. Водородные связи, которые образуются между этими группами, «сшивают» спираль и не дают ей раскручиваться. При этом каждая С=О группа первой пептидной связи образует водородную связь с NH-группой каждой пятой (через 4
пептидных связи, правило n+4).
Боковые радикалы аминокислот никак не участвуют в образовании спирали и обращены наружу. Тем не менее, ряд аминокислотных остатков не способствует образованию структуры типа альфа-спиралей. Например, близкое расположение аминокислот с одинаково заряженными боковыми радикалами вызывает их отталкивание,
а остатки пролина исключают возможность какого-либо поворота вокруг N-Cα связей,
поскольку азот здесь входит в жесткую структуру кольца. К аминокислотам, часто дестабилизирующим альфа-спирали, относят S, I, T, Y, D, K, R и G, имеющим либо заряженный или поляризованный боковой радикал, либо громоздкий или, наоборот,
весьма подвижный (позволяющий почти свободное вращение вокруг N-Cα) остаток глицина.
Одновременно с альфа-спиральной структурой Полинг описал другой тип вторичной структуры, названной β-слой (или β-лист). Эти структуры образуются между двумя расположенными рядом полипептидными цепями и стабилизируются также сетью водородных связей между С=О и NН-группами соседних цепей (Рис. 1.15). Различают параллельные и антипараллельные β-слои. Более стабильными являются антипараллельные слои, поскольку в этом случае водородные связи располагаются почти перпендикулярно пептидным, и имеют меньшую длину. Боковые радикалы в β-листах, как и в случае α-спиралей, ориентированы вне плоскости листов. В образовании β-листов принимают участие все пептидные связи, т.е. создается довольно плотная сеть водородных связей, что придает структуре высокую стабильность. В пространстве эта структура представляет собой складчатые слои.
На рисунке 1.16 приведен еще один элемент вторичной организации полипептидной цепи – так называемый β-поворот. Такая структура получается на участках с участием пролина, боковой радикал которого – жесткий пятичленный цикл с зафиксированными углами между атомами углерода. Поворот дополнительно фиксируется водородной связью глицинового остатка, который благодаря своей подвижности легко
«подстраивается» к соседнему пролину. Нетрудно видеть, что в результате полипептидная
цепь повернулась на 180°.
36

Рис. 1.16. Часто встречающийся элемент вторичной структуры – β-поворот – образуется на участке, где соседствуют пролин и глицин. На месте этого элемента полипептидная цепь поворачивается почти на 180°.
Итак:
первичной структурой белка называют последовательность аминокислотных остатков полипептидной цепи;
пептидная связь имеет частично двойной характер и потому вращение вокруг нее затруднено;
вторичные структуры образуются на локальных участках полипептидной цепи и представляют собой упорядоченные фрагменты – α-спирали и β-листы со строго определенными пространственными углами φ и ψ;
стабильность вторичной структуры обусловлена сетью водородных связей,
образуемых атомами, участвующими в образовании пептидных связей;
боковые радикалы аминокислотных остатков в образовании вторичных структур участия не принимают.
Ряд элементов полипептидной цепи не носит столь упорядоченного характера, среди
них можно выделить разного рода петли, повороты основной цепи и линкеры (участки,
расположенные между упорядоченными элементами цепи), а также неупорядоченные
клубки.
Элементы вторичной структуры в определенных сочетаниях часто встречаются в
различных белках, никак не связанных друг с другом. Накопленный на сегодняшний день
массив данных о пространственной структуре белков позволяет выделить несколько таких
супервторичных структур (мотивов) (см. примеры на Рис. 1.17). Повторяющиеся
37

антипараллельные бета-слои получили название меандры (в простейшем случае – шпилька), повторяющиеся бета- и альфа-элементы называют βαβ-мотивом, сложную, но красивую укладку четырех β-слоев называют «греческий ключ».
Рис. 1.17. А. Вторичные структуры пептидной цепи часто изображают в виде лент: α-спираль показана голубым цветом, β-лист – в виде зеленой стрелки. В. Примеры мотивов.
Следующий уровень организации белковой молекулы называется третичной структурой (пространственной, 3D) и под ней понимают пространственное расположение элементов вторичной структуры относительно друг друга. Белковая молекула в растворе испытывает на себе ряд воздействий среды (электростатические взаимодействия с заряженными или поляризованными частицами, броуновское движение,
архимедова сила и сила тяжести, трение), и ее организация направлена на то, чтобы в результате энергия молекулы была минимальной. Пространственная структура стабилизируется ковалентными, ионными и водородными связями, а также гидрофобными, дипольными и Ван-дер Ваальсовыми взаимодействиями (Рис. 1.18),
которые образуются при взаимодействии атомов боковых радикалов. Самыми прочными связями, стабилизирующими молекулу белка, являются ковалентные,
например, связи S-S (Е= 210 кДж/мол), возникающие при окислении тиогрупп боковых радикалов цистеиновых остатков. Между разнозаряженными боковыми радикалами – положительными у лизина и аргинина и отрицательными у аспарагиновой и глутаминовой кислот, возникают ионные (электростатические) связи с энергией около 45 кДж/мол.
38

Рис. 1.18. Формирование пространственной (третичной, 3D) структуры молекулы белка. Найдите на рисунке внизу слева образующиеся связи типа 1-4, перечисленные справа.
Следующими по величине энергии (8-12 кДж/мол) являются водородные связи,
возникающие при взаимодействии поляризованных боковых радикалов аминокислот,
имеющих гидроксильные, амидные и тиогруппы (S, T, Y, C, N и Q).
Особое место занимают гидрофобные взаимодействия (4-8,5 кДж/мол). В водных растворах боковые радикалы с неполярным строением обращены, как правило, внутрь белковой молекулы и формируют так называемое гидрофобное ядро (какие это аминокислоты?). На поверхности белка находятся гидрофильные функциональные группы, которые образуют водородные и ионные связи с водой и растворенными в ней соединениями.
39
Ван-дер Ваальсовы взаимодействия – самые низкоэнергетические (ок. 0,5 кДж/мол),
однако в них принимают участие все атомы без исключения и потому суммарный вклад этих взаимодействий значителен, и пренебрегать им нельзя. Они возникают между молекулами или атомами, являющимися постоянными диполями. Величина этого взаимодействия невелика и сильно зависит от расстояния между взаимодействующими частицами.
Итак, в образовании третичной структуры белка, ключевую роль играют разнообразные взаимодействия функциональных групп боковых радикалов аминокислот,
которые возникают в результате соответствующей укладки основной цепи и стабилизируются водородными связями атомов пептидной связи. Формирование правильной пространственной структуры белка определяет его биологическую активность.
Процесс образования пространственной структуры белка называется фолдингом. В
клетке он может происходить как самопроизвольно, так и при катализе различными ферментами. Оптимальные условия жизни клетки находятся в довольно узком диапазоне и для большинства земных организмов под такими условиями обычно подразумевают температурный интервал 20-40°С, атмосферное давление в одну атмосферу, pH 6,5-8,
атмосферную концентрацию кислорода и углекислого газа и т.д. Изменение факторов окружающей среды может привести к нарушениям или потере пространственной структуры белка, т.е. к его денатурации и, как следствие, способности выполнять биологическую функцию. Денатурация белка происходит в результате разрушения связей,
стабилизирующих пространственную структуру белка. Если изменение параметров (к
примеру, повышение температуры) проводить достаточно медленно, то можно наблюдать скачкообразный ход денатурации, что говорит о кооперативном эффекте явления – т.е.
нарушение небольшого количества связей влечет за собой быстрое (почти одновременное)
разрушение всей системы связей в молекуле (см. Рис. 1.19).
Вопрос: При варке яйца часто говорят, что белок свернулся – так ли это?
Денатурация может быть обратимой (т.е. после восстановления физиологических параметров среды белок возвращается в исходную конформацию без потерь активности) и
необратимой. Процессы фолдинга-денатурации-ренатурации представляют особый как фундаментальный, так и прикладной интерес, особенно в случае получения целевых белков эукариот с помощью бактериальной экспрессии. Дело в том, что в клетках прокариот отсутствуют многие механизмы фолдинга, характерные для эукариотической
40
