
УП- Биоорганическая химия
.pdf
последующей идентификации, а укороченный пептид остается иммобилизованным. Это позволяет существенным образом уменьшить количество пептида, необходимого для секвенирования, а также автоматизировать процесс.
Этап 7. Для установления полной последовательности исходного белка, проводят, сборку полученных фрагментов, учитывая условия их получения при гидролизе. Как правило,
сборку начинают с фрагмента с установленной С-концевой аминокислотой. Молекулу последовательно достраивают в направлении к N-концу, складывая полученные фрагменты с перекрывающимися участками.
Рассмотрим этапы секвенирования на примере короткого 17-членного пептида (Рис.
1.30). C помощью реакции с дансилхлоридом устанавливаем, что С-концевой аминокислотой является валин. Далее исходный пептид гидролизуем с помощью реагента бромциана (BrCN). Известно, что это соединение расщепляет пептидные связи по метионину. В результате этой реакции получаем 3 фрагмента.
Рис. 1.30. Последовательность операций секвенирования на примере короткого пептида.
61
В другой пробирке этот же исходный пептид подвергаем гидролизу действием специфической протеазы, которая называется трипсин. Этот фермент катализирует гидролиз пептидных связей, которые образуют аминокислоты с длинными положительно заряженными боковыми радикалами – лизин и аргинин. В результате обработки трипсином получим 3 других фрагмента. Каждый из этих фрагментов выделяем в индивидуальном виде с помощью хроматографии.
Далее устанавливаем последовательность каждого из фрагментов с помощью реакций с фенилизотиоцианатом. На следующем этапе проводим сборку полипептида,
начиная с максимального фрагмента, имеющего валин на конце. В нашем случае это фрагмент (2) – AFRSEV, полученный при гидролизе BrCN. Среди фрагментов после трипсиновой обработки имеется кусок (6), оканчивающийся на AFR. При подстановке этого фрагмента восстанавливаемая последовательность увеличивается еще на 5 остатков и получается 11-членный фрагмент VIGSMAFRSEV. Среди фрагментов после бромциановой обработки имеется фрагмент (3), оканчивающийся на N-конце на VIGSMA.
После его подстановки восстанавливаемая последовательность увеличивается еще на 3
остатка – TNK и получается 14-членный фрагмент, имеющий на N-конце TNK. Среди фрагментов трипсинового лизата имеется 6-членный пептид (5) AVMTNK. Его подстановка дает нам последовательность исходного 17-членного пептида.
В настоящее время определение аминокислотной последовательности больших белков проводят достаточно редко, ограничиваясь секвенированием небольших концевых фрагментов. Сборку отсеквенированных коротких фрагментов проводят на компьютерах с помощью соответствующего программного обеспечения. Более простым подходом оказалось установление последовательности белка по последовательности гена, который его кодирует. Этот вопрос мы затронем в следующей главе.
1.5.Химический синтез пептидов
Химически синтезированные полипептиды широко используются как модельные соединения для изучения белок-белковых и белково-нуклеиновых взаимодействий.
Большая группа коротких пептидов являющиеся гормонами, пептидами мозга и т.п.,
представляют важный медицинский интерес. При проведении химического синтеза пептидов необходимо решать несколько задач.
Как мы уже обсуждали, формально образование пептидной связи можно представить как реакцию конденсации с участием карбоксильной группы одной аминокислоты и
62

аминогруппы другой. Эта реакция термодинамически не выгодна и потому для синтеза
необходимо превратить аминокислоты в их активные производные по концевым
карбоксильной или аминогруппам. Рассмотрим случай, когда синтез проводят с
активированной карбоксильной группой (Рис. 1.31). Очевидно, что вводимые
активационные группы должны иметь электронно-акцепторную природу, с тем чтобы
увеличить дробный положительный заряд на углероде карбоксила. В этом случае
электронно-донорная атака пары электронов аминогруппы на обедненный электронной
плотностью карбоксильный углерод будет более эффективной. На рисунке 1.31
приведены структуры некоторых из них.
Рис. 1.31. Последовательность операций при синтезе пептида. Красными буквами X,Y обозначены защитные группировки по амино- и карбоксильной группам, соответственно. Синим кружком с буквой А обозначена активационная группа при карбоксиле.
63
Наличие в каждой из аминокислот как минимум по одной амино- и
карбоксильной группе в альфа-положении приводит к получению набора пептидов,
различных как по составу, так и по длине, даже если активирована только одна аминокислота. Чтобы обеспечить синтез пептида в нужном направлении, необходимо заблокировать «ненужные» на данном этапе функциональные группы (Рис. 1.31). Причем,
если требуется синтезировать длинный пептид, необходимо, чтобы эти защитные группы удалялись в мягких условиях, не разрушающих пептидную связь. Очевидно, что удаление защиты при аминоили карбоксильной группах должно проходить в разных условиях.
Необходимо учитывать, что боковые радикалы ряда аминокислот содержат те же функциональные группы – карбоксильную, амино-, а кроме того, тио- и гидроксильную,
которые тоже могут подвергаться нуклеофильной атаке с образованием пептидной связи и как результат к накоплению побочных продуктов в виде разветвленных пептидов.
Поэтому эти группы также блокируют специально подобранными защитами. Очевидно,
что условия удаления этих блоков должны отличаться от таковых для защитных групп в альфа-положении.
Благодаря стратегии защитных групп и активации карбоксильной группы первой аминокислоты синтез пептидной связи идет в определенном направлении (Рис. 1.31).
После окончания синтеза все защитные группы удаляют и полученный полипептид очищают хроматографически.
В настоящее время защищенные производные аминокислот являются коммерческими продуктами, и их выбор исследователь производит в соответствии с той стратегией синтеза, которая может обеспечить максимальный выход целевого продукта.
Нетрудно заметить, что вся процедура синтеза пептида представляет собой повторяющиеся этапы: синтез пептидной связи, удаление защитной группы, добавление следующего звена, синтез пептидной связи, удаление защитной группы и т.д. Это создает предпосылки для организации работы в автоматическом режиме (Рис. 1.32). Первое звено иммобилизуют на поверхности нерастворимых частиц (как правило, шариков из нерастворимого полимерного материала). Эти частицы помещают в колонку и все реагенты, необходимые для синтеза, пропускают через нее в нужном порядке. В
отдельных резервуарах находятся активированные и защищенные производные аминокислот, а также растворы с активирующими реагентами и реагентами для удаления временных защитных групп. В соответствии с протоколом эти реагенты прокачивают
64
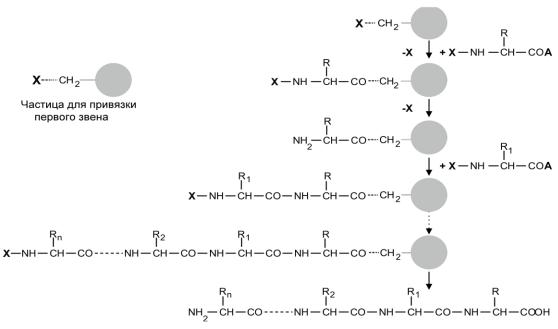
Рис. 1.32. Схема синтеза пептида на полимере (твердофазный синтез). Растущая полипептидная цепь иммобилизована на нерастворимой полимерной частице (серые кружки).
через колонку, и с каждым повторяющимся циклом на поверхности частиц происходит удлинение пептидной цепи на одно звено. По окончании синтеза прокачивают реагенты для удаления всех блоков и снятия пептида с поверхности шариков. Полученный пептид также очищают хроматографией.
Важным обстоятельством, существенно усложняющим пептидный синтез, является необходимость соблюдения оптической чистоты получаемого продукта. Как правило,
химические реакции происходят с частичной рацемизацией пептидной связи. Особенно большое накопление побочного рацемизированного (причем в разной степени и на разных участках цепи) наблюдается именно при синтезе на полимере, поскольку очистку продукта здесь проводят лишь на последнем этапе.
Вопрос: С какими аминокислотами рацемизации при синтезе пептидной связи не происходит? Есть ли таковые?
Весьма продуктивным способом синтеза пептидов является химико-
ферментативный, когда часть реакций при синтезе катализируется с помощью соответствующих ферментов. Ферментативные реакции обладают специфичностью как по своей направленности (вспомните действие протеазы трипсина при гидролизе
определенной пептидной связи), так и оптической чистоте получаемых продуктов.
65

Рассмотрим такой синтез на примере получения инсулина – важнейшего полипептида,
состоящего из 51 аминокислотного остатка (Рис. 1.33). Инсулин – это гормон поджелудочной железы, отвечающий за углеводный обмен.
Рис. 1.33. Схема химико-ферментативного синтеза инсулина человека из инсулина свиньи.
66
За его открытие в 1923 г. канадские исследователи Ф. Бантинг и Д Маклеод были удостоены Нобелевской премии по физиологии и медицине. Первичную последовательность этого белка установил уже известный нам британский молекулярный биолог Фредерик Сенгер, получивший за это исследование Нобелевскую премию 1958 г.
Пространственную структуру этого белка установила через 40 лет Дороти Кроуфут-
Ходжкин, лауреат Нобелевской премии 1964 г.
Несмотря на малый размер, молекула инсулина имеет довольно сложное строение:
она состоит из 2-х цепей А (21 аминокислотных остатков) и В (30 аминокислотных остатков), соединенных двумя S-S мостами. Еще одна S-S связь находится на А цепи (Рис. 1.33). Поскольку методы синтеза пептидов были разработаны слабо, а потребность в инсулине для лечения больных диабетом чрезвычайно велика (до его открытия диабет считался смертельным заболеванием), большие усилия были приложены к поиску инсулина, максимально схожему с человеческим, в организмах других млекопитающих.
Вот когда пригодились известные и получили развитие новые методы получения чистых белков и их секвенирования! Было обнаружено, что самым близким по структуре является инсулин свиньи: различие состоит только в одной С-концевой аминокислоте А цепи – у
человека здесь треонин, а у свиньи аланин. Для того чтобы получить человеческий инсулин, в 1972 году был разработан способ превращения, схематически приведенный на рисунке 1.32. В высокоочищенном инсулине свиньи вначале блокируют все карбоксильные группы обработкой диазометаном. Далее обработкой трипсином укорачивают В-цепь до аргинина-22. В полученном укороченном белке производят блокирование аминогрупп. Параллельно синтезируют химически удаленный концевой фрагмент В-цепи, но уже с треонином на С-конце. Полностью блокированный по
«ненужным» функциональным группам укороченный инсулин свиньи соединяют с синтетическим фрагментом. Далее проводят деблокирование всех функциональных групп и очищают полученный человеческий инсулин. Выход белка составляет 10% от взятого в синтез свиного инсулина. Этот способ получения фармакологического препарата инсулина используют до сих пор.
Для чего еще нужны синтетические пептиды, имеет ли смысл развивать методы синтеза, которые сопровождается такими трудностями? На этот вопрос отвечает следующий раздел.
Антимикробные пептиды – новая эра борьбы с инфекциями
В настоящее время активно изучаются пептиды, для которых характерна антимикробная активность. Они представляют собой короткие аминокислотные
67

последовательности (20-40 остатков), которые синтезируются широким кругом живых организмов – от бактерий, грибов и растений до млекопитающих. Некоторые антимикробные пептиды синтезируются постоянно, синтез других индуцируется в ответ на инфекцию или воспаление. Известно, что синтез таких пептидов протекает в несколько стадий, с последовательным протеолизом молекулы-предшественника до образования активного пептида с дополнительными модификациями в виде гликозилирования или галогенирования.
Для большинства антимикробных пептидов характерны следующие особенности: высокий положительный заряд, наличие большого количества гидрофобных аминокислотных остатков, пространственное разделение гидрофобных и гидрофильных участков молекулы. Структурно антимикробные пептиды могут быть представлены линейными молекулами, последовательностями в виде α-спиралей и β-складчатых структур, а также организованными в виде петель. При этом последние стабилизируются за счет присутствия одной или нескольких дисульфидных связей.
Антимикробные пептиды способны действовать на широкий круг патогенов – грамотрицательные и грамположительные бактерии, грибы и простейшие. Механизм воздействия биоактивных пептидов на бактериальные клетки может протекать двумя возможными способами: за счет ингибирования метаболических процессов или путем нарушения целостности клеточной мембраны. Проявляя активность в отношении бактерий, пептиды действуют на отрицательно заряженную внешнюю мембрану. Биоактивные пептиды, прочно связываясь с отрицательно заряженными липополисахаридами или нейтрализуя отрицательный заряд на поверхности мембраны, нарушают ее структуру и проникают внутрь периплазматического пространства. Пептиды могут встраиваться в мембрану и менять свою конформацию, образуя каналы, нарушающие целостность клетки. Проникнув в цитоплазму бактерий, пептиды способны связываться с клеточными полианионами (ДНК или РНК), ингибируя процессы трансляции и транскрипции, что приводит к гибели бактериальной клетки.
Информация о специфической активности известных антимикробных пептидов, их первичной и пространственной структуре и организмах, из которых были получены пептиды, содержится в специальных базах данных: CAMP (http://www.camp3.bicnirrh.res.in/), APD (http://aps.unmc.edu/AP/main.php), BioPD (http://biopd.bjmu.edu.cn ) и др. В настоящее время охарактеризованы более 8000 антимикробных пептидов, которые обнаружены в эпителиальных тканях, фагоцитирующих клетках и биологических жидкостях многих многоклеточных животных. Известно, что антимикробные пептиды дефензины обнаружены в нейтрофилах млекопитающих (от англ. defence – защита), в результате инфекционного или воспалительного процесса они высвобождаются из клеток и вносят вклад в иммунную защиту организма. Большое количество биоактивных пептидов, обладающих высоким терапевтическим потенциалом, найдено в слизистых выделениях на коже амфибий (магаинины, бревинины).
Очевидно, благодаря этому в древности лягушек использовали для сохранения свежести молока. Известно, что антимикробные пептиды
68
могут синтезироваться также и самими бактериями – Lactococcus casea способны продуцировать биоактивный пептид низин, который в настоящее время используется как консервант в производстве молочной продукции.
Серьезным ограничением для массового применения антимикробных пептидов как терапевтических агентов является их низкая устойчивость к протеолитическим ферментам, а также высокая стоимость производства. В настоящее время антимикробные пептиды, обладающие высоким потенциалом, являются объектом значительного числа научных исследований. В рамках таких проектов изучаются механизмы и специфика воздействия биоактивных пептидов на клеточные структуры, синтезируются искусственные пептиды, а также разрабатываются способы их доставки в организм. Сегодня многие пептиды и их синтетические модификации уже применяются как эффективные средства для борьбы с инфекциями кожных покровов, легочными инфекциями, как консерванты для продуктов питания и агенты для защиты растений.
Поскольку применение антимикробных пептидов может стать перспективной альтернативой традиционным антибиотикам, к которым бактерии довольно быстро приобретают резистентность, можно сказать о наступлении новой вехи в борьбе с бактериальными инфекциями.
Материал подготовлен М.Д. Ларионовой (ИБФ СО РАН, Красноярск) по [2,3].
Задачи и упражнения к Части 1
1.Каждому студенту выдается навсегда таблица со структурными формулами аминокислот. Задание: выучить наизусть эти структуры, а также их обозначения трехбуквенным и однобуквенным кодами.
2.Определите аминокислоты, отличающиеся друг от друга одной метильной или метиленовой группой.
3.20 стандартных аминокислот называются α-аминокислотами, однако определенные аминокислоты в природе существуют в β-форме. Нарисуйте структуру β-аланина (3-амино-пропионата).
4.Изобразите дипептид Asp-His при pH 7.0.
5.Нарисуйте кривые титрования аспарагиновой к-ты и лизина.
Определите общий заряд этих аминокислот при а) pH 1.0, b) pH 3.0, c) pH 6.0, d) pH11.0.
6.Аминокислота тирозин была растворена в воде в виде полипептида, содержащего множество остатков тирозина (polyTyr) и в форме единичных молекул. Как форма повлияет на растворимость при условии, что общее количество молекул тирозина останется постоянным?
7.Какой из этих пептидов имеет большее поглощение при 280 нм:
69
A.Gln-Leu-Glu-Phe-Thr-Leu-Asp-Gly-Tyr
B.Ser-Val-Trp-Asp-Phe-Gly-Tyr-Trp-Ala?
8.a) В какой последовательности следующие аминокислоты будут элюировать с карбоксиметиленовой колонки при pH = 6: Arg, His и Leu?
б) В какой последовательности Glu, Lys и Val будут элюировать с диэтиламиноэтил колонки при pH = 8?
9 Аминный азот по Ван-Слайку определяют реакцией с азотистой кислотой:
R-NH2 + HNO2 → N2↑
Какой объем азота выделится (при нормальных условиях) при обработке азотистой кислотой 0,001 моля лейцина, лизина, пролина?
10 Сальмин – полипептид, выделенный из спермы лосося, обладает уникальным аминокислотным составом, состоящим из семи аминокислотных остатков. Было показано, что в 100 г этого белка содержится: изолейцина – 1.28 г, аланина – 0.89 г, валина – 3.68 г, глицина – 3.01 г, серина – 7.29 г, пролина – 6.9 г, аргинина – 86.4 г. Определите аминокислотный состав этого белка. Напишите его брутто-формулу в трехбуквенном и однобуквенном виде.
11Белок содержит 0.29% триптофана. Какова его минимальная молекулярная масса?
12Изобразите пространственную структуру трипептида Gly-Pro-Arg – одного из повторяющихся фрагментов в составе коллагена.
13Фермент с молекулярной массой 300 000 диссоциирует в кислой среде на 2 компонента с молекулярной массой 100000 и 50000. Более крупные частицы составляют 2/3 всего белка и обладают каталитической активностью; частицы меньшего размера – не активны. Обработка больших частиц меркаптоэтанолом приводит к потере каталитической активности и уменьшению молекулярной массы н по данным гель-фильтрации. Полученный при этом продукт выходит одним пиком. Какие выводы можно сделать о структуре фермента?
14Дана последовательность (фрагмент гемоглобина)
VLSPAKTNVKAAWGKVGAHAGEYGAEATE.
Как обработать этот фрагмент, чтобы установить его последовательность? Опишите последовательность операций и результаты, к которым приводит каждая из них.
15Сэнгер секвенировал А-цепь бычьего сывороточного инсулина. При его полном гидролизе получаются G,A,V2,L2,I,C4,D2,E4,S2,Y2.
При обработке динитрофторбензолом получил ДНФ-глицин, С-концевой остаток – аспарагиновая кислота.
При частичном кислотном гидролизе среди прочих фрагментов обнаруживаются фрагменты:CCA, EDY, EEC, ELE, CD, YC, SVC, ECC, SLY, LYE, GIVEE.
После расщепления пепсином получается пептид, который при гидролизе дает SVC и SL. Укажите полную последовательность цепи А бычьего сывороточного инсулина.
70
