
УП- Биоорганическая химия
.pdf
Помимо водородных связей двойная спираль ДНК стабилизируется так называемыми стэкинг взаимодействиями между гетероциклическими основаниями,
которые расположены друг над другом «стопками» высотой 3,4 Å. Природа этого взаимодействия до конца не выяснена, но можно утверждать, что эти взаимодействия носят гидрофобный характер, а между облаками π-электронов, образующих ароматические кольца оснований, имеется частичное перекрывание. Энергия этого взаимодействия значительна – 12-60 кДж/моль и в несколько раз превосходит энергию водородных связей (8-12 кДж/моль). Возможно, благодаря именно этому взаимодействию наблюдается так называемый гиперхромный эффект: поглощение УФ-света отдельными нуклеотидами существенно выше, чем теми же нуклеотидами, соединенными в полинуклеотид, а поглощение одиночных цепей выше такового сдвоенных комплементарных участков.
Рис. 2.8. Двойная спираль ДНК стабилизируется: 1) водородными связями между гетероциклическими основаниями, 2) стэкинг взаимодействиями между основаниями собственной (а) и соседней цепями (б).
Сахарофосфатный каркас молекулы ДНК находится на ее внешней части и обращен к растворителю. Неэтерифицированные остатки фосфорной кислоты имеют заряд -1 и для компенсирования электростатического отталкивания стабилизированы противоионами металлов – Na+, K+ или Mg2+.
81

Молекулы ДНК, особенно в области сахарофосфатного участка, в высокой степени гидратированы, т.е. насыщены водой, и сеть водородных связей, которая образуется при этом, также играет важную роль в стабилизации молекулы ДНК.
В целом двойная спираль ДНК представляет собой длинную молекулу, во внутренней области которой находятся гидрофобные остатки гетероциклических оснований, образующие вдоль спирали малый желобок, а на поверхности – гидрофильный и заряженный сахарофосфатный остов – большой желобок спирали.
Молекулы ДНК крупные и их размер часто указывают, как и для белков, в килодальтонах
(кДа), либо в количестве пар оснований (п.о. или п.н.) – размер молекулы в 1000 п.о.
называется «килобаза».
2.3Третичная структура ДНК
Вклеточном ядре эукариот молекулы ДНК упакованы в специальные нитевидные структуры, которые называются хромосомами. Часто эту упаковку рассматривают как третий уровень пространственной организации молекулы ДНК. Известно, что общая длина ДНК существенно больше, чем размеры клетки и ядра. У E.coli она составляет 1,5
мм, у дрозофилы — 61 мм, у человека — около 2 м. Поэтому упаковка молекулы ДНК должна быть сверхкомпактной. Это достигается с помощью специальных белков –
гистонов, выполняющих функцию своеобразной «катушки», на которую наматываются нити ДНК (Рис. 2.9).
Рис. 2.9. Гистоны – белки, играющие важную роль при упаковке молекул ДНК в хромосомах
82
Гистоны – это семейство ядерных белков, массой 11-12 кДа, богатых остатками лизина и аргинина. Благодаря такому составу гистоны обладают положительным зарядом и образуют ионные связи с отрицательно заряженными молекулами ДНК. Каждая единица такой катушки включает 8 гистоновых белков (две пары из 4-х гистонов под названием Н2А, Н2В, НЗ и Н4), вокруг которых ДНК совершает 1,75 оборота (146 пар нуклеотидов).
Этот белково-нуклеиновый комплекс называется нуклеосома. Участок ДНК между нуклеосомами называется линкерным, он связан с еще одним гистоном Н1, и его длина в среднем составляет 60 пар н.о. В ядре общая масса гистонов примерно равна массе ДНК, в
упаковке которой они участвуют. Нуклеосомы, в свою очередь, плотно упакованы с помощью других негистонных белков, образуя хроматин. Хроматин – форма существования генетического материала в интерфазных клетках. Аминогруппы боковых радикалов лизина, аргинина и концевая аминогруппа гистонов могут модифицироваться с помощью специфических ферментов и образовывать ацетилированные, метилированные и другие производные, что приводит к потере заряда аминогрупп и изменению конформации гистонов. В этом состоянии гистоны взаимодействуют с ДНК по-иному:
ионные силы, например, могут быть сильно ослаблены или отсутствовать, и ДНК «слетает с катушки». Появляющиеся одноцепочечные участки могут служить матрицами для транскрипции и последующего синтеза белка, который они кодируют. Хроматин не только выполняет пассивную роль «упаковщика» ДНК, но и является весьма динамичной структурой, позволяющей как быстро реагировать на внутри-и внеклеточные сигналы, так и поддерживать состояние активности или неактивности генов. Сложные и многосторонние процессы, проходящие в нем, представляют значительный интерес для исследователей, поскольку они связаны с механизмами регуляции экспрессии различных белков, а также со стадиями клеточного цикла. Нуклеосома представляет собой пример взаимодействия нуклеиновой кислоты и белка в составе специфического нековалентного стабильного комплекса, который называется нуклеопротеид.
В прокариотах геномная ДНК представлена в виде большой кольцевой двухцепочечной молекулы, концы которой ковалентно связаны. В клетке ДНК упакована в сверхспиральные или сверхскученные структуры. Характерной особенностью является наличие множества петель, закрепленных специфическими белками. В ДНК E. coli таких петель насчитывается около сотни, каждая в среднем состоит из 40 тысяч пар нуклеотидов. Образование петель и сверхспиральность обеспечивают прокариотам упаковку очень больших кольцевых молекул ДНК в малых объемах, не ограниченных
83

мембранами. Как правило, ДНК бактериальной клетки прикреплена в одной или нескольких точках к внутренней поверхности клеточной мембраны.
Вопрос: Можно ли назвать гистоны структурными белками? Чем они отличаются от известных вам белков, выполняющих структурную функцию?
2.4. Денатурация ДНК
Повышение температуры или изменение рН раствора ДНК вызывает разрушение водородных и других связей между двумя цепями ДНК – ее плавление. Этот процесс можно наблюдать по изменению оптической плотности раствора ДНК (Рис. 2.10). Как было отмечено выше, неспаренные участки ДНК поглощают свет сильнее, чем спаренные,
т.е. при плавлении двойной спирали наблюдается увеличение оптической плотности ее раствора. Кривая плавления – графическое изображение этого процесса, похожа на кривые плавления, наблюдаемые при денатурации белковых молекул. Вид этой кривой непосредственно связан с первичной структурой ДНК – т.е. какие нуклеотиды и сколько входят в ее состав. Очевидно, что для разрыва пары G-C, которая образована тремя водородными связями, понадобится больше энергии, чем для разрыва связи А-Т. И,
соответственно, молекулы ДНК, богатые этими парами, будут плавиться при более высокой температуре. Точка перегиба на кривой плавления ДНК, соответствующая температуре, при которой количества расплавленной и нерасплавленной ДНК равны,
Рис. 2.10. Плавление (температурная денатурация) двухцепочечной молекулы ДНК.
84
называется температурой плавления и является важной физической характеристикой ДНК, отражающей ее структуру.При охлаждении раствора наблюдается обратный процесс реассоциации одиночных цепей в двойную спираль и в соответствии с принципом комплементарности его называют отжигом.
Температура плавления, отражая нуклеотидный состав ДНК, может использоваться как важный таксономический признак. Эту характеристику используют при изучении физико-химических свойств ДНК, а также при генно-инженерных работах с ДНК.
Например, при проведении полимеразной цепной реакции (ПЦР) выбор температуры отжига (плавления) дуплекса праймер-матрица рассчитывают теоретически,
используя соответствующее программное обеспечение. Эффективность ПЦР напрямую зависит от правильно подобранной температуры отжига: слишком высокая температура,
например, не обеспечит создание дуплекса и, как следствие, приведет к остановке реакции.
2.5. Рибонуклеиновые кислоты
Рибонуклеиновые кислоты представляют собой полимерные молекулы, в состав которых входят рибонуклеозиды уридин, аденозин, гуанозин и цитидин, соединенные 3'- 5'-фосфодиэфирными связями. В отличие от ДНК, эти молекулы находятся не только в клеточном ядре эукариот, но и в других компартментах клетки – цитозоле, рибосомах, и
пр. Молекулярная масса РНК существенно меньше, чем ДНК. Это одноцепочечные молекулы, но в их структуре часто имеются двухцепочечные участки (дуплексы),
образующие «шпильки» благодаря водородным связям между комплементарными основаниями. Фрагменты РНК в этих «шпильках» всегда антипараллельны.
Молекулы РНК чрезвычайно разнообразны как по структуре, так и по функциям,
выполняемым в клетке. Их можно разделить на 2 класса – кодирующая белки матричная
(мРНК) и разнообразные не кодирующие белки РНК, среди которых РНК транспортная
(тРНК) и рибосомальная (рРНК) так или иначе «обслуживают» процесс синтеза белка, а
также митохондриальная РНК (эта органелла имеет собственный генетический и белково-
синтетический аппарат) и различные малые РНК.
Матричная РНК синтезируется в ядре клетки, и ее уникальная первичная последовательность является шаблоном (матрицей) для синтеза белка, закодированного в гене (соответствующем фрагменте ДНК). Первичная структура всех мРНК имеет схожее строение З'- и 5'-концов. На 3'-конце большинства мРНК присутствует последовательность нуклеотидов из 100-200 аденозинфосфатных остатков – поли(А)-
85
фрагмент. Эту последовательность используют при выделении мРНК с помощью аффинной хроматографии на колонке, заполненной сорбентом с политимидиновыми
(поли-Т) олигонуклеотидами, иммобилизованными на поверхности. На 5'-конце всех мРНК присутствует модифицированный нуклеотид 7-метилгуанозин-5'-трифосфат (кэп).
Через несколько десятков нуклеотидов от кэпа находится инициирующий кодон – триплет
AUG, кодирующий аминокислоту метионин. За кодирующим («смысловым») участком обязательно следует один из терминирующих (стоп) кодонов UGA, UUA или UAG.
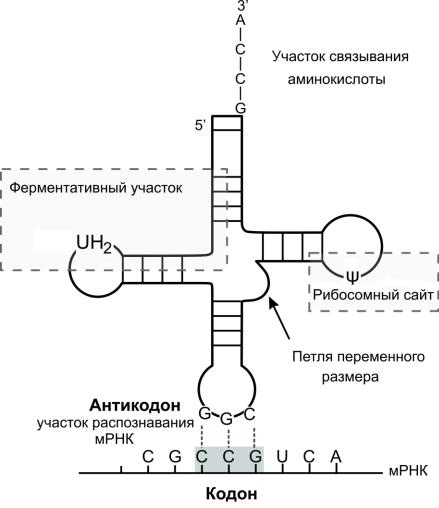
Транспортные РНК выполняют функцию доставки аминокислоты к рибосоме при синтезе белка. Структура тРНК, независимо от различий в последовательности нуклеотидов, описывается универсальной моделью "клеверного листа" (Рис. 2.11). На 3’-
конце молекулы находится участок с последовательностью С-С-А связывания аминокислоты, а на противоположном конце – участок, называемый антикодон – триплет
Рис. 2.11. Модель молекулы тРНК. Показаны некоторые минорные основания UH2 – дигидроурацил и ψ- псевдоурацил.
86

нуклеотидов, комплементарный кодону матричной РНК. Каждой аминокислоте для переноса соответствует определенная одна или несколько тРНК с соответствующим триплетом – антикодоном. Поэтому при синтезе белка информация, хранящаяся в гене
(кодирующий участок ДНК) и «переписанная» при транскрипции на мРНК, однозначно реализуется в последовательность аминокислот в синтезируемом на рибосоме белке.
В состав нуклеотидов тРНК входят так называемые минорные основания (в среднем
10-12 на молекулу). Они представлены метилированными основаниями, изомерами и аналогами пиримидинов (см. примеры на Рис. 2.12). Эти основания делают молекулу устойчивой к расщеплению нуклеазами, а также обеспечивают определенную пространственную структуру молекулы, т.к. не образуют комплементарных пар,
препятствуя спирализации молекулы в определенных участках.
Рис. 2.12. Структура некоторых минорных оснований РНК.
Рибосомальные РНК находятся в рибосомах и составляют от их массы до 60%,
остальную массу составляют рибосомальные белки. Рибосомы – это внутриклеточные органеллы, которые обеспечивают синтез полипептидной цепи в соответствии с
«текстом», заданным нуклеотидной последовательностью матричной РНК – процесс,
называемый трансляцией. Из-за большого количества РНК, входящих в состав рибосом,
их иногда называют «царством РНК». Рибосомальные РНК обладают разной
молекулярной массой и имеют многочисленные сдвоенные спирализованные участки. В
87

составе рРНК встречаются как минорные основания, так и производные рибозы
(например, 2'-метилрибоза). Фактически рибосомы представляют собой еще один пример
белково-нуклеинового комплекса.
Особое место занимают так называемые малые интерференционные РНК (миРНК, siRNA) и другие виды короткоцепочечных РНК, циркулирующих в крови. Исследования последних десяти лет указывают на их ключевую роль как регуляторов процессов репликации ДНК, а также транскрипции и трансляции.
2.6. Особые нуклеотиды
Кроме рассмотренных нами нуклеозидфосфатов с одним остатком фосфорной кислоты (они часто так и называются — нуклеозидмонофосфаты) в клетках содержатся нуклеозидди- и нуклеозидтрифосфаты. На рисунке 2.13 слева показана структура молекулы аденозин 5'-трифосфорной кислоты – АТФ (ATP). Три остатка фосфорной кислоты присоединены с помощью высокоэнергетических пирофосфатных связей. При гидролизе этой связи освобождается от 30 до 50 кДж/моль энергии, в то время как при гидролизе обычной сложноэфирной фосфатной связи освобождается энергия, равная 8-12
кДж/моль. Таким образом, молекулы АТP, а также гуанозинтрифосфата (GTP) играют важную роль «поставщиков энергии» для обеспечения множества биохимических процессов, протекающих в клетке. Из четырех рибонуклеозидтрифосфатов (NTP, где N = A, G, U или C) синтезируются все виды РНК. Дезоксирибонуклеозидтрифосфаты (dNTP,
где N = A, G, T или C) являются «строительными кирпичиками», из которых ферментативно синтезируются полимерные молекулы ДНК в процессе ее репликации.
Рис. 2.13. Структуры молекулы 5'АТP (слева) и 5'3'-сAMP (справа).
Особую роль в клетке играют нуклеозидциклофосфаты – нуклеотиды, в которых остаток фосфорной кислоты образует внутримолекулярный диэфир одновременно с 3'- и 5'-
88
гидроксильными группами (Рис. 2.13, справа). Как правило, в виде таких циклофосфатов существуют цикло-АМФ (cAMP) и цикло-ГМФ (cGMP). Эти нуклеотиды образуются из соответствующих нуклеозидтрифосфатов под действием ферментов аденилатциклазы и гуанилатциклазы. В биологических процессах они выступают в качестве промежуточного посредника регуляторного действия гормонов.
2.7. Определение первичной структуры ДНК
Первичная структура ДНК, т.е. состав и порядок следования нуклеотидов в этой полимерной молекуле определяет состав и последовательность аминокислот в белке,
которые она кодирует. Поэтому определение последовательности ДНК – секвенирование
(от англ. sequence – последовательность), является важной задачей биоорганической химии. Для секвенирования ДНК на сегодня разработаны различные способы, ряд биотехнологических фирм выпускает секвенирующие установки, позволяющие проводить работу с огромной скоростью. Эти технологические достижения позволили определить последовательности не только коротких ДНК, но и целых геномов, вплоть до генома человека. В рамках нашего курса будут рассмотрены два способа секвенирования – химический и химико-ферментативный.
Химический способ секвенирования используют для прочтения коротких одноцепочечных олигонуклеотидов. Принцип метода заключается в проведении гидролиза олигонуклеотида различными специфичными химическими реагентами и последующего анализа полученных фрагментов с помощью электрофореза. На рисунке
2.14 приведен простой пример секвенирования октануклеотида GTCAGACT.
На первом этапе производят мечение олигонуклеотида введением радиоактивного остатка фосфорной кислоты по 5’-концу. Далее образец делят на 4 порции и в каждую пробирку добавляют разные химические реагенты.
1). Действием диметилсульфата молекула расщепляется по гуанозиновым звеньям.
Таким образом, в этой пробирке окажутся 4 фрагмента, но только два из них будут радиоактивно меченными (т.е. содержащими радиоактивный фосфат на 5’-конце) – pG и pGTCAG.
2). Действием муравьиной кислоты в другой пробирке эта же молекула расщепляется по всем пуриновым основаниям на 8 фрагментов, но радиоактивными будут только 4 из них – pG, pGTCA, pGTCAG и pGTCAGA. 2). Действием муравьиной кислоты в другой пробирке эта же молекула расщепляется по всем пуриновым основаниям на 8
89

Рис. 2.14. Принцип химического секвенирования (по Максаму-Гилберту) на примере октануклеотида. Кружки означают наличие радиоактивной метки на фрагменте.
фрагментов, но радиоактивными будут только 4 из них – pG, pGTCA, pGTCAG и pGTCAGA.
3). Действием гидразина в третьей пробирке олигонуклеотид расщепляется по всем пиримидиновым основаниям на 8 фрагментов, но радиоактивными будут только 4 из них
– рGT , рGTC, рGTCAGAC и рGTCAGACT
4). В 4-й пробирке действием гидразина в присутствии соли NaCl олигонуклеотид расщепляется только по цитидинам. При этом образуется 4 фрагмента, но радиоактивными будут только 2 – рGTC и рGTCAGAC.
90
