
УП- Биоорганическая химия
.pdfДалее сложную липидную смесь можно разделить с помощью различных видов хроматографии. Например, с помощью адсорбционной хроматографии, где в качестве неподвижной фазы используют полярный сорбент силикагель (SiO2), а в качестве подвижной – смеси органических растворителей.
При хроматографии в колоночном варианте раствор липидной смеси наносят сверху на силикагель в колонке и прокачивают через нее смеси органических растворителей с последовательно увеличивающейся долей полярного компонента, например, хлороформ с увеличивающимся содержанием спирта. При этом липиды элюируются (смываются) с
колонки по очереди в соответствии с полярностью молекул – нейтральные триацилглицериды двигаются быстрее, полярные – медленнее, а заряженные элюируются последними при очень высоком содержании спирта. Если хроматографию проводят в тонком слое (ТСХ), где силикагель нанесен на стеклянную или алюминиевую пластину,
то раствор липидной смеси наносят на один конец пластины и помещают ее в хроматографическую камеру, на дне которой находится растворитель. Растворитель поднимается вверх по пластине за счет капиллярных сил, а вместе с ним двигаются липиды. В результате процесса компоненты смеси формируют зоны липидов также в соответствии с их полярностью.Для идентификации липидов в полученных фракциях используют другие виды хроматографии – газожидкостную, масс-спектрометрию, а также ряд химических методов (гидролиз, получение пригодных для анализа производных и пр.). Часто для определения состава сложных липидов и типа связи между группами используют специфические гидролизующие ферменты.
Мощным инструментом для изучения липидов является масс-спектрометрия. На рис. 4.10
показан хромато-масс-спектрометр Agilent Technology 5975C (США) (кафедра гидробиологии, Институт фундаментальной биологии и биотехнологии СФУ), а также примеры хроматограмм, полученных при анализе липидного состава озерных рыб омуля и щуки.
Данный прибор объединяет в себе высокоэффективную хроматографическую систему, с помощью которой сложная смесь разделяется на составные соединения,
которые идентифицируют с помощью последующей масс-спектрометрии. В памяти прибора содержится информация о более чем 200 000 соединений, что позволяет быстро проводить подобную идентификацию. Обратите внимание, насколько четко разделяются арахидоновая (20:4, ω6) и эйкозопентаеновая (20:5, ω5) кислоты, молекулярная масса которых отличается всего на 2 единицы. Вопрос: чем еще различаются эти жирные
кислоты?
151

Рис. 4.10. Вверху: хромато-масспектрометр Agilent Technology 5975C (США). А и В – состав жирных кислот щуки и омуля, соответственно. Показано процентное содержание некоторых жирных кислот. Материал любезно предоставлен д.б.н. Г.С. Калачевой, ИБФ СО РАН, Красноярск.
Липидный состав различных биологических объектов является важнейшей их
характеристикой. На основе этих данных устанавливают их биологическую роль,
152

метаболизм в клетке, пищевую ценность продуктов, связи в пищевой цепи,
сосуществование организмов в биоте и т.д.
Особую структуру имеют мембранные липиды архей – микроорганизмов, живущих в особых «нефизиологических» условиях (экстремофилов) – при высоких температурах,
необычных значениях рН или высокой ионной силы среды. Столь необычные условия среды не могли не отразиться на структуре клеточной мембраны этих организмов. На рисунке 4.11 представлена одна из типичных структур мембранных липидов архей. На противоположных концах этих молекул находятся гидрофильные остатки глицеринов,
этерифицированных углеводным фрагментом и глицерофосфатом. Между ними находится гидрофобная область, образованная длинными предельными углеводородными радикалами изопреноидного типа, которые присоединены к глицеринам простыми
Рис. 4.11. Пример мембранных липидов архей. Глицериновый остаток на правом конце молекулы имеет нестандартную конфигурацию. Подобные структуры формируют монослойную мембрану.
эфирными связями. Углеводородные радикалы могут быть различного строения, в том числе содержать циклопентановые кольца.
Таким образом, изложенный материал демонстрирует насколько велико многообразие соединений липидной природы и, в частности, омыляемых липидов. На рисунке 4.12 приведена основная классификация омыляемых липидов, которые обсуждались в рамках нашего курса. Она суммирует основные структурно-
функциональные характеристики этих соединений и ее рассмотрение будет полезным для усвоения этого материала.
4.4. Неомыляемые липиды
Неомыляемые липиды – это множество гидрофобных соединений, которые при гидролизе не распадаются на составляющие его молекулы. Представителями этой группы
153

липидов являются стероиды – соединения, каркас молекул которых составляет циклопентапергидрофенантрен или стеран (Рис. 4.13).
Молекула стерана состоит из 4-х конденсированных колец, полностью насыщенная. В пространстве эта молекула принимает несколько конформационных состояний, слабо отличающихся энергетически, т.е. легко переходящих одно в другое. У
Рис. 4.13. Строение стерана и его природных производных.
природных стероидов, как правило, в положениях 10 и 13 стерана находятся метильные группы, в положении 17 – радикалы различного строения, а в положении 3 – свободная или замещенная гидроксильная группа или ее заместители. В природе найдено значительное количество разнообразных стероидов, среди которых важнейшим является холестерол (Рис. 4.13). Холестерол составляет 30-40% от массы внутриклеточных мембран животных клеток (см. Рис. 4.5). Холестерол укрепляет липидный бислой,
уменьшая проходимость малых водорастворимых молекул, а также препятствует кристаллизации углеводородных «хвостов». Наличие гидроксильной группы в положении
3 придает полярность этому участку молекулы холестерола. При ее локализации в билипидном слое мембран она направлена к внешнему полярному участку, а кольцевая часть молекулы холестерола погружена в гидрофобную центральную часть мембраны.
Холестерол является предшественником большой группы стероидных гормонов
(Рис. 4.14).
154

Рис. 4.14. Классификация и структура некоторых стероидных гормонов.
В соответствии с функциями, которые эти гормоны выполняют в организме, их разделяют на следующие группы:
–глюкокортикоиды (например, кортизол), регулирующие метаболизм углеводов, белков и пептидов, а также влияющие на ряд других жизненно важных функций, в том числе воспалительные реакции;
–минералокортикоиды (альдостерон), регулирующие водно-солевой обмен в почках;
–половые гормоны – андрогены и эстрогены, например, тестостерон и эстрадиол.
Стероидные гормоны нерастворимы в воде и потому их транспорт по кровяному руслу к нужным тканям осуществляется в виде соединений с соответствующими белками.
Одними из производных стероидного ряда являются витамины группы D, которые участвуют в регуляции метаболизма ионов Са2+ (Рис. 4.15).
155

156
Рис. 4.12. Основные классы омыляемых липидов.

Рис. 4.15. Структура витамина D2. В результате окисления стерана цикл В разрушен
В клетках печени из холестерола синтезируется еще одна группа веществ с общим названием желчные кислоты. Их характерной структурной чертой является наличие карбоксильной группы у углеводородного радикала в положении С17. На рисунке 4.16
приведена структурная формула холиевой кислоты. В пространстве эта молекула образует
«бананчик», одна сторона которого гидрофобна, а другая гидрофильна за счет карбоксильной и трех гидроксильных групп. Такое строение молекулы желчной кислоты
Рис. 4.16. Холиевая кислота (слева) и комплексы желчных кислот с липидной мицеллой и липазой (справа).
157
позволяет образовывать тройные комплексы с мицеллами триацилглицеридов
(гидрофобные молекулы) и белками-липазами (гидрофильными молекулами), которые начинают процессы ферментативного расщепления липидов.
Задачи и упражнения к Части 4
1.Чем отличаются липиды от остальных 3-х классов биологических молекул, изученных нами ранее – белков, углеводов и нуклеиновых кислот?
2.Повторите названия длинноцепочечных карбоновых кислот. Какие из них чаще всего встречаются в составе липидов?
3.Липиды содержат жирные кислоты с 18 атомами углерода. t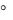 плавления кислот:
плавления кислот:
стеариновой – +69,6°С, олеиновой – +13,4°С, линолевой – -5°С, линоленовой – -11°С.
а) Какая особенность этих жирных кислот может коррелировать с температурой плавления? Какова общая закономерность изменения температуры плавления?
б) Изобразите все возможные триацилглицериды, которые могут быть образованы из глицерина, пальмитиновой и олеиновой кислот.
в) Жирные кислоты с разветвленными цепочками обнаружены в некоторых мембранных липидах бактерий. Будет ли их присутствие увеличивать или уменьшать текучесть мембран (т.е. увеличивать или уменьшать их точку плавления)?
4.Общим свойством мембранных липидов является их амфифильность. Например, в
фосфатидилхолине две жирнокислотные цепочки гидрофобны, а фосфохолиновая
«головка» гидрофильна. Назовите гидрофобные и гидрофильные компоненты для следующих мембранных липидов: а) фосфатидилэтаноламина, б) сфингомиелина, в)
галактозилцереброзида, г) ганглиозида, д) холестерола.
5.Изобразите структуры следующих ж.к.:
а) омега-6 жирной кислоты 16:1;
б) линолевых кислот, с нетрадиционным расположением и конфигурацией (цис- (с) или транс- (t)) двойных связей – С18:2, ω9с,11t; С18:2, ω9t,11c; С18:2, ω10t12c;
в) ацетиленовых (а) эйкоза-11,14,17-триен-8-иновой (20:4, 8а,11,14,15) и октадека-9,12,15-
триен-6-иновой кислот (18:4, 6а,9,2,15).
158
6.Общепринятой процедурой для очистки жироуловителя в раковине является добавление средств, содержащих гидроксид натрия. Объясните, как они действуют.
7.Анализ состава липида показал, что в нем на один моль жирной кислоты приходится строго один моль неорганического фосфата. Может ли этот липид быть: а)
глицерофосфатом, б) ганглиозидом, в) сфингомиелином?
8.Полный гидролиз глицерофосфата привел к образованию глицерина, двух жирных кислот, 16:1 (Δ9) и 16:0, фосфорной кислоты и серина в соотношении 1:1:1:1.
Изобразите этот липид.
9.Дана смесь липидов: фосфатидилсерин, фосфатидилэтаноламин,
холестнринпальмитат (стеариновый эфир), сфингомиелин, пальмитат, н-тетрадеканол,
триацилглицерин и холестерол. В каком порядке эти молекулы будут выходить из колонки с силикагелем при ее промывке растворителями с нарастающей полярностью?
10.Нингидрин реагирует с первичными аминами, образуя пурпурно-голубой продукт.
После тонкослойной хроматографии фосфолипидов печени крыс пластинку опрыскали раствором нингидрида. Какие фосфолипиды можно определить таким образом?
11.Изобразите возможные изомеры олеиновой кислоты. Как отличаются их температуры плавления? Объясните.
12.Нарисуйте молекулу глицерофосфолипида, у которого в первом положении находится насыщенная С16 кислота, во втором – мононенасыщенная С18 кислота и в третьем – этаноламин.
13.Почему триацилглицериды не могут быть необходимыми компонентами билипидного слоя?
Какие мембранные липиды будут синтезировать бактерии, обычно культивируемые при
20°С, если их культивирование проводить при 30°С: а) с насыщенными или ненасыщенными жирными кислотами, б) с короткоцепочечными или длинноцепочечными жирными кислотами?
ЦИТИРУЕМАЯ ЛИТЕРАТУРА
1. T. Kaneda. Fatty acids of the genus bacillus: an example of branched-chain preference.
Bacteriological reviews, 1977, V. 41, No. 2, P. 391-418. 159
2.N. Zhila, G. Kalacheva, T. Volova. Fatty acid composition and polyhydroxyalkanoates production by Cupriavidus eutrophus B-10646 cells grown on different carbon sources. Process Biochemistry, 2015, V. 50, P. 69-78.
3Г.С. Калачева, Э.К. Родичева, В.C. Бондарь, С.Е. Медведева, И.И. Гительзон. Состав жирных кислот липидов светящегося гриба Neonothopanus nambi при разных условиях культивирования. Микология и фитопатология. 2016. Т. 50, вып. 5, С. 318-329.
4Г.С. Калачева, Н.Н. Сущик, М.И. Гладышев, О.Н. Махутова. Сезонная динамика жирных кислот липидов водного мха Fontinalis antipyretica, собранного в реке Енисей.
Физиология растений, 2009, Т. 56, С. 1-14.
160
