
- •1. Параметры состояния
- •Давление
- •Температура
- •2. Идеальные газы
- •3. Смеси идеальных газов
- •Уравнение состояния смеси
- •Теплоемкость смеси идеальных газов
- •4. Первый закон термодинамики
- •Пример решения задач
- •5. Процессы изменения состояния идеальных газов
- •Пример решения задач
- •6. Второй закон термодинамики. Работоспособность газов
- •Пример решения задач
- •7. Вода и водяной пар. Равновесная парожидкостная смесь
- •Пример решения задач
- •8. Цикл Ренкина (цикл паросиловых установок)
- •Термический к.П.Д. Цикла Ренкина
- •Цикл Ренкина с промежуточным перегревом пара
- •Примеры решения задач
- •9. Цикл парокомпрессорной холодильной установки
- •Пример решения задач
- •10. Циклы газотурбинных установок
- •Пример решения задач
- •Приложение
- •Литература
5. Процессы изменения состояния идеальных газов
Исследование термодинамического процесса включает в себя получение аналитической связи между термодинамическими параметрами газа, определение их значений и приращений в различных термодинамических состояниях, реализуемых в процессе.
Фундаментальные соотношения для идеального газа (в удельных массовых величинах):
Pv=RT – уравнение состояния (Клапейрона);
du=cvdT, dh=cpdT – закон Джоуля;
с
(5.1)
две формы уравнения
первого закона термодинамики
(5.2)![]() –
–
Изобарный процесс (P=P0=const)
а). В этом случае для любых двух состояний газа
P0 v1=RT1, P0 v2=RT2.
Отсюда следует характерная для этого процесса связь между термодинамическими параметрами (уравнение процесса):
![]() или
или
![]() .
.
б). Поскольку dP0, то из (5.1) следует, что все тепло идет на изменение энтальпии:
q = h = cpdT.
Располагаемая работа равна нулю.
в). С учетом этого из (5.2) следует
u = h – P0V = h – RT.
Работа расширения А = P0V.
Изохорный процесс (V=V0=const)
Поскольку M=const, то v0=V0/M=const.
a). Для любых двух состояний
P1v0=RT1 , P2v0=RT2.
Отсюда следует уравнение изохорного процесса
![]() или
или
![]() .
.
б). Из (5.2) получаем q=u=cvT – все тепло идет на изменение внутренней энергии; т.к. dv0, работа расширения равна нулю.
в). Из (5.1) следует
h = u +v0P = u+RT = q+v0P.
Располагаемая работа v0P = h –u = RT.
Изотермический процесс (T=T0=const)
а). Из уравнения состояния для двух произвольных «точек» этого процесса
P1v1=RT0 , P2v2=RT0
следует уравнение процесса
![]() или
Pv=RT0=const.
или
Pv=RT0=const.
б). В соответствии с законом Джоуля, т.к. dT0,
du = cvdT 0, dh = cpdT 0 (u=h=0).
в). Из уравнения (5.2) следует, что dq=Pdv – все тепло идет на совершение работы, и наоборот.
Из (5.1) следует, что dq = –vdP – располагаемая работа равна работе расширения с обратным знаком.
г). Произведенная работа (работа расширения)

Здесь использованы следующие из уравнения процесса равенства:
P1v1= P2 v2 =Pv= RT0=const и .
Адиабатный процесс (dq=0)
В этом процессе отсутствует теплообмен с окружающей средой:
Q=Mq=0.
a). Поскольку dq=0, уравнения (5.1), (5.2) имеют вид
![]() ,
,
![]() (
(![]() =dh;
=dh;
![]() =du).
=du).
Разделив первое уравнение на второе (отдельно левые и правые части), получаем
![]()
(![]() – показатель адиабаты).
Из этого уравнения следует
– показатель адиабаты).
Из этого уравнения следует
![]() ,
т.е.
,
т.е.
![]() ,
,
![]() и
и
![]() или
или
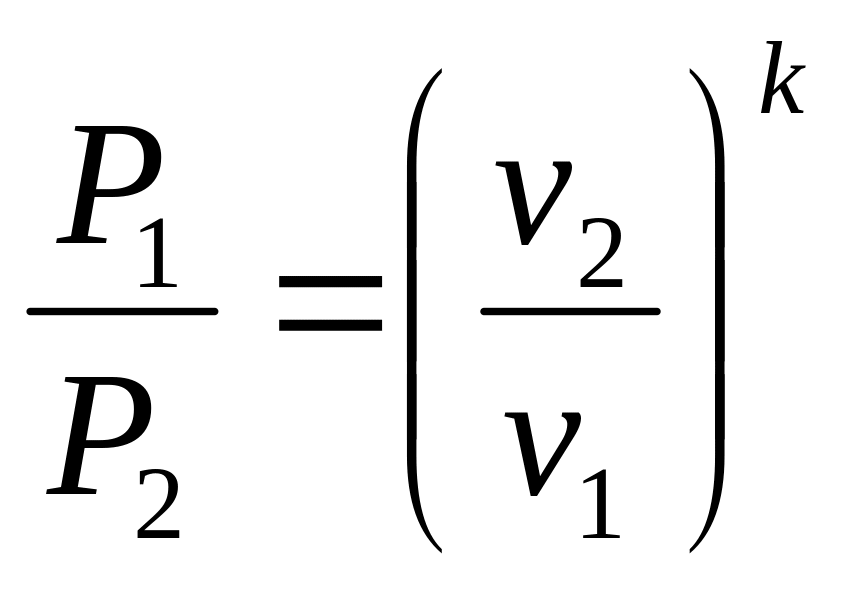 . (5.3)
. (5.3)
Это и есть уравнение адиабатного процесса, а т.к. Pv=RT, можно представить его в виде
![]() или
или
 . (5.4)
. (5.4)
б). Располагаемая работа в адиабатном процессе в k раз больше работы расширения:
vdP= –k(Pdv).
Поскольку vdP=dh, а du= –pdv, приращение энтальпии в k раз больше приращения внутренней энергии:
dh=kdu.
в). Для работы (работа расширения), совершаемой газом в адиабатном процессе при переходе из одного состояние в другое,
dA=Pdv.
Поскольку h=u+Pv, то
dh–du=d(Pv)=Pdv+vdP=dA–kdA=(1–k)dA,
следовательно, получаем
dA= –d(Pv)/(k–1).
Отсюда после интегрирования
![]() .
.
Используя различные уравнения адиабатного процесса (5.3) или (5.4), формулам для A можно придать различный вид, например,
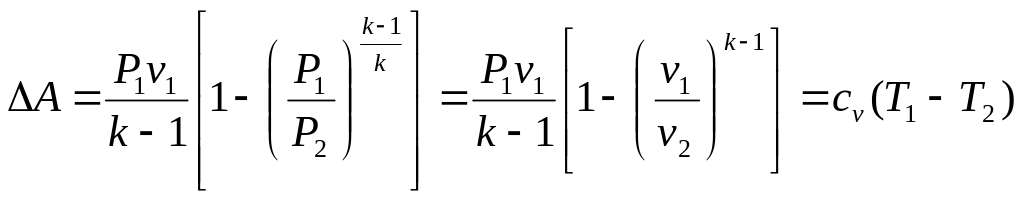 .
.
Политропный процесс (dq=cпdT, cп=const)
Этот процесс характеризуется линейной зависимостью Q от T.
а). Для этого процесса уравнения (5.1), (5.2) имеют вид
![]() (du=cvdT,
dh=cpdT),
(du=cvdT,
dh=cpdT), ![]() .
.
Перенесем
![]() в левые части этих уравнений:
в левые части этих уравнений:
![]() ,
,
![]() .
.
Разделив первое уравнение на второе, получим
![]() ,
vdP=
–n(Pdv)=
– ndA
,
vdP=
–n(Pdv)=
– ndA
(n – показатель политропы). Действуя как в предыдущем пункте, получим уравнение политропного процесса
![]()
или

т.е. уравнения предыдущего пункта (5.3) и (5.4) с заменой k на n.
Замечание.
Из равенства
![]() c
учетом того, что cp=kcv,
следует связь между n
и k:
c
учетом того, что cp=kcv,
следует связь между n
и k:
![]() .
.
б). Для работы, совершаемой газом (dA=Pdv) при переходе из одного состояния в другое, получаем те же формулы, что и для адиабатного процесса, с заменой в них k на n. Действительно,
dh–du=d(Pv)=Pdv+vdP=–ndA+kdA=(1–n)dA
и
dA= –d(Pv)/(n–1).
Отсюда
![]()
и т.д.
Замечание. Задание объема Vн (м3) идеального газа, «приведенного к нормальным условиям» (P0=101325 Па, T0=273,15 К), фактически задает его массу M (кг) , т.к.
P0 Vн=МRT0 .
