
2550
.pdfМинистерство образования и науки РФ ГОУ ВПО «Сибирская государственная автомобильно-дорожная
академия (СибАДИ)»
В.А.Хомич, С.А.Эмралиева
СБОРНИК ЗАДАЧ ПО ХИМИИ
Омск
СибАДИ
2011
1
УДК 546
ББК 24.1 С 91
Рецензенты: канд.хим.наук, доц. Л.Н.Котова (ОмГТУ); канд.хим.наук, доц. В.Л.Штабнова (ОГИС)
Работа одобрена редакционно-издательским советом академии в качестве сборника задач для студентов очной и заочной форм обучения.
Сборник задач по химии / В.А.Хомич, С.А.Эмралиева. Омск: СибАДИ, 2011. 179 с.
Сборник задач для самостоятельной работы по углубленному изучению химии для студентов направлений бакалавриата: 140400 – электроэнергетика и электротехника, 141100 – энергетическое машиностроение, 151000 – технологические машины и оборудование, 190100 – Наземные транспортнотехнологические комплексы, 190600 – Эксплуатация транспортнотехнологических машин и комплексов, 190700 – Технология транспортных процессов, 220700 – Автоматизация технологических процессов и производств.
Сборник задач содержит теоретический материал, разобранные примеры решения типовых задач и условия задач, тестовые задания, а также необходимые справочные таблицы. Условия задач могут быть использованы в качестве заданий для выполнения контрольной работы студентами заочной формы обучения.
Табл. 11. Библиогр.: 6 назв.
ГОУ «СибАДИ», 2011
2
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ……………………………………………………………………… 4
ДЕДАКТИЧЕСКАЯ ЕДИНИЦА 1. ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ…………………………………………………………………………. 5
1.Моль. Эквивалент. Закон эквивалентов…………………………………. 5
2.Строение атома и периодическая система элементов……..……………. 14
3.Классы неорганических соединений…………………………………….. 34
4.Способы выражения состава растворов…………………………………. 47
5.Окислительно-восстановительные реакции…………………………….. 59
ДЕДАКТИЧЕСКАЯ ЕДИНИЦА 2. ФИЗИЧЕСКАЯ ХИМИЯ…………… 72
6.Основы химической термодинамики. Термохимия…………………….. 72
7.Основы химической термодинамики. Энтропия. Энергия Гиббса……. 84
8.Химическая кинетика и равновесие…………………………………...... 96
9.Общие свойства растворов……………………………………………….. 114
10. Электрохимические процессы. Гальванические элементы…………… 126
11.Электрохимические процессы. Коррозия металлов………………....... 137
12.Электрохимические процессы. Электролиз……………………………. 150
Библиографический список………………………………………………… |
167 |
|
ПРИЛОЖЕНИЕ 1. Значения некоторых фундаментальных постоянных…. |
167 |
|
ПРИЛОЖЕНИЕ 2. Принятые сокращения и величины…………………... |
168 |
|
ПРИЛОЖЕНИЕ 3. Периодическая таблица Менделеева……………………. |
170 |
|
ПРИЛОЖЕНИЕ 4. Потенциал ионизации атомов, сродство атомов к |
|
|
электрону и электроотрицательность элементов ……………………………. |
171 |
|
ПРИЛОЖЕНИЕ 5. |
Таблица кислот…………………………………………. |
172 |
ПРИЛОЖЕНИЕ 6. |
Таблица растворимости…………………………………. |
174 |
ПРИЛОЖЕНИЕ 7. |
Термодинамические константы некоторых веществ…. |
175 |
ПРИЛОЖЕНИЕ 8. Стандартные электродные потенциалы φ0 некоторых |
|
|
металлов (ряд напряжений)……………………………………………………. |
177 |
|
ПРИЛОЖЕНИЕ 9. |
Варианты контрольных заданий ……………………… |
178 |
3
ВВЕДЕНИЕ
Дисциплина «Химия» преподается студентам на лекциях, а также лабораторных занятиях, так как химия является экспериментальной наукой. С введением контроля знаний студентов путем тестирования, навыков в практическом применении теоретических химических знаний, получаемых на лабораторных работах, становится явно недостаточно. Для овладения алгоритмами решения задач и выполнения тестовых заданий необходима самостоятельная работа студентов, для которой и предназначен данный сборник.
Сборник задач включает материал двух основных дедактических единиц (ДЕ):
Первая ДЕ «Общая и неорганическая химия» включает 5 тем:
1.Моль. Эквивалент. Закон эквивалентов.
2.Строение атома и периодическая система элементов.
3.Классы неорганических соединений.
4.Способы выражения состава растворов.
5.Окислительно-восстановительные реакции.
Вторая ДЕ «Физическая химия» включает 7 тем:
6.Основы химической термодинамики. Термохимия.
7.Основы химической термодинамики. Энтропия. Энергия Гиббса.
8.Химическая кинетика и химическое равновесие.
9.Общие свойства растворов.
10.Электрохимические процессы. Гальванические элементы.
11.Электрохимические процессы. Коррозия металлов.
12.Электрохимические процессы. Электролиз.
Таким образом, материал сборника охватывает 12 тем. В приложениях сборника даются таблицы со справочными физикохимическими данными, необходимыми для выполнения заданий.
По каждой теме курса химии, при подготовке к лабораторной работе, студент, после прочтения лекции, должен ознакомиться с теоретическим материалом этого сборника, рассмотреть примеры решения типовых задач, прорешать задачи и выполнить тесты.
Условия задач могут быть использованы в качестве заданий для выполнения контрольной работы студентами заочной формы обучения. Для этого в приложении 1 (табл. П1) приведены номера задач, соответствующие каждому варианту. Всего вариантов – 30, количество задач в каждом варианте – 12.
4
ДЕДАКТИЧЕСКАЯ ЕДИНИЦА 1
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
1. Моль. Эквивалент. Закон эквивалентов
Основной единицей количества вещества по Международной системе является моль. Моль - это количество вещества, содержащее столько структурных единиц, сколько атомов содержится в 0,012 кг изотопа углерода 126С. Структурными единицами могут быть атомы, молекулы, ионы, электроны и другие частицы вещества. Моль – это количество вещества, в котором содержится число частиц, равное постоянной Авогадро (6,02·1023 моль-1). Масса моля вещества М выражается в г/моль. Молярная масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.).
Кроме «моля» в химии применяют такое понятие, как «эквивалент». В некоторых химических реакциях условно принимает участие не целое количество молей структурных единиц, а лишь часть единицы, называемая эквивалентом. Эквивалент – это реальная или условная часть вещества, которая может замещать, присоединять, высвобождать один ион водорода в обменных реакциях или один электрон в окислительно-восстановительных реакциях. Эквивалент – безразмерная величина.
Эквивалент элемента – это такое количество вещества, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса эквивалента элемента называется молярной массой эквивалента mЭ. Количество эквивалентов nЭ выражается в молях, а молярная масса одного эквивалента – в г/моль.
Для решения практических задач в химии молярные массы эквивалентов mЭ рассчитываются по следующим формулам:
mЭ = М/В,
где В – валентность.
Если молекула простого вещества состоит из n атомов, то
mЭ = M/nаB.
5
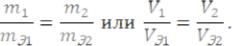
mЭ(кислоты) = M(кислоты)/D,
где D – основность кислоты (количество ионов водорода);
mЭ(основания) = M(основания)/D,
где D – кислотность основания (количество гидроксильных групп);
mЭ(соли) = M(соли)/nа·B,
где nа - число атомов металла; В – валентность металла;
mЭ(оксида) = M(оксида)/nа·B,
где nа - число атомов элемента, В – валентность элемента.
Согласно закону эквивалентов массы (объемы для газов) реагирующих друг с другом веществ m1(V1) и m2(V2) пропорциональны молярным массам их эквивалентов mЭ1 и mЭ2 (молярным объемам их эквивалентов VЭ1 и VЭ2).
Объем, занимаемый при данных условиях молярной массой или молярной массой эквивалентов газообразного вещества, называется
молярным или, соответственно, молярным объемом эквивалентов
этого вещества. Молярный объем любого газа при н.у. VМ = 22,4 дм3·моль-1. Отсюда молярный объем эквивалентов водорода VЭ(Н2), молекула которого состоит из двух атомов, равен 22,4/2 = 11,2 дм3·моль-1.
Примеры решениятиповых задач
Пример 1. Выразите в молях: а) 6,02·1021 молекул СО2; б) 1,2·1024 атомов кислорода; в) 2,0·1023 молекул воды. Определите молярную массу указанных веществ.
6
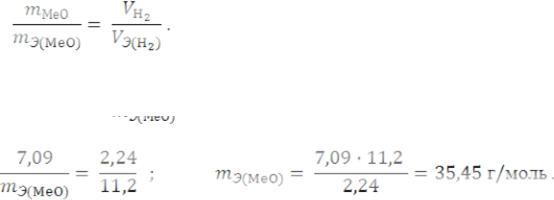
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного вида, равное постоянной Авогадро (табл. П.3). Отсюда: а) 0,01 моль; б) 2 моль; в) 1/3 моль.
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44, 18, 16 а.е.м., то их молярные массы равны: а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Пример 2. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 дм3 водорода (н.у.) Вычислите молярную массу эквивалентов оксида металла и металла. Чему равна молярная масса металла?
Решение. Согласно закону эквивалентов
Из последнего уравнения находим молярную массу эквивалентов оксида металла 


 :
:
Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей. Отсюда
mЭ(Ме) = mЭ(МеО) – mЭ(О) =35,45 – 8 = 27,45 г/моль.
Молярная масса металла определяется из соотношения mЭ =M/В.
Отсюда М = 27,45 · 2 = 54,9 г/моль.
Пример 3. Вычислите молярные массы эквивалентов H2SО4 и
Аl(ОН)3 в реакциях, выраженных уравнениями: |
|
||
H2SО4 |
+ KOH = KHSО4 + H2О; |
(1) |
|
Н2SО4 |
+ Мg = МgSO4 + Н2; |
(2) |
|
Аl(ОН)3 |
+ 2НСl = Аl(ОН)Сl2 + 2 H2О; |
(3) |
|
Аl(ОН)3 |
+ 3HNO3 = Al(NO3)3 + 3H2O. |
(4) |
|
Решение. Молярная масса эквивалента сложного вещества, так же как и молярная масса эквивалента элемента, может иметь различные
7

значения и зависит от того, в какую реакцию обмена вступает это вещество. Молярная масса эквивалента кислоты (основания) равна молекулярной массе М, деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп). Следовательно, молярная масса эквивалента Н2SО4 в реакции (1) равна MH2SO4, а в реакции (2) – MH2SO4/2. Молярная масса эквивалента Аl(ОН)3 в реакции (3) равна MАl(ОН)3 а в реакции (4) – MАl(ОН)3/3.
Задачу можно решить и другим способом.
Так как Н2SО4 взаимодействует с одним эквивалентом КОН и двумя эквивалентами магния, то ее молярная масса эквивалента равна в реакции (1) М/1 и в реакции (2) – М/2.
Аl(ОН)3 взаимодействует с одним эквивалентом НС1 и тремя эквивалентами НNО3, поэтому его молярная масса эквивалента в реакции (3) равна М/1, в реакции (4) – М/3. Следовательно, молярные массы эквивалентов
mЭ [H2SО4] = 98/1 = 98 г/моль; |
(1) |
mЭ [H2SО4] = 98/2 = 49 г/моль; |
(2) |
mЭ [Аl(ОН)3] = 78/2 = 39 г/моль; |
(3) |
mЭ [Аl(ОН)3] = 78/3 = 26 г/моль. |
(4) |
Пример 4. Из 3,85 г нитрата металла получено 1,6 г его гидроксида. Вычислите молярную массу эквивалентов металла.
Решение. Аналогично примеру 2, записываем соотношение
Отсюда |
mЭ(Ме) = 15 г/моль. |
Пример 5. В какой массе Са(ОН)2 содержится такое же количество эквивалентов вещества, сколько в 312 г А1(ОН)3?
Решение. mЭ[А1(ОН)3] = М/Z = 78/3 г/моль. Следовательно, количество эквивалентов вещества А1(ОН)3
nЭ[А1(ОН)3] = m[А1(ОН)3]/mЭ[А1(ОН)3] = 312/26 = 12 моль; mЭ[Са(ОН)2] = 74/2 = 37 г/моль.
Отсюда m[Са(ОН)2] = mЭ[Са(ОН)2] · nЭ = 37 · 12 = 444 г.
8
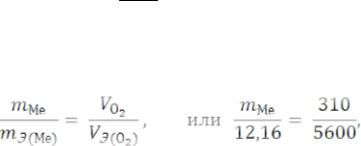
Пример 6. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества содержит постоянную Авогадро NА структурных единиц (в нашем примере молекул) (табл. П.1).
MH2SО4 = 98,0 г/моль. Следовательно, масса одной молекулы
98/(6,02·1023) = 1,63·1022 г.
Пример 7. Вычислите массу металла, молярная масса эквивалента которого 12,16 г/моль взаимодействует с 310 см3 кислорода, измеренного при н.у.?
Решение. Молярная масса О2 (32 г/моль) при н.у. занимает объем 22,4 дм3, а объем молярной массы эквивалента кислорода (8 г/моль) равен
22,4 5,6 дм3.
4
По закону эквивалентов,
откуда |
m Me |
|
12 ,16 310 |
0,673 г. |
||
|
5600 |
|||||
|
|
|
|
|||
Задачи для самостоятельного решения
1-1. Определите, в какой массе NaOH содержится такое же количество вещества эквивалентов, сколько в 140 г КОН?
Ответ: 100 г.
1-2. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалентов этого металла.
Ответ: 32,5 г/моль.
1-3. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалентов этого металла.
Ответ: 9 г/моль.
9
1-4. Оксид трехвалентного элемента содержит 31,58 % кислорода. Вычислите молярную массу эквивалентов и молярную массу этого элемента.
Ответ: 17,3 г/моль; 52 г/моль.
1-5. Чему равен при н.у. объем эквивалентов водорода? Вычислите молярную массу эквивалентов металла, если на восстановление 1,017 г его оксида израсходовано 0,28 дм3 водорода
(н.у.).
Ответ: 11,2 дм3; 32,68 г/моль.
1-6. Выразите в молях: а) 6,02·1022 молекул С2Н2; б) 1,8·1024 атомов азота; в) 3,01·1023 молекул NH3. Какова молярная масса указанных веществ?
1-7. Вычислите молярную массу эквивалентов Н3РО4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
1-8. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалентов металла и его оксида. Чему равна молярная масса этого металла?
Ответ: 23 г/моль; 31 г/моль; 23 г/моль.
1-9. На сжигание 1,5 г двухвалентного металла требуется 0,69 дм3 кислорода (н.у.). Вычислите молярную массу эквивалентов металла и его молярную массу.
Ответ: 12,17 г/моль; 24,34 г/моль.
1-10. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите молярную массу эквивалентов этого металла.
Ответ: 103,6 г/моль.
1-11. Напишите уравнения реакций Fe(OH)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите молярные массы эквивалентов Fe(OH)3 в каждой реакции.
1-12. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их молярные массы эквивалентов.
1-13. В какой массе Сr(ОН)3 содержится такое же количество вещества эквивалентов, сколько в 174,96 г Mg(OH)2?
Ответ: 206 г.
1-14. Избытком хлорводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида
10
