
2550
.pdf
|
|
|
|
Продолжение табл. 2 |
1 |
2 |
|
3 |
4 |
3-2 |
SeO3 + MgO → |
|
3-17 |
Mn2O7 + HNO3 → |
|
CsOH + CaO → |
|
|
CdO + HClO4 → |
|
FeSO4 + LiOH → |
|
|
Fe2(SO4)3 + RbOH → |
|
BaHPO4 + Ba(OH)2 → |
|
|
Na3AsO4 + H3AsO4 → |
|
MgOHCI + H2SO4 → |
|
|
Mg(OH)2CO3 + H2SO4 → |
|
As + Ba → |
|
|
Mg + Cl2 → |
3-3 |
Al2O3 + NaOH → |
|
3-18 |
CdO + HMnO4 → |
|
WO3 + K2O → |
|
|
CrCl3 + NH4OH → |
|
Cr(SO4)3 + NaOH → |
|
|
BaCO3 + H2CO3 → |
|
Mg(H2PO4)2 + KOH → |
|
|
(CuOH)2SO4 + H2SO4 → |
|
SnCl2 + HgSO4 → |
|
|
Hg + SnCl2 → |
|
K + H2O → |
|
|
CaHPO4 + Ca(OH)2 → |
3-4 |
BeO + HMnO4 → |
|
3-19 |
As2O5 + Mg(OH)2 → |
|
TiO2 + Ca(OH)2 → |
|
|
Ag2O + H2SO4 → |
|
Sr(OH)2 + H2S → |
|
|
FeS + H3PO4 → |
|
KOH + KHSO3 → |
|
|
Na2SeO3 + H2SeO3 → |
|
FeOHBr2 + HBr → |
|
|
Au + H2SO4 → |
|
Ag + H3AsO4 → |
|
|
(CaOH)2CO3 + HBr → |
3-5 |
FeO + KOH → |
|
3-20 |
SiO2 + RbOH → |
|
K2CO3 + Pb(NO3)2 → |
|
|
CaO + HMnO4 → |
|
Zn(HCO3)2 + NaOH → |
|
|
FeCl3 + Na2SO4 → |
|
(MgOH)2CO3 + HBr → |
|
|
NiOHNO3 + HNO3 → |
|
Ca(OH)2 + HMnO4 → |
|
|
Zn + CuCl2 → |
|
Fe + CuCl2 → |
|
|
Mg(HCO3)2 + KOH → |
3-6 |
Li2O + H3PO4 → |
|
3-21 |
RbOH + As2O5 → |
|
CaO + Re2O7 → |
|
|
NaO + SnO2 → |
|
Na3PO4 + BaCI2 → |
|
|
Na2SO4 + FeCI3 → |
|
NaHSO4 + KOH → |
|
|
ZnCO3 + H2CO3 → |
|
FeOHCI2 + HCl → |
|
|
K2O + HClO4 → |
|
Au + HCl → |
|
|
(SrOH)2CO3 + HCl → |
3-7 |
BeO + Ca(OH)2 → |
|
3-22 |
SO3 + NH4OH → |
|
SrO + MoO3 → |
|
|
CuO + P2O5 → |
|
Li2SO3 + H2SO3 → |
|
|
Li2SiO3 + H2SO4 → |
|
(ZnOH)2CO3 + HNO3 → |
|
|
NaHCO3 + NaOH → |
|
Al(NO3)3 + CuSO4 → |
|
|
CdOHCl + HNO3 → |
|
Al + Se → |
|
|
Al + Te → |
3-8 |
NiO + H3PO4 → |
|
3-23 |
SrO+ KOH → |
|
CrO3 + La2O3 → |
|
|
NH3 + Na2CrO4 → |
|
Ba(OH)2 + KNO3→ |
|
|
Al(NO3)3 + CuSO4 → |
|
Ca(H2PO4)2 + KOH → |
|
|
Ca(OH)2 + Ca(HCO3)2 → |
|
H2CO3 + (MgOH)2CO3 → |
|
|
(PbOH)2CrO4 + H2CrO4 → |
|
In + Se → |
|
|
Cd +HBr → |
|
|
|
|
|
|
|
41 |
|
|

|
|
|
|
Окончание табл. 2 |
|
2 |
|
3 |
4 |
3-9 |
Bi2O5 + Sr(OH)2 → |
|
3-24 |
FeO + NaOH → |
|
Fe2O3 + HF → |
|
|
Li2CO3 + Pb(NO3)2 → |
|
Ba(NO3)2 + K2SiO3 → |
|
|
Zn(HSiO3)2 + KOH → |
|
MgOHCl + H2SO4 → |
|
|
(SrOH)2SO4 + HBr → |
|
LiHCO3 + NaOH → |
|
|
Mg(CO3) + HClO4 → |
|
Ca + P → |
|
|
Sn + CuCl2 → |
3-10 |
As2O5 + Ca(OH)2 → |
|
3-25 |
K2O + H3PO4 → |
|
CdO + TiO2 → |
|
|
ZnO + Mn2O7 → |
|
MgCO3 + HCI → |
|
|
Na3AsO4 + CaCI2 → |
|
Ca(HS)2 + NaOH → |
|
|
Ca(HSO4)2 + LiOH → |
|
(CuOH)2CO3 + HCl → |
|
|
AlOHCI2 + HClO4 → |
|
Hg +HCl → |
|
|
Au + H2CrO4 → |
3-11 |
WO3 + H2SO4 → |
|
3-26 |
BeO + NaOH → |
|
FeO + H3PO4 → |
|
|
CaO + CrO3 → |
|
Pb(NO3)2 + KCl → |
|
|
K2SO4 + H2SO4 → |
|
Sr(HSO3)2 + KOH → |
|
|
(MgOH)2CO3 + HCl → |
|
(CaOH)2SO4 + H3PO4 → |
|
|
Al(MnO4)3 + CuSO4 → |
|
Ca + S → |
|
|
Al + CdCl2 → |
3-12 |
V2O5 + Mg(OH)2 → |
|
3-27 |
ZnO + H3PO4 → |
|
HgO +HJ → |
|
|
CrO3 + Li2O → |
|
K2CO3 + Pb(NO3)2 → |
|
|
Ca(OH)2 + KNO2→ |
|
ZnSO3 + H2SO4 → |
|
|
Ba(H2PO4)2 + Ba(OH)2 → |
|
Ca(OH)2 + HCl → |
|
|
H2CrO4 + (MgOH)2S → |
|
Na + P → |
|
|
Ga + S → |
3-13 |
CrO3 + KOH → |
|
3-28 |
Ca(OH)2 + Bi2O5 → |
|
MnO + NH4OH → |
|
|
Cr2O3 + HCl → |
|
CaS + CH3COOH → |
|
|
Ba(NO2)2 + Li2SiO3 → |
|
K3AsO4 + H3AsO4 → |
|
|
MgOHBr + H3AsO4 → |
|
CuSO4 + NaOH → |
|
|
KHCO3 + RbOH → |
|
Mg + Te → |
|
|
Cs + P → |
3-14 |
ZnO + NaOH → |
|
3-29 |
P2O5 + CaO → |
|
Ag2O + H2SO4 → |
|
|
Cd(OH)2 + SnO2 → |
|
AgNO3 + BaCl2 → |
|
|
SrCO3 + HI → |
|
Ca(H2PO4)2 + KOH → |
|
|
Ba(HS)2 + RbOH → |
|
(FeOH)2SO4 + HCl → |
|
|
(ZnOH)2CO3 + HBr → |
|
Sr + N2 → |
|
|
Hg +H3BO3 → |
3-15 |
SiO2 + Ra(OH)2 → |
|
3-30 |
Re2O7 + Zn(OH)2 → |
|
Cs2O + N2O5 → |
|
|
NiO + HClO4 → |
|
PbS + HNO3 → |
|
|
Ba(NO3)2 + NaOH → |
|
SrSO4 + H2SO4 → |
|
|
Pb(OH)2 + HNO3 → |
|
(ZnOH)2CO3 + HNO3 → |
|
|
K2HPO4 + KOH → |
|
Pb + CaCl2 → |
|
|
Sn + HgSO4 → |
|
|
|
|
|
|
|
42 |
|
|
Тестовые задания
Т3-1. Какие из приведенных ниже реакций невозможны?
а) HC1 + Cu = ;
б) SO2 + K2O = ;
в) Na2O + Са(ОН)2 =.
Т3-2. С какими веществами не взаимодействует Cs2O? а) Н2О;
б) NaOH; в) НCl.
Т3-3. Какие из приведённых реакций возможны?
а) Сu + HCI = ;
б) СО2 + Са(ОН)2 = ;
в) Al + NaOH = .
Т3-4. Оксиды – это соединения, состоящие из а) металла и кислотного остатка; б) металла и кислорода; в) металла и водорода.
Т3-5. Какой металл будет взаимодействовать как с раствором H2SO4(разб), так и с раствором NaOH(разб)?
а) Zn; б) Сa;
в)К.
Т3-6. К какому классу неорганических соединении относится
Ca(HSO4)2?
а) соли; б) основания; в) кислоты.
Т3-7. Оксиды бывают а) ионные; б) аморфные; в) основные.
Т3-8. Кислоты – это соединения, состоящие из а) металла и кислорода; б) водорода и кислотного остатка;
в) металла и кислотного остатка.
Т3-9. К каким солям относится (CaOH)2SO4? а) кислым; б) средним;
43
в) основным.
Т3-10. Кислотные оксиды взаимодействуют с а) кислотами; б) солями; в) оксидами.
Т3-11. Соли – это соединения, состоящие из а) металла и гидроксогруппы; б) металла и кислорода; в) металла и кислотного остатка.
Т3-12. Какой металл взаимодействует с раствором щелочи?
а) Al;
б) Ni;
в) Na.
Т3-13. С какими веществами не взаимодействует СаСl2? а) основаниями; б) основными оксидами; в) кислотами.
Т3-14. Амфотерный оксид – это а) CaO;
б) Cr2O3;
в) CO2.
Т3-15. Основной оксид – это а) N2O5;
б) As2O5;
в) CaO.
Т3-16. С каким из нижеперечисленных соединений будет вступать в реакцию КОН?
а) MgO;
б) Mn2O7;
в) N2O3.
Т3-17. Какие из приведенных ниже реакций возможны?
а) HC1 + Cu = ;
б) SO2 + K2O = ;
в) Na2O + Са(ОН)2 =.
Т3-18. Н2SO4 относится к а) оксидам; б) кислотам; в) солям.
44
Т3-19. К какому классу неорганических соединении относится
ZnOHCl?
а) соли; б) основания; в) кислоты.
Т3-20. С какими веществами не взаимодействует MgO? а) Н2О;
б) NaOH; в) НCl.
Т3-21. К какому типу соли относится NaHCO3? а) кислые; б) средние; в) основные.
Т3-22. Какой металл взаимодействует с раствором щелочи?
а) Zn;
б) K;
в) Co.
Т3-23. При взаимодействии Na с водой получается а) соль; б) кислота;
в) основание.
Т3-24. По числу атомов водорода хлороводородная (соляная) кислота относится к
а) одноосновной; б) двухосновной; в) трехосновной.
Т3-25. Кислотные оксиды реагируют со щелочами с образованием а) кислот; б) основных оксидов; в) солей.
Т3-26. Оксид цинка не реагирует с а) NO;
б) NaOH;
в) CO2;
г) SO2.
Т3-27. Сокращенное уравнение имеет вид Fe2+ + 2OH- = Fe(OH)2 для реакции
а) FeSO4 + H2O →; б) FeSO4 + KOH →;
45
в) FeCO3 + HCl →; г) FeCO3 + KOH →.
Т3-28. Кислая соль образуется при взаимодействии 1 моль Са(ОН)2 с
а) 1 моль HNO3;
б) 1 моль H3PO4;
в) 1 моль CH3COOH; г) 2 моль HCl.
Т3-29. Кислотный характер имеют оксиды, образованные металлами а) со степенью окисления ниже +4; б) с любой степенью окисления; в) главных подгрупп;
г) со степенью окисления равной или выше +4.
Т3-30. При взаимодействии 1 моль гидроксида натрия и 1 моль серной кислоты образуется ___ соль и вода
а) кислая; б) двойная; в) основная; г) средняя.
Т3-31. Образование кислых солей возможно в реакциях между веществами
а) Fe(OH)3 + HCl →; б) KOH + CO2 →; в) N2O5 + NaOH →; г) CaO + H3PO4 →.
Т3-32. Кислотами, которые не образуют кислых солей, являются а) ортофосфорная; б) сернистая; в) хлороводородная; г) азотистая.
Т3-33. При взаимодействии оксида серы (IV) с избытком NaOH образуется а) гидросульфит натрия;
б) гидросульфат натрия; в) сульфит натрия и вода; г) сульфат натрия и вода.
Т3-34. Образование соли аммония возможно в химической реакции а) Fe + HNO3 (конц)→;
б) Cu + HNO3 (разб)→;
в) Mg + HNO3 (разб)→;
46

г) Zn + HNO3 (конц)→.
Т3-35. С кислотами и щелочами взаимодействует оксид а) хрома (III);
б) хрома (II); в) хрома (VI); г) магния.
Т3-36. Уравнение реакции, практически осуществимой в водном растворе, имеет вид
а) Ba(NO3)2 + 2 NaOH = 2 NaNO3 + Ba(OH)2; б) NaNO3 + HCl = NaCl + HNO3;
в) CuSO4 + 2 KOH = K2SO4 + Cu(OH)2;
г) Fe2(SO4)3 + 6 HNO3 = 2 Fe(NO3)3 + 3 H2SO4.
Т3-37. Хлорид меди(II) образуется при действии соляной кислоты на а) бромид меди(II);
б) оксид меди(II); в) медь;
г) карбонат меди(II).
4. Способы выражения состава растворов
Концентрацией раствора называется количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя.
Массовая доля растворенного вещества ω (безразмерная, в
долях единицы) представляет собой отношение массы растворенного вещества mв к массе раствора mр-ра:
Процентная концентрация (С%, %) показывает число граммов
(единиц массы) растворенного вещества mв, содержащееся в 100 г (единиц массы) раствора mр-ра.
47
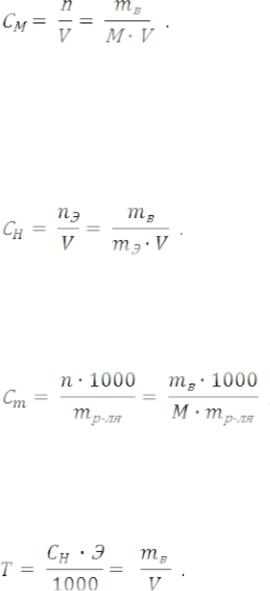
Молярная концентрация растворенного вещества или молярность СМ, (единица измерения – моль/дм3 или сокращенное обозначение «М») представляет собой отношение количества молей растворенного вещества n в 1 дм3 раствора V:
Молярная концентрация эквивалента растворенного вещества,
или нормальная концентрация или нормальность СН (единица измерения – моль/дм3, сокращенное обозначение «н.» или «N») представляет собой отношение количества эквивалентов растворенного вещества nЭ в 1 дм3 раствора V:
Моляльная концентрация растворенного вещества или моляльность Сm (единица измерения – моль/кг) представляет собой отношение количества молей растворенного вещества в 1 кг растворителя:
Титр раствора (Т) (единица измерения – г/см3) – концентрация раствора, равная массе растворенного вещества (m), содержащегося в 1 см3 раствора (V):
Согласно закону эквивалентов вещества взаимодействуют между собой в эквивалентных количествах, поэтому растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т. е.
48

Примеры решениятиповых задач
Пример 1. Вычислите: а) процентную С%; б) молярную СM; в) нормальную Сн. и г) моляльную Сm концентрации раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр Т этого раствора?
Решение:
а) Процентная концентрация показывает число граммов растворенного вещества, содержащееся в 100 г раствора. Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 + 282 = 300 г и, следовательно,
300 г – 18 г.
100 г – С%.
б) Масса 1 дм3 раствора составляет 1031 г. Массу кислоты в дм3 раствора находим из соотношения
300 г – 18 г.
1031 г – х г.
Молярную концентрацию раствора получим делением числа граммов Н3РO4 в 1 дм3 раствора на молярную массу Н3РО4, равную
97,99 г/моль:
CM 61,86 0,63 моль/дм3. 97,99
49

в) Молярная масса эквивалента Н3РО4 равна
Молярная концентрация эквивалента или нормальная концентрация будет равна:
г) Массу Н3РО4 в 1000 г растворителя находим из соотношения
282 г –18 г.
1000 г – х г.
Моляльную концентрацию определяем отношением массы растворенного вещества, содержащегося в 1 кг воды, на молярную массу кислоты:
Так как в 1 дм3 раствора содержится 61,86 г кислоты, титр раствора определяем как
T61,86 0,06186 г/см3. 1000
Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н. раствора щелочи. Чему равна нормальность кислоты?
Решение. Согласно закону эквивалентов
V1CН1 V2CН2 ;
50
