
2550
.pdfпрохождения электрического тока через растворы или расплавы электролитов. При электролизе электрод, соединенный с отрицательным полюсом внешнего источника постоянного тока, называется катодом (на нем идет восстановление), а электрод, соединенный с положительным полюсом источника тока, – анодом (на нем идет окисление).
Электролиз протекает в растворе или расплаве электролита. Молекулы электролита диссоциируют на ионы под влиянием полярных молекул воды или под влиянием нагрева расплава. Поэтому при погружении в электролит электродов, соединенных с источником тока, происходит направленное перемещение ионов: катионов (положительно заряженных ионов) к катоду, анионов (отрицательно заряженных ионов) – к аноду. Например, при электролизе раствора или расплава хлорида натрия NaCl ионы Na+ перемещаются к катоду, а ионы Cl– – к аноду.
Различают растворимые и нерастворимые аноды. К нерастворимым анодам относятся аноды, изготовленные из угля, графита или благородных металлов (золота, платины, палладия и т.п.). В этом случае к анодам перемещаются анионы кислотных остатков, и протекает соответствующий окислительный процесс. Например:
2Cl– – 2ē = 2Cl0 = Cl20↑;
2H2O – 4ē = 4H+ + O2↑.
К растворимым анодам относятся аноды, изготовленные из любых металлов, кроме благородных. В этом случае происходит окисление (растворение) самого анода
Ме0 – nē → Меn+.
Например, на медном аноде протекает следующий процесс
Cu0 – 2ē → Cu2+.
Cостав продуктов, полученных при электролизе определяется порядком восстановления катионов на катоде и анионов на аноде.
Катодные процессы при электролизе. Способность положительно заряженных ионов восстанавливаться на катоде определяется величиной их электродного потенциала. Чем больше
151
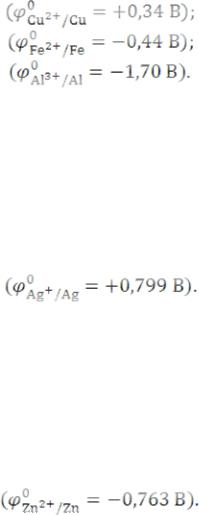
численное значение величины φ, тем легче происходит восстановление.
При электролизе расплавов на катоде сначала восстанавливаются менее активные катионы, стоящие в ряду напряжений правее. Например:
Cu2+ + 2ē → Cu0;
Fe2+ + 2ē → Fe0;
Al3+ + 3ē → Al0;
При электролизе растворов последовательность разряжения ионов на катоде следующая.
1) Катионы металлов, стоящие в ряду напряжений правее водорода и имеющие положительные значения стандартных электродных потенциалов, всегда восстанавливаются из растворов. Например:
Ag+ + ē → Ag0;
2) Если катионы металлов занимают в ряду напряжений среднее положение (от марганца до водорода), то одновременно с восстановлением катионов металлов протекает процесс восстановления молекул воды с образованием газообразного водорода и ионов ОН-. Ионы ОН- соединяются с катионами металла с образованием основания. Например:
Zn2+ + 2ē → Zn0; |
|
2H2O + 2ē → H2↑ + 2OH–; |
Zn2+ + 2OH– → Zn(ОН)2. |
Наиболее вероятно протекание 1-ого процесса – восстановления катионов металла.
3) Катионы металлов начала ряда напряжений, расположенные левее марганца, из водных растворов не восстанавливаются; их можно восстановить только из расплавов. Это связано с большим перенапряжением восстановления указанных металлов.
В водных растворах протекает восстановление молекул воды, а ионы металлов соединяются с ионами ОН-.
152

Например:
2H2O + 2ē → H2↑ + 2OH–, 2 Na+ + 2 OH– → 2 NaОН.
Продукты, образующиеся при электролизе на электродах в результате окислительно-восстановительных реакций, называются
первичными продуктами электролиза. Продукты, образующиеся в растворе у электродов в результате вторичных реакций соединения,
называются вторичными продуктами электролиза.
Вприведенных примерах вторичными продуктами электролиза являются основания Zn(ОН)2 и NaОН.
Анодные процессы при электролизе. На аноде в первую очередь окисляются отрицательно заряженные ионы, которые имеют наименьшее значение электродного потенциала.
Пользуясь рядом стандартных окислительно-восстановительных потенциалов, можно приближённо установить порядок окисления анионов на аноде.
Впервую очередь окисляются анионы бескислородных кислот (S2-, I–, Br–, Cl–, CN–), за исключением иона фтора. Например:
S2– – 2ē → S0;
Во вторую очередь окисляются молекулы воды:
2H2O – 4ē → O2↑ + 4H+;
Анионы кислородсодержащих кислот при электролизе водных растворов участвуют во вторичных процессах соединения с ионами
водорода. Например:
SО42– + 2Н+ → Н2SО4.
Анионы кислородсодержащих кислот при электролизе расплавов окисляются с образованием кислорода и соответствующего оксида.
Например:
2SО42–– 4ē → O2↑ + 2SО3; 4РО43–– 12ē → 3O2↑ + 2Р2О5; 2СО32–– 4ē → O2↑ + 2СО2.
153
В третью очередь окисляются анионы OH–:
4OH– – 4ē → O2↑ + Н2О.
Рассмотрим примеры различных случаев электролиза.
1. Электролиз раствора хлорида меди с нерастворимым анодом.
Катодный процесс (–) |
CuCl2 ↔ Cu2+ + 2Cl–: |
Анодный процесс (+) |
|
Cu2+ + 2ē → Cu0. |
2Cl– – 2ē → Cl20↑. |
2. Электролиз раствора сульфата цинка с нерастворимым анодом. ZnSO4 ↔ Zn2+ + SО42–:
Катодный процесс (–) |
Анодный процесс (+) |
Zn2+ + 2ē → Zn0; |
2H2O – 4ē → O2↑ + 4H+; |
2H2O + 2ē → H2↑ + 2OH–; |
4H+ + 2SО42– → H2SO4. |
Zn2+ + 2OH– → Zn(OH)2. |
|
В данном примере вторичными продуктами электролиза являются: образовавшаяся у анода серная кислота и у катода гидроксид цинка. Цинк и кислород, образовавшиеся на электродах, являются первичными продуктами электролиза.
3. Электролиз раствора хлорида натрия с нерастворимым анодом.
|
NaCl ↔ Na+ + Cl–: |
Катодный процесс (–) |
Анодный процесс (+) |
2H2O + 2ē → H2↑ + 2OH–; |
2Cl– – 2ē → Cl20↑. |
2Na+ + 2OH– → 2NaOH. |
|
В приведённом примере первичными продуктами электролиза являются газы – водород и хлор, вторичными - гидроксид натрия, образовавшийся у катода.
4. Электролиз раствора сульфата натрия с нерастворимым анодом.
154
Na2SO4 ↔ 2Na+ + SО42–:
Катодный процесс (–) |
Анодный процесс (+) |
2H2O + 2ē → H2↑ + 2OH–; |
2H2O – 4ē → O2↑ + 4H+; |
2Na+ + 2OH– → 2NaOH. |
4H+ + 2SО42– → H2SO4. |
В данном случае, как и при электролизе кислородсодержащих кислот и щелочей, образуется 2 первичных (водород и кислород) и 2 вторичных (щелочь и кислота) продукта.
5. Электролиз расплава хлорида натрия. |
|
NaCl ↔ Na+ + Cl–: |
|
Катодный процесс (–) |
Анодный процесс (+) |
Na+ + ē → Na0. |
2Cl– – 2ē → Cl20↑. |
В приведённом примере первичными продуктами электролиза являются газ – хлор и металл – натрий. Вторичных продуктов нет.
6. Электролиз расплава сульфата натрия.
|
Na2SO4 ↔ 2Na+ + SО42–: |
Катодный процесс (–) |
Анодный процесс (+) |
Na+ + ē → Na0. |
2SО42–– 4ē → O2↑ + 2SО3. |
В данном случае образуются 3 первичных продукта (натрий, кислород и оксид серы (VI)), вторичных продуктов нет.
7. Примером применения электролиза раствора с растворимым анодом служит рафинирование металлов, т.е. очистка их от примесей. Пример рафинирования меди с примесями Zn, Sn, Ag. Электролитом служит раствор соли меди, анодом – медь, загрязненная примесями, катодом – графит или пластинка из чистой меди. Прилагаемое из внешнего источника напряжение не превышает стандартный электродный потенциал меди ( 0,4 В).
155

CuCl2 ↔ Cu2+ + 2Cl–: |
|
|
Катодный процесс (–) |
Анодный процесс (+) |
|
Cu2+ + 2ē → Cu0. |
Zn0 |
– 2ē → Zn2+; |
|
Sn0 |
– 2ē → Sn2+; |
|
Cu0 |
– 2ē → Cu2+. |
Медь растворяется и окисляется на аноде и восстанавливается и осаждается на катоде.
Для растворения серебра величина используемого напряжения недостаточна, и поэтому оно в нейтральном состоянии остается на дне электролизера в виде рыхлого осадка (в шламе).
Методом электролиза производится покрытие одного металла другим (гальваностегия), и наносятся металлические покрытия на неметаллические полупроводниковые подложки (гальванопластика).
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г.:
1)количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2)массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Для расчета массы вещества m, выделившейся на электроде, используют математическое выражение обобщенного закона Фарадея
m mFэ I t nMF I t K I t ;
где mЭ – молярная масса эквивалента (эквивалентная масса вещества);
F– постоянная Фарадея, равная 96500 Кл/моль;. I – сила тока, А;
t – время проведения электролиза, с; М – молярная масса вещества, г/моль;
156

n – число отданных или принятых электронов; К – электрохимический эквивалент вещества.
Для расчета объема газа V, выделившегося на электроде используют видоизмененное уравнение закона Фарадея
V VFэ I t,
где Vэ – молярный объем эквивалента газа.
Практический расход тока при электролизе вследствие протекания побочных процессов (взаимодействие полученных веществ с электродом или электролитом) меньше его количества, рассчитанного согласно закону Фарадея. Следовательно, практическая масса полученных веществ отличается от теоретически рассчитанной. Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах,
называется выходом вещества по току η.
|
т(практ) |
100% |
т(практ) 96500 |
100%. |
|
т(теорет) |
m I t |
|
|||
|
|
|
э |
|
|
Примеры решениятиповых задач
Пример 1. Сколько граммов меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
Решение. Молярная масса эквивалента меди в CuSO4 равна 63,54/2 = 31,77 г/моль, время электролиза t=6060=3600с.Тогда
m 31,77 4 3600 4,74 г. 96500
Пример 2. Сколько времени надо проводить электролиз при силе тока 8 А, чтобы из раствора AgNO3 выделить 5,3935 г серебра?
Решение. Из закона Фарадея следует, что
t 5,3935 96500 603c 10 мин 3 с, 107,87 8
157

где т = 5,3935 г;
тэ(Ag) = 107,87 г/моль; I = 8 А.
Пример 3. Вычислить эквивалент металла, зная, что при электролизе раствора хлорида этого металла затрачена 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Из закона Фарадея следует, что
mЭ 11,742 96500 29,35г/моль, 3880
где It = Q = 3880 Кл.
Пример 4. На сколько граммов уменьшится масса серебряного анода, если электролиз раствора AgNO3 проводить при силе тока 2 А в течение 33 мин 20 с?
Решение. Из закона Фарадея следует, что
m 107,87 2 2000 4,47 г, 96500
где тэ(Аg) = 107,87 г/моль; I = 2 А;
t = 33 60 + 20 = 2000 с.
Пример 5. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 дм3 водорода, измеренного при нормальных условиях?
Решение. Из закона Фарадея следует, что
I V 96500.
VЭ t
Молярный объем эквивалента водорода при нормальных условиях равен 22,4/2 = 11,2 дм3.
158

I1,4 96500 2A, 11,2 6025
где 6025 с составляет 1 ч 40 мин 25 с.
Пример 6. Сколько граммов гидроксида калия образовалось у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 дм3 кислорода, измеренного при н.у.?
Решение. Молярный объем эквивалента кислорода (н.у.) 22,4/4 = 5,6 дм3. Следовательно, 11,2 дм3 занимают 2 эквивалента кислорода. Столько же, т.е. 2 эквивалента, КОН образовалось у катода или 56,11·2 = 112,22 г (56,11 г – тэ(КОН)).
Задачи для самостоятельного решения
12-1. Электролиз раствора К2SО4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах, вычислите объем выделяющихся на электродах газов.
Ответ: 6,266 дм3; 3,133 дм3.
12-2. Составьте уравнения процессов, происходящих на электродах при электролизе растворов А1С13, NiSO4. В обоих случаях анод угольный.
12-3. При электролизе раствора CuSO4 на аноде выделилось 168 см3 кислорода, измеренного при н.у. Сколько граммов меди выделилось на катоде?
Ответ: 0,953 г.
12-4. Сколько граммов воды разложилось при электролизе раствора Na2SO4 при силе тока 7 А в течение 5 ч?
Ответ: 11,75 г.
12-5. Электролиз раствора нитрата серебра проводили при силе тока 2А в течение 4 ч. Сколько граммов серебра выделилось на катоде?
Ответ: 32,20 г.
12-6. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите молярную массу эквивалента металла.
159
Ответ: 32,7 г/моль.
12-7. Составьте уравнения процессов, происходящих на электродах при электролизе раствора КОН, расплава КОН.
12-8. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 дм3 кислорода, измеренного при н.у. Вычислите силу тока.
Ответ: 5,74 А.
12-9. Составьте уравнения процессов, проходящих на электродах при электролизе раствора A12(SO4)3 в случае угольного анода; в случае алюминиевого анода.
12-10. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора NaI в течение 2,5 ч, если сила тока равна 6 А?
Ответ: 0,56 г; 71,0 г.
12-11. При электролизе раствора AgNO3 масса серебряного анода уменьшилась на 5,4 г. Сколько кулонов электричества израсходовано на этот процесс?
Ответ: 4830 Кл.
12-12. Какие вещества и в каком количестве выделяются на угольных электродах при электролизе раствора КВr в течение 1 ч 35 мин при силе тока 15 А?
Ответ: 0,886 г; 70,79 г.
12-13. Составьте уравнения процессов, происходящих при электролизе СuС12, если анод медный; если анод угольный.
12-14. На электролиз раствора СаС12 израсходовано 10722,2 Кл электричества. Вычислите объемы газов, выделяющиеся на угольных электродах.
Ответ: 1,24 дм3.
12-15. Составьте уравнения процессов, происходящих на электродах при электролизе раствора КСl, расплава КСl.
12-16. Сколько времени проводят электролиз раствора электролита при силе тока 5 А, если на катоде выделяется 0,1 эквивалент вещества? Сколько выделится вещества на аноде?
Ответ: 32 мин 10 с.
12-17. При электролизе растворов MgSO4 и ZnCl2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Сколько граммов вещества выделится на другом катоде; на анодах?
Ответ: 8,17 г; 2,0 г; 8,86 г.
160
