
2550
.pdfОпределим изменение металлических свойств элементов в главных и побочных подгруппах периодической системы с увеличением заряда ядра атома элемента. Главные подгруппы в группах периодической системы образуют s- и p-элементы, а побочные – d-элементы.
Вглавных подгруппах с увеличением заряда ядра атома элемента увеличивается радиус атома элемента, так как в этом направлении возрастает число электронных слоев в атоме элемента. Поэтому в главной подгруппе сверху вниз нарастают металлические (восстановительные) свойства элементов.
Впобочных подгруппах при переходе от первого элемента ко второму происходит увеличение радиуса атома элемента, а при переходе от второго элемента к третьему даже некоторое уменьшение. Это объясняется f-лантаноидным сжатием. Поэтому в побочных подгруппах с увеличением заряда ядра уменьшаются металлические свойства (за исключением побочной подгруппы третьей группы). Поэтому в пределах одной группы свойства элементов главной и побочных подгрупп различны. Различия в свойствах элементов главных и побочных подгрупп значительны для первой группы, затем оно ослабевает. Так, элементы главной и побочной подгрупп третьей группы сравнительно близки по свойствам. Затем это различие в свойствах вновь усиливается и делается очень существенным в седьмой группе, где элементы подгруппы марганца сильно отличаются от галогенов.
Примеры решениятиповых задач
Пример 1. Атомы элементов имеют следующее строение наружного и предпоследнего электронных слоев:
а) 2s22p63s23p1; б) 3s23p63d34s2; в) 4s24p64d105s0.
Определите эти элементы.
Решение. В случае а) имеем дело с незаполненным р-подуровнем 3-го энергетического уровня, причем этот подуровень содержит один электрон и соответствует первому р-элементу 3-го энергетического уровня. Это 13Al. Его полная электронная формула 1s22s22p63s23p1.
21
Случай б) соответствует незаполненному d-подуровню 3-го энергетического уровня. Поскольку наружный слой содержит максимальное число s-электронов (4s2), то с учетом 3-х электронов на незаполненном 3d-подуровне это соответствует 3-му по счету
d-элементу 4-го периода, то есть 23V. Его полная электронная формула 1s22s22p63s23p63d34s2.
Случай в) соответствует полностью заполненному 4d-подуровню (10 электронов), однако внешний 5s-подуровень пуст. Это означает, что произошел провал 2-х электронов с 5s- на 4d-подуровень, что соответствует восьмому по счету d-элементу (10 – 2 = 8) в пятом
периоде. Этот элемент 46Pd. Его полная электронная формула:
1s22s22p63s23p63d104s24p64d105s0.
Пример 2. Определите силы кислот в ряду HOCl → HOBr → HOI, а также изменение окислительных свойств этих кислот.
Решение. Свойством, определяющим силу кислот указанного ряда, является электроотрицательность атомов галогенов. Чем больше электроотрицательность галогена, тем в большей степени стабилизирован анион кислоты (О–Hal)– и поляризация связи Н–О, отвечающая за отдачу протона, т.е. кислотные свойства. Поскольку электроотрицательность атомов галогенов уменьшается в ряду Cl > Br > I (табл. П.3), то кислотность кислот изменяется аналогично: HOCl > HOBr > HOI. В основе окислительных свойств H(OHal) лежит также электроотрицательность, поскольку акту принятия электронов способствует способность атома притягивать электроны. Поэтому окислительные свойства этих кислот также уменьшаются в ряду
HOCl > HOBr > HOI.
Пример 3. Определите изменение основных свойств и растворимости в воде гидроксидов щелочных металлов в ряду LiOH → CsOH.
Решение. Основность гидроксидов – способность их к отщеплению гидроксид-аниона. Чем прочнее этот анион связан с катионом металла, тем меньшую основность проявляет гидроксид. Поскольку в ряду LiOH → CsOH радиус катиона увеличивается, расстояние между центрами зарядов катиона металла и гидроксиданиона (кулоновский радиус) также увеличивается. Это приводит к ослаблению сил кулоновского притяжения между разноименно
22
заряженными частицами и увеличению способности гидроксида к отщеплению. Поэтому в ряду LiOH → CsOH основность возрастает.
В то же время с увеличением кулоновского радиуса возрастает степень поляризации ионной пары «катион металла – гидроксиданион», а следовательно, способность этой пары к гидратации и последующей диссоциации. Это приводит к увеличению растворимости гидроксидов в ряду LiOH → CsOH.
Задачи для самостоятельного решения
2-1. Структура валентного электронного слоя атомов некоторых элементов выражается формулой: a) 5s25р4; б) 4s13d5. Определите порядковый номер и название этих элементов. Охарактеризуйте свойства их оксидов и гидроксидов. По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) охарактеризуйте окислительно-восстановительные свойства этих элементов.
2-2. Напишите электронные формулы атомов элементов с порядковыми номерами 15 и 41. Сколько неспаренных электронов у атомов первого элемента и сколько свободных d-орбиталей у атомов последнего элемента? По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) определите наиболее активными металлическими или неметаллическими свойствами обладают элементы.
2-3. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 27. Чему равен максимальный спин р- электронов у атомов первого и d-электронов у атомов второго элемента? По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) определите наиболее активными металлическими или неметаллическими свойствами обладают элементы.
2-4. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит провал одного 5s-электрона на 4d - подуровень. К какому электронному семейству относится каждый из этих элементов и какие электроны их атомов являются валентными? По значениям величин потенциала
23
ионизации (табл. П.3) определите элемент, который проявляет наиболее активные металлические свойства.
2-5. Составьте электронные формулы атомов элементов с порядковыми номерами 8 и 26. К какому электронному семейству относится каждый из этих элементов и какие электроны их атомов являются валентными?По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) определите, который элемент проявляет наиболее активные металлические, а какой – неметаллические свойства.
2-6. Напишите электронные формулы атомов элементов с порядковыми номерами 34 и 42, учитывая, что у второго происходит «провал» одного 5s-электрона на 4d-подуровень. Чему равен максимальный спин d-электронов у атомов второго и р-электронов у атомов первого элемента? По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) определите, который элемент проявляет наиболее активные металлические, а какой – неметаллические свойства.
2-7. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) постройте элементы в ряды по увеличению металлических и неметаллических свойств. Напишите уравнения реакций, доказывающих амфотерный характер гидроксида алюминия.
2-8. Составьте формулы соединений алюминия с хлором, серой, азотом и углеродом в низшей степени окисления. Назовите соответствующие соединения. По значениям величин энергии сродства к электрону (табл. П.3) постройте элементы в ряд по увеличению их неметаллических свойств.
2-9. Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой их степени окисления. Как называются соответствующие соединения? По значениям величин энергии сродства к электрону (табл. П.3) постройте элементы в ряд по увеличению их неметаллических свойств.
2-10. Исходя из положения германия, цезия и технеция в периодической системе составьте формулы следующих соединений: мета- и ортогерманиевой кислот, дигидрофосфата цезия и оксида технеция, отвечающего их высшей степени окисления. Изобразите
24
графически формулы этих соединений. По значениям величин потенциала ионизации (табл. П.3) постройте элементы в ряды по увеличению их металлических свойств.
2-11. Исходя из положения германия, молибдена и рения в периодической системе составьте формулы следующих соединений: водородного соединения германия, рениевой кислоты и оксида молибдена, отвечающего их высшей степени окисления. Изобразите графически формулы этих соединений. По значениям величин потенциала ионизации (табл. П.3) постройте элементы в ряды по увеличению их металлических свойств.
2-12. Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте исходя из строения атомов данных элементов.
2-13. Какие элементы образуют газообразные соединения с водородом? В каких группах периодической системы находятся эти элементы? Составьте формулы водородных и кислородных соединений хлора, теллура и сурьмы, отвечающих их низшей и высшей степеням окисления. По значениям величин энергии сродства к электрону (табл. П.3) постройте элементы в ряд по увеличению их неметаллических свойств.
2-14. Напишите электронные и электронно-графические формулы атомов Сr и Se. Определите, у какого элемента сильнее выражены металлические свойства. Какой из этих элементов образует газообразное соединение с водородом?
2-15. У какого из р-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какой из водородных соединений данных элементов является более сильным восстановителем? Ответ мотивируйте строением атома этих элементов и значениями энергий сродства к электрону(табл. П.3).
2-16. Напишите электронные и электронно-графические формулы атомов Ва, Мg, Са, Fе, Сd и Sr. По значениям величин потенциала ионизации (табл. П.3) постройте элементы в ряды по увеличению их металлических свойств. Исходя из положения металла в периодической системе определите, какой из двух гидроксидов более сильное основание: Ва(ОН)2 или Мg(ОН)2; Са(ОН)2 или Fе(ОН)2; Сd(ОН)2 или Sr(ОН)2. Ответ мотивируйте.
25
2-17. Определите, почему марганец проявляет металлические свойства, а хлор – неметаллические. Напишите электронные и электронно-графические формулы атомов этих элементов. Ответ мотивируйте строением их атомов. Напишите формулы оксидов и гидроксидов хлора и марганца.
2-18. Какую низшую и высшую степень окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. По значениям величин энергии сродства к электрону (табл. П.3) постройте элементы в ряд по увеличению их неметаллических свойств.
2-19. К какому семейству относятся элементы, в атомах которых последний электрон поступает на 4f - и на 5f - орбитали? Приведите примеры соответствующих элементов. Напишите электронные и электронно-графические формулы их атомов, укажите валентные электроны.
2-20. На основании современной формулировки периодического закона объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя и имеют большую атомную массу? Напишите электронные и электронно-графические формулы этих атомов, укажите валентные электроны. По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) постройте данные элементы в ряды по увеличению их металлических и неметаллических свойств.
2-21. Напишите электронные и электронно-графические формулы атомов углерода, фосфора, серы и йода. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите низшую и высшую степени окисления, которые они проявляют. Составьте формулы и назовите соединения данных элементов, отвечающих этим степеням окисления. По значениям величин энергии сродства к электрону (табл. П.3) постройте элементы в ряд по увеличению их неметаллических свойств.
2-22. Напишите электронные и электронно-графические формулы атомов германия, ванадия, марганца и ксенона. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите высшую степень окисления, которую они проявляют. Составьте формулы оксидов данных элементов,
26
отвечающих этой степени окисления. По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) постройте данные элементы в ряды по увеличению их металлических и неметаллических свойств.
2-23. Напишите электронные и электронно-графические формулы атомов углерода, мышьяка и марганца. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите высшую и низшую степени окисления, которые они могут проявлять. Составьте формулы и назовите соединения данных элементов, отвечающих этим степеням окисления. По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) постройте данные элементы в ряды по увеличению их металлических и неметаллических свойств.
2-24. Напишите электронные и электронно-графические формулы атомов азота, серы и кислорода. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите высшую и низшую степени окисления, которую они могут проявлять. Составьте формулы и назовите соединения данных элементов, отвечающих этим степеням окисления. На основании величин энергии сродства к электрону (табл. П.3) постройте элементы в ряд по увеличению их неметаллических свойств.
2-25. Напишите электронные и электронно-графические формулы атомов хлора, фосфора, хрома. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите высшую и низшую степени окисления, которые они могут проявлять. Составьте формулы и назовите соединения данных элементов, отвечающих этим степеням окисления. По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) постройте данные элементы в ряды по увеличению их металлических и неметаллических свойств.
2-26. Напишите электронные и электронно-графические формулы атомов мышьяка, селена, брома. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите высшую и низшую степени окисления, которые они могут проявлять. Составьте формулы и назовите соединения данных элементов, отвечающих этим степеням окисления. На основании величин энергии сродства к электрону (табл. П.3)
27
постройте элементы в ряд по увеличению их неметаллических свойств.
2-27. Напишите электронные и электронно-графические формулы атомов фосфора, хрома, марганца. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите высшую и низшую степени окисления, которые они могут проявлять. Составьте формулы и назовите соединения данных элементов, отвечающих этим степеням окисления. По значениям величин потенциала ионизации и энергии сродства к электрону (табл. П.3) постройте данные элементы в ряды по увеличению их металлических и неметаллических свойств.
2-28. Напишите электронные и электронно-графические формулы атомов углерода, азота, йода. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите высшую и низшую степени окисления, которые они могут проявлять. Составьте формулы и назовите соединения данных элементов, отвечающих этим степеням окисления. На основании величин энергии сродства к электрону (табл. П.3) постройте элементы в ряд по увеличению их неметаллических свойств.
2-29. Напишите электронные и электронно-графические формулы атомов серы, хлора, мышьяка. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите высшую и низшую степени окисления, которые они могут проявлять. Составьте формулы и назовите соединения данных элементов, отвечающих этим степеням окисления. На основании величин энергии сродства к электрону (табл. П.3) постройте элементы в ряд по увеличению их неметаллических свойств.
2-30. Напишите электронные и электронно-графические формулы атомов кремния, мышьяка, селена. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите высшую и низшую степени окисления, которые они могут проявлять. Составьте формулы и назовите соединения данных элементов, отвечающих этим степеням окисления. На основании величин энергии сродства к электрону (табл. П.3) постройте элементы в ряд по увеличению их неметаллических свойств.
28

2-31. Напишите электронные и электронно-графические формулы атомов кремния, теллура, брома. Укажите валентные электроны, а также электронное семейство каждого элемента. Определите высшую и низшую степени окисления, которые они могут проявлять. Составьте формулы и назовите соединения данных элементов, отвечающих этим степеням окисления. На основании величин энергии сродства к электрону (табл. П.3) постройте элементы в ряд по увеличению их неметаллических свойств.
Тестовые задания
Т2-1. Число нейтронов в ядре атома 


 равно а) 49; б) 66; в) 164; г) 115.
равно а) 49; б) 66; в) 164; г) 115.
Т2-2. Ядро атома состоит из а) протонов и нейтронов; б) нейтронов и электронов; в) протонов и электронов;
г) протонов, электронов и нейтронов. Т2-3. Нейтрон – это
а) положительно заряженная частица, имеющая массу, равную массе протона;
б) нейтральная частица; в) отрицательно заряженная частица;
г) положительная частица, имеющая массу, не равную массе протона.
Т2-4. Число протонов в атоме 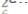


 а) 64; б) 35; в) 93; г) 29.
а) 64; б) 35; в) 93; г) 29.
Т2-5. Количество электронов в атоме равно числу а) протонов; б) нейтронов; в) уровней;
г) атомной массе.
29
Т2-6. Атомы С и Si имеют одинаковое число а) нейтронов в ядре; б) энергетических уровней; в) электронов;
г) электронов на внешнем энергетическом уровне. Т2-7. К s -элементам относится
а) Al;
б) Be;
в) C;
г) B.
Т2-8. Электронную конфигурацию 1s22s22p63s23p64s2 имеет элемент а) Ba;
б) Mg;
в) Ca;
г) Sr.
Т2-9. Число неспаренных электронов в атоме алюминия в основном состоянии равно
а) 1; б) 2; в) 3; г) 0.
Т2-10. Ядра атомов изотопов различаются числом а) протонов; б) протонов и нейтронов; в) нейтронов;
г) протонов и электронов.
Т2-11. В главной подгруппе находится а) Sc;
б) Hf;
в) As;
г) Tc.
Т2-12. Неметаллом является а) Rb;
б) Kr;
в) In;
г) Sn.
Т2-13. Mеталлические свойства возрастают в ряду а) Tl–In–Al;
б) Be–B–C;
30
