
- •Содержание
- •1. Лабораторная работа по теме гальванические элементы
- •2) Cr в 0,006 моль/л Cr2(so4)3.
- •2) Al в 0,03 моль/л Al 2(so4)3 .
- •2) Cu в 0,0002 моль/л CuSo4.
- •1) Mn в 0,002 моль/л МnCl2;
- •2) Аg в 0,001 моль/л AgNo3.
- •2. Лабораторная работа по теме «Коррозия металлов и защита от коррозии»
- •3. Лабораторная работа по теме «Электролиз»
- •Задание
- •Задание.
- •Задание.
- •Задание.
- •4. Лабораторная работа по теме «Взаимодействие металлов с водой, водными растворами кислот и щелочей»
- •5. Лабораторная работа окислительно-восстановительных реакций
- •Лабораторная работа 6 по теме «Химические эквиваленты веществ» Опыт 1. Приготовление раствора соляной кислоты заданной нормальности из более концентрированного раствора
- •Опыт 2. Определение молярной концентрации эквивалента, приготовленного раствора соляной кислоты методом титрования
- •Опыт 3. Экспериментальная проверка закона эквивалентов – определение массы металла (навески) и молярной массы эквивалента (или эквивалентной массы) металла методом вытеснения водорода
- •7. Лабораторная работа химическая кинетика и равновесие
- •Индивидуальные задачи
- •7. Индивидуальные задания по теме «Строение атома»
- •8. Лабораторная работа по теме «Химическая связь»
- •Индивидуальные задания
- •9. Лабораторная работа по теме «Растворы электролитов»
- •10. Лабораторная работа по теме «Неорганические вяжущие вещества»
- •11. Лабораторная работа «Химия элементов»
- •Опыт 1.Алюминий. Пассивация алюминия.
- •Опыт 5. Кремний. Кремниевая кислота и ее свойства. Получение геля и золя кремниевой кислоты.
- •Опыт 7. Свинец. Свойства свинца.
- •Опыт 9. Элементы побочных подгрупп. Железо. Свойства железа.
- •Опыт 19. Различие между двойными и комплексными солями
- •Опыт 20. Получение комплексной соли никеля. Молекулярное и ионное уравнения
- •Опыт 21. Нестойкость комплексных ионов
3. Лабораторная работа по теме «Электролиз»
Опыт 1. Электролиз раствора сульфата натрия.
Прибор соберите по схеме, как показано на рис.17. Зарисуйте его. Бюретки и U – образная трубка должны быть собраны герметично. Герметичность системы проверьте путем поднятия или опускания одной из бюреток. Если при этом уровень жидкости остается стабильно на одном уровне, то прибор герметичен.
В начале опыта зафиксируйте в журнале: начало опыта и начальный уровень жидкости в бюретках 1 и 5. Электролиз проводите в течение 3 –10 минут до получения 5 – 100 мл газа в одной из бюреток. Затем выключите выпрямитель. Запишите конец опыта. Определите точный объем выделившихся газов в бюретках 1 и 5 и заметьте изменение цвета индикатора. Для определения точного объема выделившихся газов в спаренных бюретках столбики жидкости приведите к одинаковому уровню и по разности уровней жидкости до и после опыта (h0 и hk ) определите объемы газов в электродных зонах V = hk - h0 (для упрощения расчета объем выделившихся газов не приводите к нормальным условиям).

Рис.17. Прибор для количественного определения выделяющихся веществ в реакционных зонах при электролизе раствора сульфата натрия: 1 и 5 – бюретки спаренные; 2 - U-образная трубка; 3 – раствор сульфата натрия и 3 – 4 капли метилового оранжевого; 4 – графитовые электроды; 6 – выпрямитель.
Запишите электродные процессы. Объясните изменение окраски индикатора.
Вычислите по объему выделившегося газа массу вещества, разложившегося при электролизе. Рассчитайте Еразл. Составьте ЭХС внутреннего гальванического элемента, который образуется в процессе электролиза.
Необходимо учесть, что раствор метиловый оранжевый имеет цвет: а) в кислой среде – красный; б) в нейтральной – оранжевый; в) в щелочной – бледно-желтый.
Задание
1.Объясните, с какой целью при промышленном электролизе воды в нее вводят электролиты: H2SO4, Na2SO4, NaOH? Какой электролит наиболее целесообразен? Ответ обоснуйте.
2 .Запишите катодные и анодные реакции при электролизе растворов: H2SO4, Na2SO4, NaOH. Рассчитайте соответствующие электродные потенциалы, принимая pH растворов равным соответственно 0; 7; 14.
3. Изобразите графически зависимость равновесных потенциалов катода и анода от pH раствора.
4. Подтвердите расчетом независимость напряжения разложения воды от состава раствора. Отметьте, как это проявляется на графике. Дайте объяснение?
Опыт 2 Электролиз раствором иодида калия.
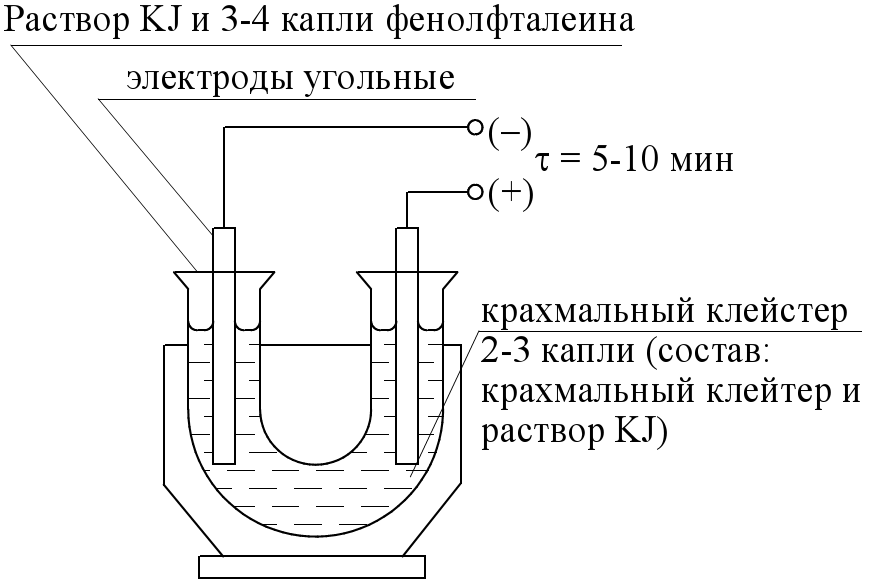
Результаты наблюдения:
Окраска растворов.
Характер реакции.
Уравнения реакций (электродные процессы).
Вычислите Еразл.
Составьте ЭХО работы внутреннего гальваноэлемента.
Задание.
Можно ли электролизом водного раствора фторида калия получить фтор? Ответ обоснуйте.
Опыт 3. Электролиз раствора хлорида меди (или сульфата меди), (рис.18.).
Результаты наблюдения:
Что наблюдается в реакционных зонах
на поверхности электрода – катода?
Дайте объяснения.
Составьте уравнения реакций.
Вычислите Еразл.
Составьте ЭХС внутреннего гальваноэлемента, который образуется в процессе электролиза.
