
- •Содержание
- •1. Лабораторная работа по теме гальванические элементы
- •2) Cr в 0,006 моль/л Cr2(so4)3.
- •2) Al в 0,03 моль/л Al 2(so4)3 .
- •2) Cu в 0,0002 моль/л CuSo4.
- •1) Mn в 0,002 моль/л МnCl2;
- •2) Аg в 0,001 моль/л AgNo3.
- •2. Лабораторная работа по теме «Коррозия металлов и защита от коррозии»
- •3. Лабораторная работа по теме «Электролиз»
- •Задание
- •Задание.
- •Задание.
- •Задание.
- •4. Лабораторная работа по теме «Взаимодействие металлов с водой, водными растворами кислот и щелочей»
- •5. Лабораторная работа окислительно-восстановительных реакций
- •Лабораторная работа 6 по теме «Химические эквиваленты веществ» Опыт 1. Приготовление раствора соляной кислоты заданной нормальности из более концентрированного раствора
- •Опыт 2. Определение молярной концентрации эквивалента, приготовленного раствора соляной кислоты методом титрования
- •Опыт 3. Экспериментальная проверка закона эквивалентов – определение массы металла (навески) и молярной массы эквивалента (или эквивалентной массы) металла методом вытеснения водорода
- •7. Лабораторная работа химическая кинетика и равновесие
- •Индивидуальные задачи
- •7. Индивидуальные задания по теме «Строение атома»
- •8. Лабораторная работа по теме «Химическая связь»
- •Индивидуальные задания
- •9. Лабораторная работа по теме «Растворы электролитов»
- •10. Лабораторная работа по теме «Неорганические вяжущие вещества»
- •11. Лабораторная работа «Химия элементов»
- •Опыт 1.Алюминий. Пассивация алюминия.
- •Опыт 5. Кремний. Кремниевая кислота и ее свойства. Получение геля и золя кремниевой кислоты.
- •Опыт 7. Свинец. Свойства свинца.
- •Опыт 9. Элементы побочных подгрупп. Железо. Свойства железа.
- •Опыт 19. Различие между двойными и комплексными солями
- •Опыт 20. Получение комплексной соли никеля. Молекулярное и ионное уравнения
- •Опыт 21. Нестойкость комплексных ионов
Содержание
1. Лабораторная работа по теме гальванические элементы
Опыт 1. Гальванический элемент с деполяризатором – катионом металла.
По заданию преподавателя из перечисленных электродов составьте элемент:
Zn2+│Zn, Сu2+│Сu, Ni2+│Ni, Cd2+│Cd.
Найдите по табл. 3 стандартные потенциалы электродов и запишите схему элемента, уравнения электродных процессов и токообразующей реакции. Покажите ход электронов во внешней цепи, а ионов - во внутренней. Вычислите ЭДС. Соберите элемент. Для этого в батарейный стакан 1 (рис. 4) вставьте пористый стакан 2. Во внутренний стакан и наружный поместите по одной выбранной металлической пластинке и залейте 1M растворами соответствующих сернокислых солей. Присоедините пластинки к вольтметру с большим внутренним сопротивлением и через 5 мин после замыкания цепи измерьте напряжение. Сделайте вывод, является ли исследуемый элемент практически поляризующимся.
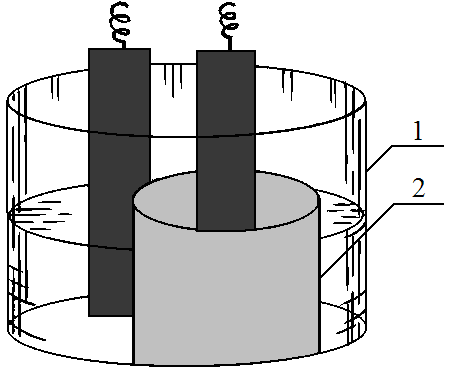
Рис. 4 Медно-цинковый элемент.
Опыт 2. Определение природы газового электрода в элементе.
В U - образную трубку налейте 3%-ый раствор хлорида натрия.
Электроды - железный гвоздь и графитовый стержень - тщательно зачистите наждачной бумагой, промойте под краном проточной водой и погрузите в раствор. Замкните внешнюю цепь через вольтметр и наблюдайте работу элемента: наличие тока в цепи и его направление. Выключите вольтметр и замкните внешнюю цепь накоротко. Зарисуйте прибор и запишите наблюдения.
Определите, с какой деполяризацией (водородной или кислородной) работает элемент. Для этого, пользуясь значениями электродных потенциалов железа (в 3%-ом растворе NaCl ЕСР = - 0,42), водородного и кислородного электродов в данной среде с учетом материала подкладки, запишите анодный и катодный процессы, уравнение токообразующей реакции и составьте схему работы элемента. (Прежде чем приступить к вычислению электродных потенциалов газовых электродов, определите, какое значение рН имеет водный раствор NaCl. Почему?).
Убедитесь в наличии ионов железа, добавив в U - образную трубку 2-3 капли красной кровяной соли К3[Fe(CN)6], a наличие ионов ОН- проверьте, добавив 2-3 капли фенолфталеина. Отметьте изменение цвета. Дайте объяснение. Напишите ионное уравнение взаимодействия красной кровяной соли с ионами железа.
Опыт 3. Поляризация при работе элемента и деполяризация.
В проделанном опыте 2 снова включите вольтметр в цепь (не встряхивая электродов! Почему?). Наблюдайте уменьшение напряжения. Объясните наблюдаемое явление поляризации: почему и как меняется электродный потенциал катода (анода)? Какой электрод поляризуется в меньшей степени? Почему? Не размыкая внешней цепи элемента, добавьте в катодное пространство несколько капель раствора перекиси водорода. Наблюдайте и запишите изменение напряжения. Объясните процесс деполяризации в катодной зоне и роль перекиси водорода в этом процессе.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ К САМОСТОЯТЕЛЬНОЙ РАБОТЕ.
Вариант 1. 1.Вычислите потенциал электрода, на котором установилось равновесие Cl2↑ + 2ē ↔ 2Cl- при [Cl-]= 1 моль/л, РCl2=1. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве анода? Как при этом изменится значение равновесного потенциала?
Условная схема электрода - Сu2+│Сu. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода имеет стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Вычислите ЭДС этого элемента.
Сравните окислительную способность кислородного электрода в стандартных условиях (в кислой среде) и в нейтральной среде при РО2 = 1. Составьте схему элемента из указанных электродов. Вычислите ЭДС. Как называется такой элемент, долго ли он будет работать?
4. Укажите химические реакции, которые можно использовать для организации гальванического элемента:
СuО + 2HCl → CuCl2 + H2O;
Ni + CuSO4 → NiSO4 + Cu;
H2S + NaOH → Na2S + H2O;
SnCl2 + FeCl3 → SnCl4 + FeCl2.
При использовании какой реакции ожидается максимальная ЭДС?
5. Составьте схему, напишите уравнения электродных процессов к токообразующей реакции, вычислите ЭДС элемента, составленного из электродов:
1) Аl в 0,006 н Аl2(SO4)3;
2) Pt в H2SО4 при pH = 3, РН2 = 1
Укажите виды поляризации этих электродов. Как поляризация сказывается на работе гальванического элемента?
Вариант 2. 1. Вычислите потенциал электрода, на котором установилось равновесие Со2+ +2ē ↔ Со при [Со2+] =10-3моль/л. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве катода? Как при этом изменится значение равновесного электродного потенциала?
Условная схема электрода – Fe2+, Fe3+│Pt. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода имеет стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС?
Сравните восстановительную активность алюминиевого электрода в кислой и щелочной среде при стандартных условиях. Составьте схему элемента из указанных электродов. Вычислите ЭДС. Как называется такой элемент? Долго ли он будет работать?
Укажите химические реакции, которые можно использовать для организации гальванического элемента:
Ni + 2HCl → NiCl2 + H2;
MgO + 2HCl → MgCl2 + H2O;
Fe(OН)2 + 2HCl → FeCl2 + 2H2O;
Cd+ CuCl2 → CdCl2 + Cu.
При использовании какой реакции ожидается максимальное значение ЭДС?
5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов:
1) Pt в 0,005 моль/л Ва(OН)2 при РO2=1;
2) Рt в 0,05 М MgCl2 при РCl2=1.
Укажите виды поляризации этих электродов. Как поляризация скажется на работе гальванического элемента?
Вариант 3. 1. Вычислите потенциал электрода, на котором установилось равновесие
O2 + 4Н++4ē ↔ 2Н2О при рН=4, РO2 = 1. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве анода? Как при этом изменится значение равновесного потенциала?
2. Условная схема электрода – Мn2+│Мn. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода будет иметь стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал укапанного электрода. Чему равна его ЭДС?
3. Сравните восстановительную активность цинкового электрода в щелочной и кислой среде при стандартных условиях. Составьте схему элемента из указанных электродов. Вычислите ЭДС. Как называется такой элемент?
4. Укажите химические реакции, которые можно использовать для организации гальванического элемента:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl;
SО3 + H2O → H2SО4;
Na2CO3 + 2HCl → 2NaCl +CO2 + H2O;
H2 + Cl2 →2HCl.
При использовании какой реакции ожидается максимальная ЭДС?
5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов:
1)Cd в 0,01 моль/л CdCl2, α = 60%;
2)Pt в 0,1М NaOH при РH2=1.
Укажите виды поляризации этих электродов. Как поляризация отражается на работе гальванического элемента?
Вариант 4. 1. Вычислите потенциал электрода, на котором установилось равновесие
Ni2++2ē ↔ Ni при [Ni] = 10-4моль/л. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве анода? Как при этом изменится величина равновесного потенциала?
2. Условная схема электрода – Cl-│Cl2, Pt. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода будет иметь стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС?
3. Пользуясь формулой Нернста для водородного электрода, покажите, как изменяется его окислительная активность с изменением рН среды от 6 до 13. Составьте схему элемента из указанных электродов. Вычислите ЭДС. Как называется такой элемент? Долго ли он будет работать?
4. Укажите химические реакции, которые можно использовать для организации гальванического элемента:
BaCl2 + H2SО4 → BaSO4 + 2HCl;
Н2 + О2 → 2Н2O ;
CО2 + H2O → H2CО3;
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag.
При использовании какой реакции ожидается максимальная ЭДС?
5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов:
Pt в 0,01М NaOH, РН2=1;
