
- •6.3. Включение в обмен веществ и функции элементов минерального питания
- •6.3.1. Фосфор 6.3.1.1. Характерные особенности фосфорного питания
- •6.3.1.2. Основные типы фосфорсодержащих соединений
- •6.3.1.3. Транспорт фосфата через мембраны
- •6.3.1.4. Метаболизм фосфата
- •6.3.1.5. Ответные реакции растительного организма на дефицит фосфата
- •6.3.2. Азот
- •6.3.2.1. Формы азота, используемые растением
- •6.3.2.2. Поглощение и усвоение нитрата
- •6.3.2.3. Поглощение и ассимиляция аммония
- •6.3.2.4. Интеграция азотного метаболизма на уровне целого растения
- •6.3.3. Сера
- •6.3.3.1. Серосодержащие органические соединения
- •6.3.3.2. Поглощение и транспорт сульфата
- •6.3.3.3. Ассимиляторное восстановление сульфата
- •6.3.3.4. Глутатион и его производные
- •6.3.4. Кальций
- •6.3.4.2. Системы транспорта кальция
- •6.3.5. Калий
- •6.3.5.1. Системы транспорта к и их характеристика
- •6.3.5.2. Регуляция мембранного потенциала
- •6.3.5.3. Регуляция активности ферментов и синтез белка
- •6.3.5.4. Осморегуляция и катионно-анионный баланс
- •6.3.6. Движения устьиц: транспорт ионов и регуляция
- •6.3.6.1. Открывание устьиц
- •6.3.6.2. Закрывание устьиц
- •6.3.7. Хлор
- •6.3.8. Магний
- •6.3.9. Железо
- •6.3.10. Медь
- •6.3.11. Марганец
- •6.3.12. Молибден
- •6.3.13. Цинк
6.3.2.4. Интеграция азотного метаболизма на уровне целого растения
С и N — два главных конструктивных элемента, обеспечивающих рост и развитие растений. Фиксация СО2 за счет световой энергии происходит исключительно в хлоропластах. Усвоение минерального азота — процесс «делокализованный». Весь поглощаемый аммоний и часть нитрата превращается в азот органических соединений в корнях, но энергией и органическими субстратами ассимиляцию N обеспечивает фотосинтез в виде притока Сахаров по флоэме. Азотный обмен на основе продуктов фотосинтеза составляет наиболее развитую сторону метаболизма корней: здесь синтезируются аминокислоты и амиды, уреиды, никотин, нуклеиновые кислоты, цитокинины и другие азотсодержащие органические соединения.
Нитрат ассимилируется как в корнях, так и в листьях. При усвоении в листьях только первая реакция восстановления нитрата до нитрита локализована в цитозоле. Азот нитрита включается в состав аминокислот и амидов в строме хлоропластов и обеспечивается энергией за счет световых реакций фотосинтеза. Общая субклеточная компартментация азотного и углеродного метаболизма на уровне хлоропласта ставит в первую очередь вопрос о распределении энергоресурсов между обменом С и N в хлоропласте.
После ассимиляции СО2 восстановление и включение азота нитрита в состав аминокислот — наиболее значимый энергопотребляемый процесс в хлоропласте. Редукция 1 моль СО2 до уровня восстановленности Сахаров требует приблизительно 4е или 8 квантов света (2 моль НАДФН и 3 моль АТФ) (рис. 6.47).
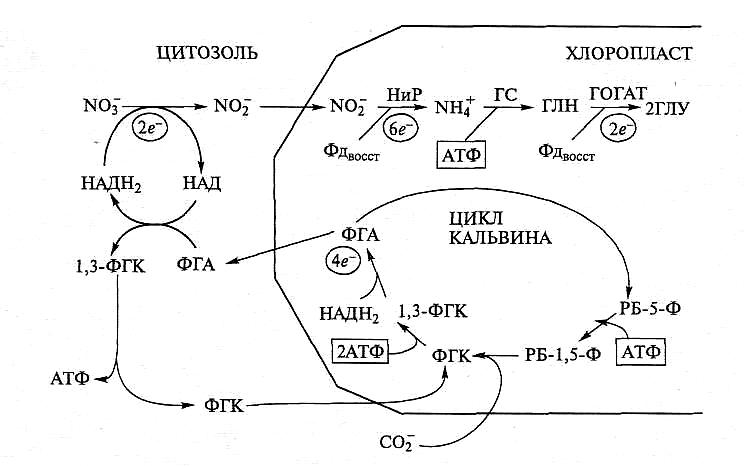
Рис. 6.47. Распределение восстановительных и энергетических эквивалентов фотосинтеза на ассимиляцию одного моля углекислоты и нитрата. Пояснения в тексте
Для превращения NO в NH с использованием восстановленного Фд в хлоропласте требуется 6е (12 квантов) и еще 2е (4 кванта) требуется для превращения Глу—NH2 в Глу. Дополнительно к этому 1 моль АТФ нужен для синтеза Глу—NH2. Если принять во внимание, что нитрат в цитозоле может быть восстановлен также за счет энергии фотосинтеза в виде челночного выноса и превращения триоз в цитозоле, общий расход будет больше на 2е , или 4 кванта. Таким образом, на усвоение нитрата в фотосинтезирующей клетке расходуется по меньшей мере 20 квантов. Кроме того, необходимо учесть затраты энергии на реассимиляцию в хлоропласте аммония фотодыхания, приток которого на порядок превышает приток нитрита.
Хотя энергозатраты на ассимиляцию 1 моль нитрата в 2,5 больше, чем на ассимиляцию 1 моль СО2, величина ассимиляции СО2 в 5 — 20 раз выше, чем величина светозависимой ассимиляции нитрата, и можно думать, что активность электронного транспорта в хлоропласте используется предпочтительно на ассимиляцию углерода. Однако в стационарных условиях пул Фд (2 мМ), как правило, восстановлен даже в темноте, и его достаточно, чтобы обеспечить электронами все взаимодействующие с ним ферментные системы (Фд-НАДФ-оксидоредуктазы, НиР, ГОГАТ, сульфитредуктазу и тиоредоксинредуктазу). Более того, нитрит, будучи акцептором электронов, участвует в поддержании редокс-статуса компонентов ЭТЦ, стимулируя нециклический электронный транспорт. Кроме того, нитрит конкурирует за электроны с кислородом и, вероятно, препятствует появлению токсических активных форм кислорода. Возможно также, что увеличение чувствительности к фотоингибированию у хлоропластов растений, испытывающих азотное голодание, обусловлено отсутствием значительного стока электронов на восстановление NO .
Таким образом, процессы фотоассимиляции СО2 и NO не конкурируют за восстановительные эквиваленты в хлоропластах. Отсутствие конкуренции между двумя этими базовыми процессами находится в полном соответствии с тем, что обычно наблюдается в естественной среде: снабжение азотом усиливает рост и, следовательно, общую фиксацию СО2.
Взаимодействие и регуляция процессов ассимиляции углекислоты и азота в хлоропласте существует также на уровне притока субстратов (СО2, NO , α-кетоглутаровая кислота) и удаления продуктов ассимиляции (глутаминовая кислота, ФГА). Одним из главных факторов регуляции образования нитрита в цитозоле выступает доступность восстановителя в виде НАДН (см. выше). Если источником восстановителя служат фотосинтетические реакции, то восстановительная сила поступает в цитозоль из хлоропласта за счет выноса ФГА или дигидроксиацетонфосфата и их окисления до ФГК с образованием НАДН и АТФ. У С4-видов растений особое значение имеет челночный транспорт оксалат (ЩУК) — малат.
Транспорт нитрита из цитозоля в хлоропласт регулируется через светозависимые изменения рН, концентрации Mg2+ и образование АТФ в ФС1, а также через редукцию NO ; вероятно, это и есть то самое место, где контролируется процесс усвоения окисленного азота в хлоропласте.
Данных о сколь-либо существенном синтезе α -кетоглутаровой кислоты в хлоропласте нет. Транспорт α-кетоглутарата в хлоропласт происходит одновременно с экспортом глутамата и с участием двух транслокаторов. Перенос α-кетоглутарата активируется в присутствии NH , NО и дикарбоновых кислот (малата, сукцината, фумарата). Большая часть метки 14С-α-кетоглутарата включается в глутаминовую кислоту, экспортируемую из хлоропласта. При этом только незначительное количество глутамина выходит из хлоропласта.
Таким образом, взаимодействие фотосинтеза и азотного обмена в хлоропласте может опосредованно регулироваться доступностью образующихся вне хлоропласта нитрита и
α-кетоглутарата, возникновение которых в цитозоле связано с реакциями дыхания.
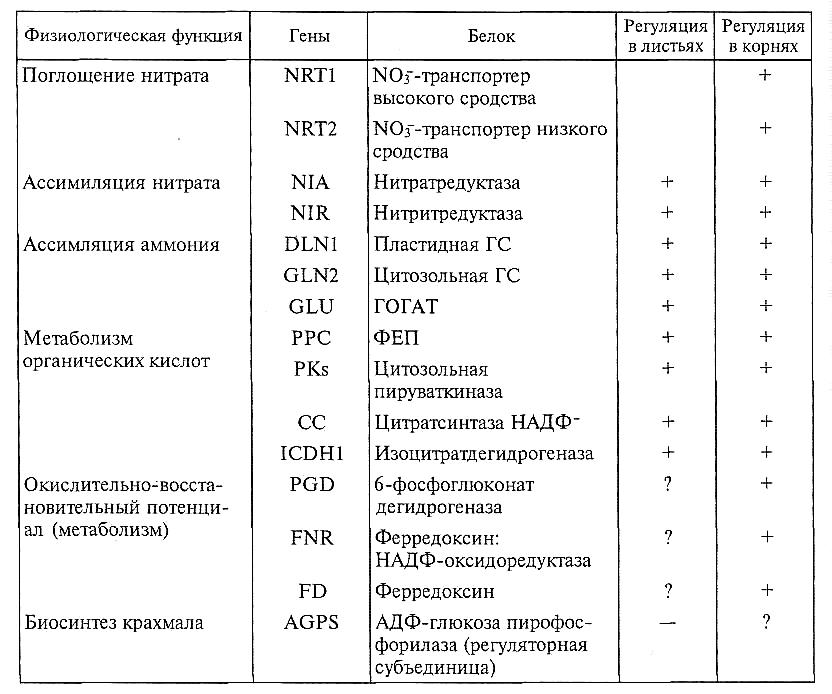
Нитрат — регуляторная молекула. Нитрат проявляет свойства сигнальной молекулы для многих ферментов и процессов. Сигнальная функция нитрата проявляется в быстром (в течение 0,5 — 1 ч) увеличения уровня мРНК индуцируемых генов при низких концентрациях нитрата порядка 10 — 250 мкМ даже в присутствии ингибиторов белка. Так у Arabidopsis идентифицировано более 40 генов, индуцируемых нитратом. В табл. 6.5 приведен далеко не полный перечень генов, индуцируемых нитратом.
Таблица 6.5. Некоторые гены, регулируемые нитратом (механизм передачи сигнала неизвестен)
Таким образом, на физиологическом уровне ион NO выступает индуктором путей ассимиляторного усвоения нитрата и перепрограммирует метаболизм С на создание восстановительного потенциала и углеродных субстратов для путей ассимиляции.
Нитрат также влияет на формирование и рост боковых корней. Локальные аппликации нитрата к корню при его дефиците индуцируют локальную пролиферацию боковых корней. Данный эффект сохраняется у мутантных по HP растений, т.е. не связан с метаболизацией NO . С другой стороны, постоянно высокие концентрации NO в среде приводят к уменьшению частоты боковых корней. Наиболее вероятно, что это обусловлено неидентифицированным фактором, поступающим из надземных органов, где нитрат преимущественно накапливается (рис. 6.48).
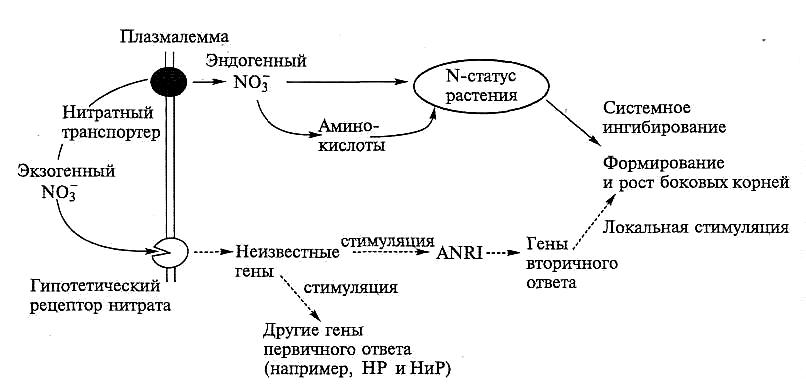
Рис. 6.48. Схема регуляции нитратом формирования боковых корней
Таким образом, NО -сигнал экзогенной или эндогенной природы «модулирует» рост и морфологию корня.
О путях восприятия и передачи NO -сигнала известно мало. Действие сигнальной молекулы обычно начинается со взаимодействия с рецептором. Такой белок-рецептор для нитрата не выявлен. Предполагается, что в передачу сигнала включены ионы Са2+, фосфатазы и киназы. Был идентифицирован также ген ANR1, гомологичный фактору транскрипции MADS-box. Этот ген быстро и специфично индуцируется ионом NO в корнях растений, голодавших по азоту. Если экспрессия этого гена заблокирована, то образование латеральных корней под действием нитрата не происходит.
