
- •6.3. Включение в обмен веществ и функции элементов минерального питания
- •6.3.1. Фосфор 6.3.1.1. Характерные особенности фосфорного питания
- •6.3.1.2. Основные типы фосфорсодержащих соединений
- •6.3.1.3. Транспорт фосфата через мембраны
- •6.3.1.4. Метаболизм фосфата
- •6.3.1.5. Ответные реакции растительного организма на дефицит фосфата
- •6.3.2. Азот
- •6.3.2.1. Формы азота, используемые растением
- •6.3.2.2. Поглощение и усвоение нитрата
- •6.3.2.3. Поглощение и ассимиляция аммония
- •6.3.2.4. Интеграция азотного метаболизма на уровне целого растения
- •6.3.3. Сера
- •6.3.3.1. Серосодержащие органические соединения
- •6.3.3.2. Поглощение и транспорт сульфата
- •6.3.3.3. Ассимиляторное восстановление сульфата
- •6.3.3.4. Глутатион и его производные
- •6.3.4. Кальций
- •6.3.4.2. Системы транспорта кальция
- •6.3.5. Калий
- •6.3.5.1. Системы транспорта к и их характеристика
- •6.3.5.2. Регуляция мембранного потенциала
- •6.3.5.3. Регуляция активности ферментов и синтез белка
- •6.3.5.4. Осморегуляция и катионно-анионный баланс
- •6.3.6. Движения устьиц: транспорт ионов и регуляция
- •6.3.6.1. Открывание устьиц
- •6.3.6.2. Закрывание устьиц
- •6.3.7. Хлор
- •6.3.8. Магний
- •6.3.9. Железо
- •6.3.10. Медь
- •6.3.11. Марганец
- •6.3.12. Молибден
- •6.3.13. Цинк
6.3.1.4. Метаболизм фосфата
Главный биохимический путь включения фосфата в органические соединения идет через АТФ: неорганический фосфат вовлекается в реакции углеводного обмена (см. гл. 3 и 4) и биосинтеза фосфолипидов. В состав нуклеиновых кислот АТФ входит как ключевое соединение. Поскольку химическая форма фосфора не меняется, можно говорить о «химической» компартментации фосфата или распределении Фн между различными типами органических соединений. В табл. 6.4 приведены величины времени обновления различных химических Р-пулов.
Таблица 6.4. Время обновления и скорость синтеза различных типов фосфорсодержащих органических соединений (по R.L.Bieleski, I.B.Ferguson, 1983)

Уже через 30 с поглощенный Фн включается в состав АТФ в γ-положении:
α β γ
аденозин—Р ~ Р ~ Р
Далее имеет место быстрая обменная реакция между АТФ и УТФ, катализируемая нуклеозиддифосфаткиназой, поэтому следует говорить о быстро обновляемом пуле (АТФ + УТФ). Высокая скорость обновления β-Р в этом пуле свидетельствует, что примерно 1 из 4 молекул нуклеотидфосфатов окисляется до мононуклеотида. В стационарном состоянии до 45 % поглощаемого фосфата проходит через нуклеотидный пул. Второе место по интенсивности вовлечения фосфата в метаболизм занимают реакции фосфорилирования глюкозы и триоз в гликолизе. Менее быстрые реакции включения Р — через фосфатидилхолин в состав фосфолипидов биомембран. Обновление «структурного» фосфата в составе нуклеотидов, где АТФ — ключевое соединение, идет чрезвычайно медленно, и содержание Р в ДНК достаточно стабильный показатель для вида. Доля Р в других формах фосфорсодержащих соединений от общего содержания Р меняется в зависимости от типа ткани, возраста и фосфорного питания.
После заполнения пулов быстро обновляемого органического фосфата в клетке начинается накопление неорганического фосфата. За исключением строгого фосфорного голодания, цитозольная концентрация Фн поддерживается на постоянном уровне (5—10 мМ) независимо от экзогенной концентрации Фн. Постоянство концентрации Фн в цитозоле необходимо для обновления и поддержания химических пулов Р и протекания множества ферментативных реакций. Вакуолярная концентрация, напротив, широко варьирует: быстро возрастает в ответ на улучшение фосфатного питания и снижается вплоть до нуля при фосфатном голодании. Максимальная концентрация в запасном пуле обычно не превышает 25 мМ.
Наиболее значительный прогресс в картировании внутриклеточных пулов Р был достигнут с применением ЯМР-спектроскопии. На рис. 6.36 представлен достаточно типичный спектр распределения Р между различными клеточными пулами, полученный для суспензионной культуры клеток моркови in vivo.
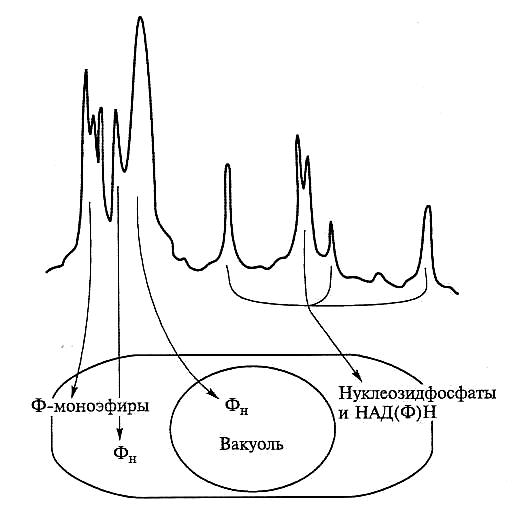
Рис. 6.36. Типичный спектр распределения фосфата между различными клеточными пулами, полученный для суспензионной культуры клеток моркови in vivo (no Carrol et al., 1994)
Фосфорилирование и дефосфорилирование белковых молекул — важнейший способ регуляции их активности. Включение фосфата в молекулу белка приводит к перераспределению в ней электрических зарядов, модификации структуры и функций. Фосфорилирование белков регулирует активность многих ферментов, синтез РНК и белка, как следствие — деление и дифференцировку клеток. Это способ быстрой регуляции метаболической активности на уровне клетки и тканей.
Активности ферментов синтеза Сахаров, аминокислот и изопреноидов, а также ферментов расщепления сахарозы и Н+-АТФаза Р-типа в цитозоле регулируются обратимым фосфорилированием белковых молекул по серину/треонину.
Рассмотрим пример посттрансляционного контроля за распределением потоков С между сахарами и аминокислотами в ответ на действие факторов среды. Активность сахарофосфатсинтазы (СФС) может модулироваться разными типами фосфорилирования. Если фотосинтез заингибирован, СФС инактивируется фосфорилированием по серину в положении 158. В ответ на водный стресс СФС активируется фосфорилированием по серину-424 через Са2+-зависимую киназу. Пул сахарозы и растворимых Сахаров при этом увеличивается.
Известен механизм более тонкой регуляции активности ферментов путем фосфорилирования, в котором принимает участие низкомолекулярный белок 14-3-3. Белки, фосфорилированные по серину, становятся мишенью для присоединения 14-3-3-белка, который связывается с определенным фосфопептидом: Арг-Сер-Х-фосфоСер-Х-Про. После связывания белок-мишень меняет свои свойства: активность, стабильность, субклеточную локализацию и характер взаимодействия с другими белками. Такой тип регуляции — фосфорилирование по серину с последующим связыванием с 14-3-3-белком — установлен для многих ферментов: HP, ГС, СФС, ФЕПК, 3-ФГА-дегидрогеназы, Н+-АТФазы плазмалеммы и др.
У хорошо обеспеченных Фн растений большая часть поглощенного корнями фосфата транспортируется по ксилеме в более молодые листья. Радиальный транспорт по корню идет в виде фосфорных эфиров Сахаров. В ксилему фосфат загружается после дефосфорилирования Гл6Ф и по ксилеме транспортируется в виде Фн (см. рис. 6.23). Использование меченого фосфата показало, что он достигает ксилемы примерно за 8 мин. В зависимости от доступности в среде концентрация Фн в ксилеме варьирует от 1 до 7 мМ.
Наблюдается также быстрая ретранслокация Фн по флоэме. В экспериментах на растениях фасоли с разделенной корневой системой было показано, что через 6 ч после внесения меченого фосфата под одну часть корня он появляется в другой части. Приблизительно половина Фн, ретранслоцированного из надземных органов в корни по флоэме, затем переносится в ксилему и возвращается обратно в листья. Если в ксилеме Р всегда транспортируется исключительно как свободный фосфат, то во флоэме обнаруживаются значительные количества органического фосфора.
