
- •6.3. Включение в обмен веществ и функции элементов минерального питания
- •6.3.1. Фосфор 6.3.1.1. Характерные особенности фосфорного питания
- •6.3.1.2. Основные типы фосфорсодержащих соединений
- •6.3.1.3. Транспорт фосфата через мембраны
- •6.3.1.4. Метаболизм фосфата
- •6.3.1.5. Ответные реакции растительного организма на дефицит фосфата
- •6.3.2. Азот
- •6.3.2.1. Формы азота, используемые растением
- •6.3.2.2. Поглощение и усвоение нитрата
- •6.3.2.3. Поглощение и ассимиляция аммония
- •6.3.2.4. Интеграция азотного метаболизма на уровне целого растения
- •6.3.3. Сера
- •6.3.3.1. Серосодержащие органические соединения
- •6.3.3.2. Поглощение и транспорт сульфата
- •6.3.3.3. Ассимиляторное восстановление сульфата
- •6.3.3.4. Глутатион и его производные
- •6.3.4. Кальций
- •6.3.4.2. Системы транспорта кальция
- •6.3.5. Калий
- •6.3.5.1. Системы транспорта к и их характеристика
- •6.3.5.2. Регуляция мембранного потенциала
- •6.3.5.3. Регуляция активности ферментов и синтез белка
- •6.3.5.4. Осморегуляция и катионно-анионный баланс
- •6.3.6. Движения устьиц: транспорт ионов и регуляция
- •6.3.6.1. Открывание устьиц
- •6.3.6.2. Закрывание устьиц
- •6.3.7. Хлор
- •6.3.8. Магний
- •6.3.9. Железо
- •6.3.10. Медь
- •6.3.11. Марганец
- •6.3.12. Молибден
- •6.3.13. Цинк
6.3.9. Железо
Железо относят к группе микроэлементов, и обычно с него начинают обсуждение их функций. В отличие от макроэлементов, которые выполняют широкий спектр функций «общеорганизменного» уровня, микроэлементы реализуют свои функции в конкретных процессах и реакциях, как правило, в локальных клеточных структурах. Здесь микроэлементы определяют пространственную конформацию, активность некоторых ферментов или участвуют в окислительно-восстановительных реакциях.
В почве содержание железа больше, чем любого другого элемента, но доступного железа так мало, что даже при относительно малой потребности растения часто страдают от его недостатка (хлороз). При физиологических величинах рН концентрация соединений трех- и двухвалентного железа ниже, чем 10-5 мМ, и для поглощения его нужно сначала растворить. Чтобы обеспечить себя железом (концентрация в тканях составляет 10-6 М), растения развили механизмы, позволяющие добывать Fe3+/2+ из почвы. Эти механизмы активируются в ответ на еще больший, чем обычно, дефицит Fe3+ и различны у двудольных и однодольных растений (рис. 6.62).
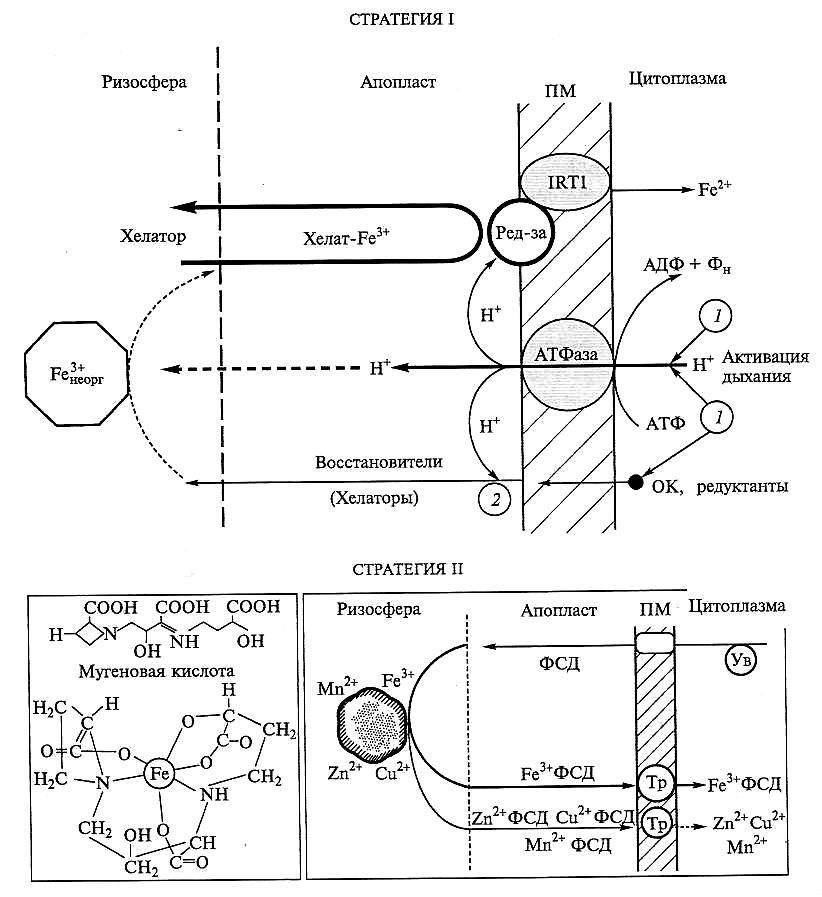
Рис. 6.62. Ответная реакция корней на дефицит железа.
Стратегия I — у двудольных и однодольных незлаковых растений (1 — активация протонной помпы; 2 — увеличение выхода восстановителей/хелаторов); ОК — органические кислоты; ред-за — индуцируемая хелатредуктаза; IRT1 (Iron reduced transporter) — транспортер Fe11. Стратегия II — синтез фитосидерофоров у однодольных злаков; ФСД — фитосидерофоры; ПМ — плазма-лемма; Ув — увеличение синтеза и выхода ФСД; Тр — транспортеры комплексов металла с ФСД
У двудольных и незлаковых однодольных видов реализуется стратегия I, связанная с интенсификацией дыхания. Активация дыхания корней способствует работе Н+-помпы (за счет увеличения доступности АТФ) и обеспечивает дополнительный синтез органических кислот, которые хелатируют железо (например, лимонная кислота). Выкачивание протонов способствует растворению железа почвенных частиц, а вышедшие хелаторы образуют хелатные комплексы с Fe3+. Хелатированное Fe3+ восстанавливается расположенной на ПМ Fe3+-хелатредуктазой (этот фермент, видимо, способен также восстанавливать Сu2+ до Сu+). Двухвалентное железо (Fe2+) переносится через мембрану специфическим Fе2+-транспортером — IRT1, который, видимо, осуществляет также транспорт Мn2+, но Cd2+ подавляет его активность. Перенос осуществляется одновременно с активацией Н+-АТФазы. Считают, что именно переносчик IRT1 отвечает за поступления железа из почвы.
У однодольных злаков адаптация, обеспечивающая поглощение железа (стратегия II), связана с синтезом специальных хелатирующих веществ — фитосидерофоров. Фитосидерофоры — низкомолекулярные соединения, относящиеся к непротеиногенным аминокислотам, — синтезируются (в ответ на дефицит железа) из метионина с образованием на первом этапе никотинамина, который затем превращается в мугеновую кислоту. Последняя является хелатором железа. Железо (Fe3+) в составе комплекса переносится специфической, пока неохарактеризованной транспортной системой. Никотинамин также может быть хелатором, принимающим участие в транспорте металлов по механизму стратегии II. Кроме того, комплекс металла с никотинамином может участвовать в дальнейшем транспорте Сu, Zn по ксилеме и Сu, Zn, Fe2+ — по флоэме.
Дефицит железа вызывает также изменения морфологии корней, индуцируя рост корневых волосков, которые обильно покрывают поверхность корня. Это способствует лучшему контакту с почвой и почвенным раствором, увеличивая поглощение железа (см. подразд. 6.2.1.1).
В клетках железо находится либо в комплексе с тетрапирольным кольцом (гемопротеины), либо в комплексе с сульфидной серой многочисленных железо-серных белков. И те и другие соединения железа входят в состав ферментов ЭТЦ дыхания и фотосинтеза (см. гл. 2, 3, 4). Железогемопрбтеины в сумме составляют до 8,5 % от общего белка клетки. К гемопротеинам относятся пероксидаза и каталаза, связанные с антиоксидантной защитой (см. гл. 3). Пероксидаза участвует также в синтезе лигнина. Лег-гемоглобин связывает кислород и служит защитным барьером от его проникновения в клубеньки бобовых, поскольку О2 инактивирует нитрогеназу, фиксирующую N2.
Первым из белков, содержащих негеминовое железо, был открыт ферредоксин. В хлоропласте этот железосерный белок является донором электронов для НАДФ оксидоредуктазы, ферментов сульфитредуктазы и нитритредуктазы (у двух последних ферментов простетической группой является Fe-содержащий сирогем) (см. рис. 6.42 и 6.49). Соотношение Fe и S в кластере железосер-ных белков может различаться и составлять 2Fe—2S, как у ферредоксина, или 4Fe—4S, как у многих других ферментов (см. гл. 2).
К железосерным белкам помимо белков ЭТЦ хлоропластов и митохондрий относятся аконитаза, ксантиноксидаза, липоксигеназа, нитрогеназа и ключевой фермент азотного обмена — нитратредуктаза. В сумме железо белков, связанное с серой, составляет 18,5 % общего содержания железа; на митохондриальные комплексы приходится 9 %, на ферредоксин 2,5 %. Одна из супероксиддисмутаз (СОД), присутствующая в хлоропласте, также включает Fe.
Запасной формой железа в растительной клетке является ферритин — многомерный белок, состоящий из 24 полипептидов. Отдельные полипептиды представляют собой полые сферы, разграничивающие внутреннюю полость четвертичной структуры ферритина, которая заполнена железом (Fe2O3•nН2О). Каждая молекула может запасать до 4500 атомов железа в растворимой, нетоксичной и доступной форме. Основная масса ферритина находится в строме хлоропласта. В целом до 60 % железа, содержащегося в листе, приходится на хлоропласты.
