
- •6.3. Включение в обмен веществ и функции элементов минерального питания
- •6.3.1. Фосфор 6.3.1.1. Характерные особенности фосфорного питания
- •6.3.1.2. Основные типы фосфорсодержащих соединений
- •6.3.1.3. Транспорт фосфата через мембраны
- •6.3.1.4. Метаболизм фосфата
- •6.3.1.5. Ответные реакции растительного организма на дефицит фосфата
- •6.3.2. Азот
- •6.3.2.1. Формы азота, используемые растением
- •6.3.2.2. Поглощение и усвоение нитрата
- •6.3.2.3. Поглощение и ассимиляция аммония
- •6.3.2.4. Интеграция азотного метаболизма на уровне целого растения
- •6.3.3. Сера
- •6.3.3.1. Серосодержащие органические соединения
- •6.3.3.2. Поглощение и транспорт сульфата
- •6.3.3.3. Ассимиляторное восстановление сульфата
- •6.3.3.4. Глутатион и его производные
- •6.3.4. Кальций
- •6.3.4.2. Системы транспорта кальция
- •6.3.5. Калий
- •6.3.5.1. Системы транспорта к и их характеристика
- •6.3.5.2. Регуляция мембранного потенциала
- •6.3.5.3. Регуляция активности ферментов и синтез белка
- •6.3.5.4. Осморегуляция и катионно-анионный баланс
- •6.3.6. Движения устьиц: транспорт ионов и регуляция
- •6.3.6.1. Открывание устьиц
- •6.3.6.2. Закрывание устьиц
- •6.3.7. Хлор
- •6.3.8. Магний
- •6.3.9. Железо
- •6.3.10. Медь
- •6.3.11. Марганец
- •6.3.12. Молибден
- •6.3.13. Цинк
6.3.4.2. Системы транспорта кальция
Содержание кальция в отдельных структурах клетки регулируется с участием Са2+-помп и Са2+-каналов (рис. 6.54).
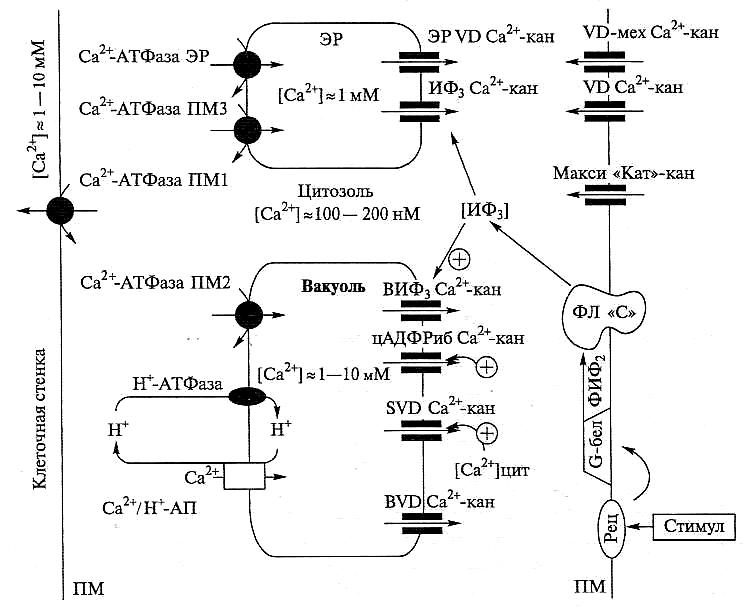
Рис. 6.54. Основные системы транспорта Са2+ в мембранах растительных клеток. Слева представлены Са2+-помпы (по Evans, Williams, 1998; Geisler et al., 2000; Hirschi, 2001); справа — Са2+-каналы (по Fox, Guerinot, 1998; Sanders et al., 1999; White, 1998, 2000; Blatt, 2000):
ПМ — плазмалемма; В — вакуоль; ВМ — вакуолярная мембрана; ЭР — эндоплазматический ретикулум; АП — антипортер; кан — канал; VD (voltage-dependent) — потенциалзависимый (потенциалуправляемый); Рец — рецептор;
G-бел — регуляторные G-белки плазмалеммы, состоящие из субъединиц α, β, γ; ФЛ «С» — фосфолипаза «С»; ФИФ2 — фосфоинозитол-4,5-бисфосфат; ИФ3 — инозитол-(1,4,5)-фосфат; цАДФРиб — циклическая АДФ-рибоза; (+) — активация соответствующими лигандами. Са2+-помпы: Са2+ АТФазы Р-типа (ПМ1, ПМ2 и ПМЗ) и ЭР-типа; антипортер — Са2+/Н+-АП. Потенциалзависимые (кальциевые каналы) (VD Са2+-кан): на ПМ: макси «Кат»-кан — неспецифичный макси-катионный канал; VD Са2+-кан — Са2+-специфичный; УБ-мехСа2+-кан — механочувствительный канал (активируется гиперполяризацией); на вакуолярной мембране: BVD Са2+-кан — потенциалуправляемый (активируется гиперполяризацией), SVD Са2+-кан — медленно (slowly) активируемый деполяризацией; на мембране ЭР локализован 3PVD
Са2+-кан. Лигандо-управляемые кальциевые каналы: на ВМ: ИФ3-активируемый ВИФ3 Са2+-кан; цАДФРиб-активируемый, предположительно имеющий рецептор рианодина цАДФРиб Са2+-кан; на ЭРМ: рецептор-управляемый канал — ИФ3Са2+-кан (более подробную характеристику см. в тексте)
Градиент электрохимического потенциала для Са2+ на плазмалемме (ПМ), тонопласте (ВМ) и мембране ЭР таков, что поступление Са2+ в цитозоль происходит по каналам пассивно, а удаление с участием помп — с затратой энергии.
Низкая концентрация кальция в цитозоле — необходимое условие для функционирования Са2+ в качестве универсального посредника при передаче информации. Реализация функций мессенджера связана с очень малыми его потоками через мембраны. Разнообразные стимулы (гормоны, свет, механические воздействия, гипоосмотики и окислители, засуха, низкая и высокая температура, Nod-фактор, сигналы межклеточных взаимодействий, гравиотропизм и др.) через быстрое изменение потенциала клеточной мембраны приводят к открыванию Са2+-каналов и возрастанию его концентрации в цитозоле. Возвращение концентрации Са2+ к стационарному уровню покоя обеспечивается работой Са2+-АТФаз. Такое изменение концентрации Са2+ в цитозоле названо нестационарным, или переходным (transient), состоянием. Локальное и часто кратковременное увеличение концентрации Са2+ в цитозоле действует как сигнал, передающий информацию от поверхности клетки внутрь. Кальциевый сигнал может усиливаться за счет дополнительного выхода Са в цитозоль из вакуоли или ЭР.
Са
+-помпы.
Выкачивание
Са
из цитозоля осуществляют Са
-АТФазы,
которые принадлежат к большому семейству
АТФаз Р-типа, и Са
/Н![]() -антипортеры.
-антипортеры.
Са2+-АТФазы растений и животных подразделяют на помпы: ПМ (или ПВ)-типа, стимулируемые кальмодулином (КаМ), и ЭР (или ПА)-типа, которые непосредственно КаМ не стимулируются. У растений в отличие от животных Са -АТФазы ПМ-типа локализованы не только на плазмалемме (Са -АТФаза ПМ1), но и на эндомембранах (Са2+-АТФаза ПМ2 и ПМЗ) (рис. 6.54). Са2+-АТФазы ЭР-типа также присутствуют как на мембране ЭР, так и на тонопласте. На тонопласте, помимо
Са -помпы, функционирует Са /Н -антипортер. Выкачивание Са из цитозоля с участием антипортера сопряжено с работой вакуолярной Н+-АТФазы, для которой гомеостатирование кальция считается конститутивной функцией. Более того, вакуолярная Н+-АТФаза, пирофосфа-таза (Н+-ПФаза) и Са2+/Н+-антипортер совместно участвуют в поддержании рН и ионного гомеостаза в цитозольном и вакуолярном компартментах. Некоторые Са2+-АТФазы и
Са2+/Н+-антипортеры идентифицированы на генном уровне.
Итак, Са -помпы выполняют несколько важных функций. Наряду с центральной — поддержание низкой концентрации кальция и создание фона для возникновения кальциевого сигнала — они обеспечивают создание пулов Са в апопласте, вакуоли, ЭР, откуда он может контролируемо возвращаться в цитозоль. Функционирование Са -АТФаз, связанное с восстановлением [Са ]цит до уровня покоя, одновременно обеспечивает завершение переходного состояния и, таким образом, формирование Са -сигнала (см. подразд. 6.3.4.3).
Са -каналы. Кальциевые каналы подразделяют на две группы: потенциал-зависимые (VD — voltage-dependent) и рецепторуправляемые, или лигандозависимые. К настоящему времени изучены электрические и биохимические свойства, регуляция и физиологическая роль ряда кальциевых каналов из разных мембран растений, но пока не осуществлена их идентификация на генетическом уровне.
В плазмалемме клеток, главным образом корней и замыкающих клеток устьица, обнаружено несколько VD Са2+-каналов, которые могут быть подразделены на каналы, активируемые при деполяризации и при гиперполяризации плазмалеммы. К первому классу относится так называемый «макси-катионный канал» (рис. 6.54), который имеет высокую проводимость единичного канала, но малоселективен. Он пропускает К+, Na+, Ba , Mg , Мn и некоторые другие ионы, хотя вход Са через этот канал при физиологических концентрациях ионов, видимо, доминирует. Другой Са -канал, также активируемый при деполяризации
(VD Са -канал), более селективен для Са , но имеет меньшую проводимость. Неселективные каналы, очевидно, служат основными воротами поступления кальция в клетку из внешней среды, например в корнях, или из апопласта в устьичные клетки листа. В класс VD Са -каналов плазмалеммы, активируемых при гиперполяризации, входят механочувствительные (stretch-activated) каналы разных типов, в том числе и Са2+-канал замыкающих клеток устьица, который регулируется АБК, — VD-мех Са2+-канал (рис. 6.54). У других клеток подобные каналы также могут иметь большое значение в восприятии тургора, например при удлинении корневого волоска и пыльцевой трубки.
На тонопласте функционируют потенциалзависимые каналы, активирующиеся при гиперполяризации — BVD Са2+-канал и при деполяризации — медленный (slowly) SVD Са2+-канал (рис. 6.54). Оба типа VD-каналов не являются строго специфичными для Са2+ и проницаемы также для Mg2+, K+; SVD Са2+-канал проницаем также и для Na+, Rb+, Cs+. Выход Са2+ через SVD
Са2+-канал активируется, помимо потенциала, при увеличении [Са +]цит и регулируется другими факторами (рН, концентрацией других ионов, соотношением [Са +]цит/[Са +]вак, КаМ,
14-3-3-белками и, возможно, состоянием фосфорилированное-дефосфорилированное). Функции SVD Са2+-канала связывают с осморегуляцией и поддержанием гомеостаза. Кроме того, через этот канал происходит Са2+-индуцируемое высвобождение Са2+ из вакуоли (CICR — Са2+ induced Ca2+ release), что приводит к увеличению его концентрации в цитозоле и вносит вклад в специфичность сигнала (см. подразд. 6.3.4.3).
Из вакуоли Са выходит также через рецепторуправляемые каналы, которые открываются при рецепции вторичных мессенджеров: инозитол-1,4,5-фосфата (ИФ3 — инозитолтрифосфат) или циклической АДФ-рибозы (цАДФриб) (рис. 6.54). С активацией этих вакуолярных каналов связаны ответные реакции на гиперосмотический (ВИФ3 Са2+-кан) и холодовой (цАДФриб
Са2+-кан) шок. В ответ на действие АБК при закрывании устьиц активируются оба эти канала. В мембране ЭР также присутствуют потенциал- и лигандозависимые Са -каналы. Одним из первых каналов ЭР мембраны растений был охарактеризован потенциалзависимый механочувствительный канал (3FVD Са2+-кан) (рис. 6.54) из усиков переступня двудомного (Bryonia dioica) (назван ВСС1 — Bryonia calcium channal). Предполагают, что ВСС1 регулируется через изменение концентрации кальция в люмене ЭР, хотя рН цитозоля также влияет на его активность. С ИФ3 Са2+-каналом ЭР мембраны связывают увеличение [Са2+]цит и передачу информации в растущей пыльцевой трубке.
Итак, в растительной клетке в ответ на действие разных стимулов увеличивается концентрация кальция в цитозоле, что является Са2+-сигналом для передачи информации. Первичными источниками изменений концентрации являются Са -каналы с разными пропускными характеристиками, разными способами регуляции и расположенные на плазмалемме и эндомембранах. Разнообразие путей входа Са2+ в цитозоль вместе с разнообразием путей выхода (Са2+-помпы) создают большую гибкость в контроле за его потоками как в пространстве клетки, так и во времени, и обеспечивают возникновение специфического Са2+-сигнала, локализованного в связи с участием каналов разных типов в определенных участках клетки.
6.3.4.3. Са2+ и системы внутриклеточной сигнализации
Изменение программ роста и развития, контроль метаболизма и формирование ответных реакций на действие условий среды происходят вследствие передачи сигналов на белки-мишени или в геном по сложной сети информационных (сигнальных) путей. В клетке информация передается цитозольным структурам и компартментам через изменения концентраций множества вторичных мессенджеров (посредников), которые действуют в той или иной сигнальной системе вместе с кальцием или самостоятельно. Однако Са в комплексной сети передачи информации (transduction) служит универсальным посредником, поскольку ни один вторичный мессенджер не реагирует на столь большое число стимулов, как свободный Са цитозоля. Включение Са в широкую сеть сигнальных путей, которые передают послания от разных стимулов (внешних и внутренних) и заканчиваются соответствующими ответными реакциями, поднимает вопрос о том, каким образом в растительной клетке с участием одного и того же мессенджера достигается специфичность сопряжения стимула и ответа.
Специфичность Са -сигнала. Исходно в основе специфичности кальциевой сигнализации лежит компетентность клетки, ее функциональное предназначение. Способность реагировать на определенные стимулы и формировать соответствующий ответ зависит от экспрессии генов, кодирующих компоненты каскадного пути передачи конкретного сигнала в соответствующих клетках. Комплекс характерных свойств клетки, определяющий особенность ее сигнальной системы, получил название «физиологического адреса», который различается у разных клеток (например, у замыкающих клеток устьиц и трихобластов корня). Информация от стимулов, включая силу их воздействия, первоначально кодируется в кальциевом сигнале, отражающем характер возрастания концентрации Са2+ в цитозоле ([Са2+])цит. Это переходное (транзитное) состояние может иметь вид всплесков, волн, пульсаций или осцилляции, плато, градиента или быть сочетанием этих проявлений (рис. 6.55). Основные варьирующие параметры Са2+-сигнала, которые могут быть оценены количественно, это: уровень увеличения [Са2+]цит; продолжительность лаг-периода от момента воздействия до начала подъема [Са ]; продолжительность подъема, нахождения на высоком уровне и возвращения к уровню покоя. Сигнальная информация может быть закодирована в амплитуде и частоте осцилляции (пульсаций), а также их регулярности.
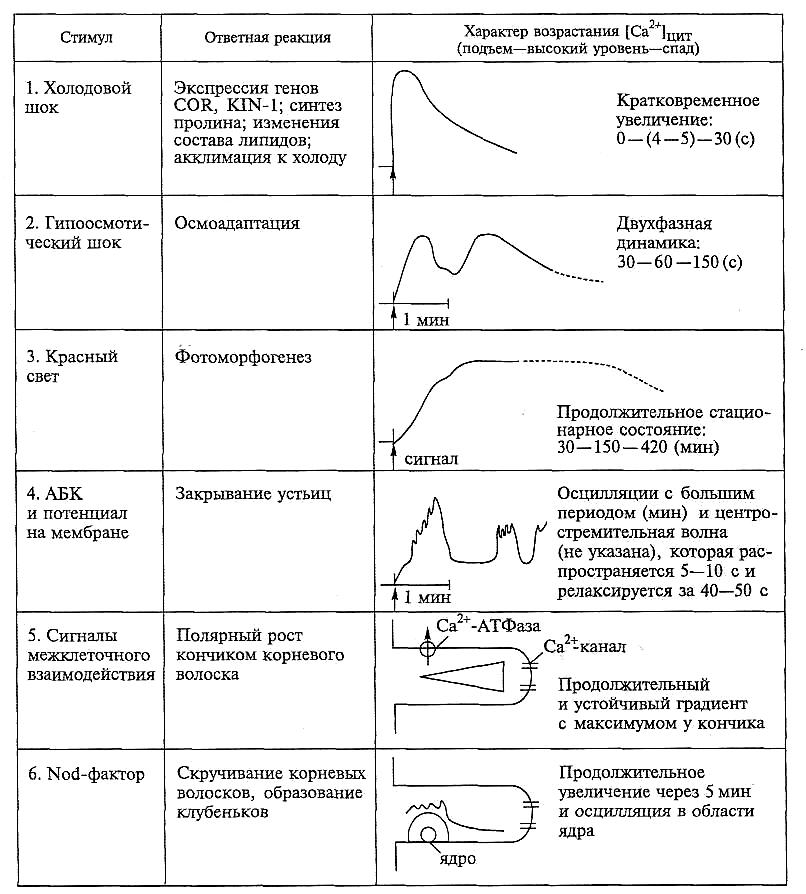
Рис. 6.55. Особенности переходного состояния [Са2+]цит в зависимости от стимулов (по данным: 1 — Malho et al., 1998; Plieth et al, 1999; 2 — Malho et al, 1998; Cessna et al., 1998; 3 — Malho et al., 1998; Legue et al., 1997; 4 - Grabov, Blatt, 1998; Staxen et al., 1999; Blatt, 2000; Hamilton et al., 2000; 5 - Bibikova et al., 1997; Wymer, Bibikova, 1997;
6 — Cardenas et al., 1999, 2000).
Время в секундах (с) или минутах (мин) указывает на продолжительность: подъема—высокого уровня—спада [Са2+]цит; стрелкой отмечен момент воздействия
плазмалеммы, в результате этого диссоциирует их α-субъединица, активирующая фосфолипазу С (ФЛ «С»)*. Активированная ФЛ «С» гидролизует ФИФ2 с
* Активированные G-белки передают сигнал и другим фосфолипазам плазмалеммы, а также циклазам и каналам, которые в свою очередь участвуют в образовании вторичных мессенджеров.
Даже самое общее сравнение характера Са -сигналов при действии разных стимулов (рис. 6.55) свидетельствует об их разнообразии: кратковременное (холодовой шок) или очень продолжительное (красный свет) увеличение [Са ]цит; появление двухфазной кинетики переходного состояния (гипоосмотический шок) или образование градиента концентрации Са (растущий корневой волосок). Кинетика изменения концентрации Са2+ может меняться в зависимости от силы и продолжительности действия стимула. Однако только в редких случаях величина изменения [Са2+]цит и конечная ответная реакция на стимул коррелируют со степенью его воздействия. Это обусловлено множеством причин, в частности тем, что стимул (фактор) в своем действующем начале имеет две составляющие: само воздействие (физическое, химическое или комплексное) и параметры времени. При холодовом шоке, например, увеличение уровня [Са ]цит (которое начинается сразу) (рис. 6.55, 1) зависит не от абсолютного значения низкой температуры, а от скорости ее снижения. При действии многих стимулов увеличение [Са2+] в Цитоплазме связано с осцилляциями (пульсациями), которые имеют определенную амплитуду и частоту и могут повторяться через менее или более регулярные интервалы (рис. 6.55, 4, 6). Характер осцилляции также определяет специфику Са -сигнала.
Разнообразие свойств и способов регуляции Са -каналов является основой, обеспечивающей взаимодействие путей передачи сигналов с участием разных посредников. Идентифицирован ряд вторичных мессенджеров, которые связаны с возникновением и спецификой Са -сигнала (ИФ3, цАДФриб, Н+ и др.). Инозитол-1,4,5,-фосфат — конечный продукт превращения минорного компонента плазмалеммы фосфатидилинозитола (ФИ), но непосредственным предшественником ИФ3 является ФИФ2 (ФИ-4,5-бисфосфат) (см. рис. 6.54). При рецепции определенных стимулов активируются регуляторные G-белки образованием двух вторичных мессенджеров:
1,2-диацетилглицерола (ДАТ*) — активатора протеинкиназы С и ИФ3 — регулятора активности Са2+-каналов эндомембран (его считают основным участником формирования Са2+-волны). Другой распространенный вторичный мессенджер животных и растительных клеток — цАДФриб также действует как сигнальная молекула, активирующая выход Са из эндогенных депо.
Поступление кальция в цитозоль через рецепторуправляемые Са -каналы эндомембран вносит дополнительный (к притоку Са2+ извне) вклад в увеличение [Са ]цит и приводит к возникновению и поддержанию осцилляции (например, в базальной части растущей пыльцевой трубки, при осмотическом стрессе, при действии АБК в замыкающих клетках устьица) (рис. 6.55, 4). Таким способом сигнальная информация не только кодируется по амплитуде и частоте всплесков, но с помощью осцилляции сигнал усиливается и меняется по продолжительности, что обеспечивает регуляцию его передачи во времени.
Специфичность Са2+-сигнала обусловлена также его локализацией в клетке и, если это касается такой формы сигнала как градиент или волна, — вектором их распространения. Разный характер увеличения концентрации Са2+ в цитозоле может быть результатом его поступления из разных депо (апопласт, вакуоль, ЭР) через разнообразные Са2+-каналы, а снижение [Са2+]цит при возвращении к уровню покоя (новый уровень может не совпадать с исходным) за счет работы
Са2+-АТФаз разных мембран (см. рис. 6.54). В клетках, растущих кончиком (трихобласт, пыльцевая трубка и др.), сигналом ориентированного роста служит градиент с высокой концентрацией Са2+ в растущем кончике (см. рис. 6.55, 5). Основой поддержания этого градиента является пространственное разделение входа Са2+ в цитозоль по Са2+-каналам плазмалеммы в зоне активного роста кончика и выкачивания Са2+-АТФазами плазмалеммы и эндомембран в базальной части клетки корневого волоска. При воздействии Nod-фактора, вызывающего образование азотфиксирующих клубеньков у бобовых, кальций также поступает извне через Са2+-каналы кончика корневого волоска (см. рис. 6.55, 6). Но Са2+-сигнал проявляется как быстро нарастающее увеличение [Са2+]шт и всплески в области ядра, что приводит к скручиванию корневого волоска и смене программ дифференциации и функционирования.
Образование всплесков, осцилляции, волн, градиентов концентрации Са цитозоля, их разнообразных субпроизводных и сочетаний, а также различия в динамике и локализации изменений [Са ]цит отражают комплексность системы формирования Са -сигнала в каждой отдельной клетке. Возникающий в ответ на определенный стимул Са -сигнал настолько специфично кодирует информацию, что получил название Са2+-подписи (Са2+ signature). Подобный специфичный Са2+-сигнал — первый этап возникновения специфичной ответной реакции.
Пути передачи Са2+-сигнала. Зашифрованная информация для достижения нужных белков-мишеней, определяющих ответ на стимул, передается по сигнальным путям благодаря образованию комплексов кальция со специальными белками. К группе регуляторных белков растений, связывающих Са , относятся: кальмодулин — КаМ (СаМ — calmodulin); Са2+-зависимые протеинкиназы — Са2+-завПК (CDPKs — calcium dependent protein kinases) и Са2+/КаМ-зависимые протеинкиназы — Са2+/КаМ ПК (CCaMKs — calcium and calmodulin dependent protein kinases) (рис. 6.56). Эти белки имеют специальные места связывания Са2+, называемые EF-руками. Термин возник из обозначения двух α-спиралей, Е и F, являющихся частью Са2+-связывающего центра. Часто белки, имеющие подобные домены связывания кальция, называют, как группу регуляторных белков, «EF-рука».
* ДАГ и продукты активации ФЛ «С» и «А», вероятно, остаются в плазмалемме, где могут добавочно модифицировать функции мембранных белков. ФИФ2 и другие фосфолипиды могут непосредственно связываться с компонентами цитоскелета, изменяя их конформацию и функции.
Са -завПКзы принадлежат к одной из групп суперсемейства протеинкиназ (ПК) эукариотических клеток. ПКазы катализируют обратимый перенос фосфата с АТФ на боковые участки аминокислот белковой цепи. Функции ПК могут быть обращены действием протеиновых фосфатаз (ПФФ). Реакции фосфорилирования-дефосфорилирования оказывают значительное воздействие на активность белков и их взаимодействие с другими белками. Са2+-завПКазы имеют три функциональных домена — каталитический, автоингибиторный и С-терминальный кальмодулинподобный регуляторный домен с четырьмя EF-руками, связывающими Са . Это позволяет считать Са2+-завПКазы (как и КаМ) первичными сенсорами путей передачи Са2+-сигнала (рис. 6.56, 4а, 46). Впервые Са2+-завПКзы были обнаружены у растений и простейших и пока не найдены в клетках дрожжей и животных. Считают, что у растений большая часть киназной активности, которая стимулируется кальцием, связана именно с Са +-завПКазами (меньшая — с Са /КаМ ПКазами и КаМ). Обнаружено множество изоформ Са +-завПКаз (у Arabidopsis идентифицировано более 40 изоформ). Это ставит вопрос о функциях этих изоформ. Есть основание полагать, что разные изоформы могут «специализироваться» на узнавании
Са2+-сигналов. Постоянно пополняемый список белков-мишеней для Са2+-завПК включает транспортные белки мембран (Н+АТФазу ПМ, калиевые и анионные каналы замыкающих клеток устьиц, аквапорины и др.), ферменты (сахарофосфатсинтазу (СФС), фосфоенолпируваткарбоксилазу (ФЕПК), нитратредуктазу (HP), фосфатидилинозитолкиназу и др.), факторы транскрипции, элонгации, белки цитоскелета и другие мишени (рис. 6.56, 5). Таким образом, Са2+-завПК включены в передачу Са2+-сигнала, связанную с поддержанием мембранного потенциала, регуляцией углеводного и азотного обмена, устьичными движениями, ответами на стрессовые воздействия, формированием архитектуры клетки и т.д.
Однако, по-видимому, полная активация фермента при фосфорилировании с участием
Са2+-завПКаз возможна, если к регуляторному участку одновременно присоединяется
14-3-3-белок. Оба компонента включены в передачу сигнала и функционируют как адаптеры, шапероны, активаторы и репрессоры. Они участвуют в регуляции активности СФС, HP, ФЕПК, что обеспечивает согласованное функционирование этих ферментов в условиях дня и ночи.
14-3-3-белкам приписывается также роль обеспечения взаимосвязи между различными путями передачи сигналов, которые вызываются разными, действующими одновременно стимулами (экзогенными и эндогенными).
Кальмодулин (КаМ) относится к семейству белков «EF-рука» и является наиболее распространенным Са -связывающим белком, который играет центральную роль у всех организмов. Растительные КаМ — высококислые белки с молекулярной массой 14 кДа, локализованные в цитозоле (обнаружены в ядре и, возможно, прикреплены к плазмалемме). КаМ эукариотных организмов обладает большой консервативностью: аминокислотные последовательности белка растений идентичны КаМ позвоночных и дрожжей на 90 и 60 % соответственно. Но у растений, в отличие от животных, обнаружены мультигенные семейства КаМ-родственных генов, экспрессия которых индуцируется физическими (касание, тепловой и холодовой шок, темнота-свет) и химическими (ауксин, NaCl) стимулами. Индуцированная экспрессия некоторых из этих КаМ-генов опосредована увеличением [Са2+]цит (рис, 6.56, 4в). Предполагается, что характер их экспрессии, заканчивающийся появлением изоформ КаМ (рис. 6.56, 6), и/или конечные мишени сигнального пути (рис. 6.56, 5, 5а, 5в)
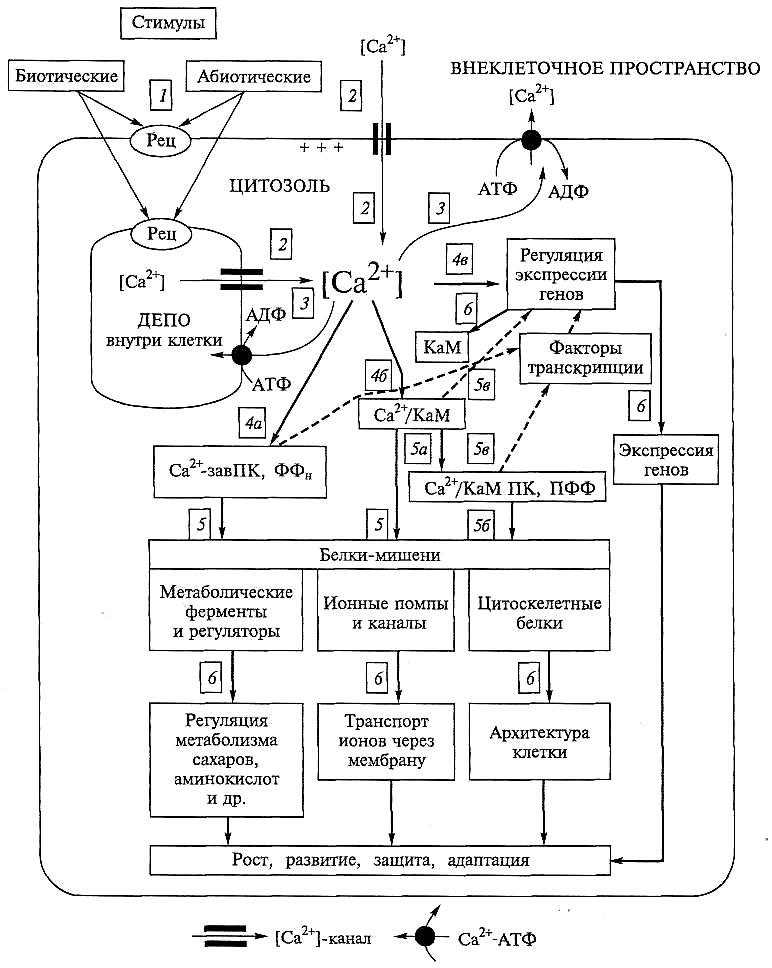
Рис. 6.56. Общая схема путей передачи Са2+-сигнала на мишени и ответная реакция
растительной клетки на разные стимулы (Н.Д.Алехина, 2004):
Рец — рецепторы на плазмалемме и эндомембранах; [Са ] — концентрация Са ; КаМ и Са2+-КаМ — кальмодулин и его комплекс с Са2+; Са2+-завПК и ПФФ — Са -зависимые протеинкиназы и протеинфосфатазы; Са2+/КаМ ПК, ПФФ — кальций и кальмодулинзависимая протеинкиназа, ПФФ; (+++) — деполяризация мембран; 1—6 — последовательность событий при восприятии стимула, возникновении Са2+-сигнала и путей его передачи (downstream transduction): 1 — рецепция различных абиотических (свет, холод, температура, гипоксия, засуха, ветер, механические воздействия и др.) и биотических (фитогормоны, патогены, симбионты и др.) стимулов, изменение мембранного потенциала (+ + +) и активация Са -каналов; 2 — инфлакс г Са2+ через каналы в цитозоль из внешней среды и внутриклеточных депо и кратковременное увеличение [Са2+]цит; 3 — выкачивание Са2+ благодаря работе Са2+-помп, окончание переходного состояния [Са2+]цит; 4 — связывание Са2+ с первичными сенсорами (4а — Са -завПКазами и ПФФазами; 46 — образование комплекса Са2+-КаМ; 4в — индукция синтеза КаМ); 5— активация белков-мишеней: 5а, 56 — при каскадной передаче через активацию Са /КяМ ПК. или ПФФ; 5в — регуляция экспрессии генов через
Са2+-КаМ-комплекс или с участием Са /КаМ ПФФ; 6 — общие ответные реакции на стимул (быстрые или более медленные, если включается геном)
различаются в зависимости от стимула. Таким образом, наличие изоформ КаМ значительно расширяет возможности адресной доставки сигнала. КаМ и комплекс Са2+-КаМ не обладают свойствами фермента и включаются в передачу сигнала и регуляцию клеточных процессов, присоединяясь к белкам-мишеням. Связывающий кальций центр КаМ имеет структуру спираль — петля — спираль. Петля, где связывается Са2+, состоит из 12 аминокислот и ограничена с С- и
N-концов α-спиральными участками, состоящими также из 12-14 аминокислот и обозначенными буквами Е и F. Разные Са2+-связывающие белки могут иметь разное число центров для связывания Са2+. Кальмодулины растений имеют четыре функциональные «EF-руки» с Са2+-связывающими доменами. Связывание Са при увеличении его концентрации в цитоплазме вызывает пространственную переориентацию аминокислот в петле и α-спиралях и переупаковку этих центров, связывающих Са2+, в структуре всего КаМ-белка. Передача сигнала становится возможной, если эти конформационные перестройки «узнаются» белками-мишенями, которые, в конечном итоге, преобразуют изменения концентрации Са2+ в цитозоле в ответ на специфический сигнал (рис. 6.56, 5).
Концентрация КаМ в цитозоле может составлять 5 — 20 мкМ и варьирует в разных типах клеток. Это предполагает вероятность конкуренции за КаМ между КаМ-связывающими белками, что может играть роль в детерминировании клеточного ответа на увеличение [Са2+]цит. Взаимодействие между Са -КаМ и КаМ-регулируемыми белками главным образом гидрофобное, и даже незначительные модификации последовательностей на гидрофобном прикрепляющем участке КаМ могут лишить его возможности активировать белки-мишени.
Важное отличительное свойство Са -КаМ-комплекса — способность связываться с большим числом разнообразных белков-мишеней. Са -КаМ-комплекс активирует непосредственно или через модификацию реакций фосфорилирования-дефосфорилирования много больше 100 белков. У животных идентифицировано более 30 ферментов и других белков, которые регулируются
Са -КаМ. В растительной клетке таких белков идентифицировано охарактеризовано значительно меньше. Са -КаМ-зависимыми являются: Са -АТФазы
II В-типа; SV — вакуолярный катионный канал; НАД-киназа, глутаматдекарбоксилаза, супероксиддисмутаза; миозин V, киназин; ПКазы и ПФФаза 2В, белки кончика корня и некоторые другие (см. рис. 6.56, 5, 5а).
Мишенями, на которые передаются Са -сигналы, часто являются транспортные системы, в том числе Са2+-помпы. Са2+-АТФазы II В-типа обеспечивают регуляцию [Са ]цит, необходимую для возникновения Са2+-сигнала, определяют характер переходного состояния, связанный с завершающей стадией, и в то же время сама их активность регулируется с участием Са2+-КаМ. Са2+-АТФазы II В-типа являются компонентами не только плазмалеммы, но и эндомембран (см. рис. 6.54), и, возможно, локализованы в оболочке ядра. КаМ регулирует активность Са2+-помпы, связываясь на автоингибиторном домене С-конца, что меняет пространственное расположение этого участка и снимает его блокирующее действие. У растительных Са2+-АТФаз (по крайней мере у некоторых: АСА2 — Arabidopsis Са2+-АТФазы, локализованной на мембране ЭР, и SCA1 — soybean Са2+-АТФазы, локализованной на ПМ) КаМ-связывающий домен находится не на С-конце, а на N-терминале. У растений, как и у животных, КаМ-зависимые Са2+-АТФазы эндоплазматического ретикулума могут быть ведущими в регуляции и поддержании осцилляции и волны [Са2+]цит.
Комплекс Са2+-КаМ может включаться в каскадную передачу Са2+-сигнала, взаимодействуя с киназами, относящимися к группе кальций/кальмодулинзависимых протеинкиназ (Са2+/КаМ ПК) (см. рис. 6.56, 5а). Эти ПК имеют не четыре, как Са2+-завПК и КаМ, а три «EF-руки» на регуляторном домене. Са2+-КаМ связывается на сайте автоингибиторного домена, вследствие чего, как предполагают, происходит активирование Са2+/КаМ-протеинкиназы, которые могут выполнять специальные функции в каскадной передаче сигнала. Это обусловлено их субстратной специфичностью, субклеточной локализацией и чувствительностью к кальцию, которые не совпадают с подобными характеристиками у Са -завПК. Параллельно с митогенактивируемыми протеинкиназами (МАПК) Са /КаМ-протеинкиназы регулируют экспрессию гена, фосфо-рилируя фактор транскрипции при получении Са -сигнала (см. рис. 6.56, 5в). Действие протеинкиназ может быть нейтрализовано или обращено протеинфосфатазами. По существу, именно баланс фосфорилирования—дефосфорилирования белков регулирует многочисленные реакции и процессы в клетке и включен в систему передачи сигналов. ПФФазы (как и ПКазы) подразделяют на две большие группы по субстратной специфичности аминокислот
(серин/треонин либо тирозин) в сайте, где связывается и отщепляется фосфатная группа. В группу Сер/Тре ПФФ входит четыре семейства, среди которых ПФФазы 2В-типа являются
Са2+-КаМ-зависимыми. Сведений о ПФФазах значительно меньше, чем о ПКазах. Установлено, что они не только выполняют функции контрагентов киназ, но также играют ведущую роль во многих сигнальных каскадах: при передаче сигнала от АБК на ионные каналы в замыкающих клетках устьиц, при стрессовых ответах на патогены, при регуляции роста корневого волоска, при свето- и гравиотропизмах и т.д.
У животных наиболее изучена Са -КаМ ПФФаза кальцийнейрин (КН). В клетках A. taliana также обнаружена ПФФаза, подобная КН. Она взаимодействует с Са2+-КаМ и активируется при возникновении Са2+-сигнала. КН — гетеродимер, состоящий из консервативной каталитической субъединицы А-типа (объединена с одной из вариабельных субъединиц) и регуляторной субъединицы В-типа (КНВ, где В — буква латинского алфавита). В корнях и стебле арабидопсиса присутствует 6 изоформ КНВ, синтез одной из них активируется при действии засухи, холода, ветра. Наличие изоформ у КНВ и КаМ значительно увеличивает число возможных комбинаций при их совместном регулировании активности белков-мишеней, расширяя спектр специфичности ответов.
Функция КНВ может быть связана с прикреплением фермента к цитоскелету или мембране: это определит место в пространстве, где будет проявляться дефосфорилирующая активность. Предполагают, что КН может являться одним из компонентов трансдукона — большого комплекса разнообразных белков плазмалеммы, включенных в каскад стимул-ответ. Например, трансдуксон может служить системой поддержания и регуляции тургора и объединять рецепторы, вторичные мессенджеры, К+- и Са2+- и анионные каналы, Са2+-ПКазу и КН, Са -АТФазу и КаМ, если помпа активирована. Подобный трансдукон может быть включен в разнообразные двигательные реакции растений (устьичные движения, тропизмы, настии и т.д.). Возможно, КН — один из компонентов механизма контроля ионных потоков из среды в корни.
С реакцией дефосфорилирования связывают еще одну важную функцию — декодирование информации, зашифрованной в виде пиков и осцилляции кальциевого сигнала. Модель дешифровки этой информации предполагает совместное функционирование ПКаз и ПФФаз, имеющих разную кинетику Са -зависимой активации.
Итак, передача Са2+-сигнала на белки-мишени может происходить разными путями с участием первичных сенсоров (Са -ПКазы, КаМ) либо по более длинным каскадным путям (см. рис. 6.56). При этом через КаМ, ПК и ПФФ, имеющих множество изоформ, осуществляются специфическое декодирование Са -сигнала и передача информации к нужному белку-эффектору (мишени). Часто белками-мишенями становятся Са -каналы, Са -АТФазы и другие ионные каналы и помпы. Мишенями для сигналов, передаваемых по различным Са -зависимым сигнальным путям, могут быть отдельные ферментные системы, цитоскелетные белки, белки факторов транскрипции и др. (см. рис. 6.56).
Ответные реакции, связанные с Са -сигнализацией, ранее подразделяли на быстрые, происходящие на пост-трансляционном уровне, и медленные, связанные с экспрессией генома. В настоящее время быстрый и медленный ответы рассматриваются как разные стадии одного общего процесса адаптивной модификации метаболизма. Связанная с экспрессией генома
Са -сигнализация часто сочетается с гормональной регуляцией процессов, это еще больше осложняет расшифровку сети разных путей передачи сигнала в клетке.
