
- •Бациллы
- •Клостридии и десульфотомакулум
- •Строение
- •Механизм работы[править | править код]
- •Классификация[
- •27)Этапы фагоцитоза:
- •Классификация
- •Экзогенные антигены
- •Эндогенные антигены
- •Аутоантигены
- •Функции антител
- •Классификация
- •Живые вакцины
- •Инактивированные вакцины Корпускулярные вакцины[
- •Химические вакцины]
- •Характеристика факторов адгезии
- •Факторы вирулентности
- •Существует 2 вакцины – бцж и бцж-м. Основное их отличие – в бцж-м содержится намного меньше туберкулезных палочек, чем в бцж. Показания и способ применения вакцины бцж
- •Оральная полиомиелитная вакцина (опв)
- •Инактивированная полиомиелитная вакцина (ипв)
- •44) Динамика инфекционного процесса
- •Формы инфекционного процесса
- •Примеры поливалентных вакцин
- •Сроки вакцинации
- •55)Периоды инфекционной болезни
- •84) Возбудитель дизентерии. Разновидность шигелл, культивирование, эпидемиология, патогенез. Лаб.Диагностика, лечение и профилактика.
- •90) Принципы и современная классификация вирусов. Порядки, семейства, подсемейства, роды, виды
- •91) Вирион. Ультраструктура, химический состав, типы симметрии капсида
- •Репродукция вирусов. Стадии взаимодействия вирусов с клеткой
- •93) Методы культивирования вирусов
- •94) .Способы индикации вирусов цпд, рга, га, внутриклеточные включения.
- •95) . Способы идентификации вирусов ртга, рн, цветная реакция.
- •98) . Вирус бешенства. Культивирование, внутриклеточные включения. Лабораторная диагностика. Специфическая профилактика.
- •99). Вирус клещевого энцефалита. Свойства, экологические варианты. Механизм передачи, патогенез заболевания. Лабораторная диагностика, специфическая профилактика и лечение.
- •100). Пикорнавирусы. Классификация. Характеристика вирусов полиомиелита, Коксаки и есно. Патогенез, иммунитет. Лабораторная диагностика, специфическая профилактика полиомиелита.
- •101). Вирусы гриппа. Антигены. Классификация.Изменчивость. Патогенез заболеваний. Лабораторная диагностика. Экспресс- диагностика. Специфическая профилактика и терапия гриппа.
- •102) . Вирус парагриппа человека: свойства, заболевания, которые вызываются. Лабораторная диагностика и профилактика.
- •104. Вирус иммунодефицита человека (вич). Свойства, классификация. Источники инфекции, пути передачи. Патогенез.
- •105. Вирусы гепатитов а, пути передачи возбудителей человеку. Характеристика вирусов. Патогенез, лабораторная диагностика, лечение и профилактика.
- •106. Вирусы гепатитов е, пути передачи возбудителей человеку. Характеристика вирусов. Патогенез. Лабораторная диагностика гепатита е, лечение и профилактика.
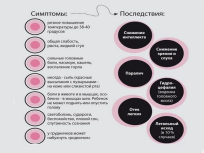
55)Периоды инфекционной болезни
Любая из инфекционных болезней, не смотря на крайнее разнообразие их проявлений, всегда проходит в своем развитии четыре периода (правда, проявляться они могут с разной степенью выраженности).
А. Первый период инфекционной болезни называется инкубационным. Продолжительность инкубационного периода для каждой инфекционной болезни имеет свою конкретную величину.
1. Возбудитель инфекции во время этого периода адгезируется (прикрепляется) на чувствительных к нему клетках макроорганизма.
2. Клиническая симптоматика отсутствует, больной в инкубационном периоде и не подозревает о своей болезни, чувствуя себя абсолютно здоровым.
3. В окружающую среду возбудитель инфекции в инкубационном периоде не выделяется (т.е. больной в этом периоде не заразен).
4. Иммунный ответ на наличие возбудителя инфекции в инкубационном периоде отсутствует (если такой иммунитет не был выработан раньше).
Б. Следующий за инкубационным период называется продромальным (в дословном переводе – период предболезни).
1. Возбудитель в продромальном периоде колонизирует чувствительные клетки (т.е. размножается на их поверхности).
2. В этом периоде появляется клиническая симптоматика, но симптомы не специфичны (общее недомогание, слабость, повышение температуры и т.п.).
3. По отношению к выделению возбудителя во внешнюю среду возможны два варианта событий.
а. При большинстве инфекционных болезней в этот период возбудитель из организма больного не выделяется.
б. Однако, при некоторых болезнях (например, при так называемых детских инфекциях) в продромальном периоде возбудитель выделяется в окружающую среду, вследствие чего больной уже в этом периоде болезни становиться заразным для окружающих.
4. Иммунный ответ в продромальном периоде инфекционной болезни отсутствует.
В. Следующий период можно обозначить как разгар болезни, хотя он, в свою очередь, классифицируется на самостоятельные отрезки, но на доклинической стадии обучения ими можно пренебречь.
1. В этом периоде происходит интенсивное размножение возбудителя и распространение его во внутренней среде макроорганизма.
2. Появляется специфическая клиническая симптоматика.
3. Возбудитель выделяется в окружающую среду.
4. Формируется иммунный ответ: появляются IgM, затем – IgG и IgA (подробнее механизмы формирования и эффекторного действия иммунного ответа будут рассматриваться в курсе иммунологии).
Г. Последний период развития инфекционной болезни носит название реконвалесцентного (термин «реконвалесценция» означает не что иное, как выздоровление).
1. Судьба возбудителя в этом периоде может быть двоякой.
а. При полном выздоровлении наступает прекращение его размножения и гибель.
б. При развитии реконвалесцентного микробоносительства неинтенсивное размножение возбудителя продолжается – до прекращения, собственно, микробоносительства.
2. Клиническая симптоматика в связи с нормализацией функций пораженных органов прекращается.
3. По отношению к выделению возбудителя во внешнюю среду, как и в случае продромального периода, возможны два варианта событий.
а. При полном выздоровлении возбудитель из организма больного, понятно, не выделяется.
б. При развитии же микробоносительства – продолжает выделяться.
4. Иммунный ответ в реконвалесцентном периоде характеризуется нарастанием титров (т.е. количества) антител (IgG и IgA), при некоторых инфекциях – развитием гиперчувствительности замедленного типа (подробнее механизмы развития иммунного ответа будут рассматриваться в курсе иммунологии).
56) Токсины бактерий их классификация и характеристика. Важную роль в развитии инфекционного процесса играют токсины. По биологическим свойствам бактериальные токсины делятся на экзотоксины и эндотоксины. Экзотоксины – белковые токсины продуцируют как грамположительные, так и грамотрицательные бактерии. По своей химической структуре это белки. По механизму действия экзотоксина на клетку различают несколько типов: 1-й тип- мембранотоксины - гемолизины, лейкоцидины; 2-й тип- функциональные блокаторы, или нейротоксины (тетаноспазмин, ботулинический токсин). Они блокируют передачу нервных импульсов в синапсах (в клетках спинного и головного мозга); 3-й тип- термостабильные и термолабильные энтеротоксины - они активизируют клеточную аденилатциклазу, что приводит к нарушению энтеросорбции и развитию диарейного синдрома. Такие токсины продуцируют холерный вибрион (холероген), энтеротоксигенные кишечные палочки; 4-й тип- цитотоксины - это токсины, блокирующие синтез белка субклеточном уровне. К ним относятся: энтеротоксин золотистых стафилококков, дерматонекротоксины стафилококков, палочек сибирской язвы, сине-зеленого гноя и возбудителя коклюша, а также антиэлонгаторы. Последние препятствуют элонгации (наращиванию) или транслокации, т. е. передвижению и-РНК вдоль рибосомы, и тем самым блокируют синтез белка. К антиэлонгаторам относят дифтерийный гистотоксин, токсин синегнойной палочки; 5-й тип- эксфолиатины, образуемые некоторыми штаммами золотистого стафилококка, и эритрогенины, продуцируемые пиогенным стрептококком группы А. Они влияют на процесс взаимодействия клеток между собой и с межклеточными веществами, и полностью определяют клиническую картину инфекции. В первом случае возникает пузырчатка новорожденных, во втором - скарлатина. Механизм действия белковых токсинов сводится к повреждению жизненно важных процессов в клетке: повышение проницаемости мембран, блокады синтеза белка и других биохимических процессов в клетке или нарушении взаимодействия и взаимокоординации между клетками. Экзотоксины являются сильными антигенами, которые и индуцируют образование в организме антитоксинов. По степени связи с бактериальной клетки экзотоксины делятся условно на три класса. • Класс А - токсины, секретируемые во внешнюю среду; • Класс В - токсины частично секретируемые и частично связанные с микробной клеткой; • Класс С - токсины, связанные и с микробной клеткой и попадающие в окружающую среду при разрушении клетки. Экзотоксины обладают высокой токсичностью. Под воздействием формалина и температуры экзотоксины утрачивают свою токсичность, но сохраняют иммуногенное свойство. Такие токсины получили название анатоксины и применяются для профилактики заболевания столбняка, гангрены, ботулизма, дифтерии, а также используются в виде антигенов для иммунизации животных с целью получения анатоксических сывороток. По отношению к t различают: термолабильные и термостабильные белковые токсины. Все экзотоксины состоят из 2х составных частей: 1 ая- рецептор и служит для фиксации молекулы токсина на соответствующей « клетке- мишени» 2ая- собственно токсический фрагмент- проникает внутрь клетки, блокирую жизненно важные метаболические реакции. Эндотоксины по своей химической структуре являются липополисахаридами, которые содержатся в клеточной стенке грамотрицательных бактерий и выделяются в окружающую среду при лизисе бактерий. Эндотоксины не обладают специфичностью, термостабильны, менее токсичны, обладают слабой иммуногенностью. При поступлении в организм больших доз эндотоксины угнетают фагоцитоз, гранулоцитоз, моноцитоз, увеличивают проницаемость капилляров, оказывают разрушающее действие на клетки. Микробные липополисахариды разрушают лейкоциты крови, вызывают дегрануляцию тучных клеток с выделением вазодилататоров, активируют фактор Хагемана, что приводит к лейкопении, гипертермии, гипотонии, ацидозу, диссеминированной внутрисосудистой коагуляции (ДВК). Эндотоксины стимулируют синтез интерферонов, активируют систему комплемента по классическому пути, обладают аллергическими свойствами. При введении небольших доз эндотоксина повышается резистентность организма, усиливается фагоцитоз, стимулируются В-лимфоциты. Сыворотка животного иммунизированного эндотоксином обладает слабой антитоксической активностью и не нейтрализует эндотоксин. Патогенность бактерий контролируется тремя типами генов: гены - собственной хромосомами, гены, привнесенные плазмидами и умеренными фагами.
57) Стафилококки, их роль в патологии человека. Методы микробиологической диагностики стафилококковых заболеваний. Род Staphylococcus имеет 28 видов, из них 14 обитают на коже и слизистых оболочках. Некоторые виды вызывают заболевания у человека, чаще всего это: S. aureus (золотистый), S. epidermidis (эпидермальный), S. saprophiticus (сапрофитический). Морфология. Сферическая форма, гроздевидное расположение (греч. – staphylos – гроздь). Спор нет. Неподвижны. Грамположительны. Факультативные анаэробы. Хемоорганотрофы. Растут на обычных средах, могут расти в присутствии 6-10% NaCl. Колонии пигментированы. Биохимически активны. Каталазоположительны. Оксидазоотрицательны. Содержат цитохромы. Обитают на кожных и слизистых покровах человека и животных. Выделяют различные экологические варианты. Особенными свойствами обладают больничные эковары возбудителей. Устойчивость Наиболее устойчивы из бактерий не образующих споры. Хорошо переносят высушивание (до 50 дней при комнатной температуре). УФО убивает за 10-12 часов, кипячение за секунды. Устойчивы к NaCl, жирным кислотам, кислой рН. (обеспечивает питание на коже) Внутрибольничные штаммы (особенно S. aureus) характеризуются повышенной устойчивостью к антибиотикам, антисептикам и дезинфектантам.
Факторы патогенности: 1) Капсула → Подавление фагоцитоза 2) Белок А → Взаимодействие с Fc-фрагментом антител, сенсибилизация 3) Пептидогликан → Стимуляция продукции эндогенных пирогенов, хемоатрактант лейкоцитов (формирование абсцессов) 4) Тейховые кислоты → Связывают фибронектин 5) Мембранотоксины, или гемолизины (альфа-, бета-, гамма-, дельта-токсины), лейкоцидин → Токсичны для многих клеток, включая эритроциты, лейкоциты, макрофаги, фибробласты. Альфа-токсин – пример порообразующего токсина 6) Эксфолиативный токсин (А,В) → Вызывает синдром «ошпареной кожи», разрушая клеточные контакты – десмосомы в гранулярном слое эпидермиса. Суперантиген 7) Токсин синдрома токсического шока → Нейротропные, вазотропные эффекты. Суперантиген 8) Энтеротоксины (А-Е) → Действие на энтероциты (пищевая интоксикация). Нейротропные эффекты Суперантиген. 9) Плазмокоагулаза → Перевод фибриногена в фибрин, препятствующему контакту с фагоцитами 10) Гиалуронидаза → Разрушение соединительной ткани 11) Липаза, лецитиназа → Гидролиз липидов, лецитина 12) Фибринолизин → Разрушение фибриновых сгустков 13) Дезоксирибонуклеаза → Расщепление ДНК, расжижение гноя 14) Кератиноидные ферменты → Инактивация бактерицидных форм кислорода 15) Устойчивость с NaCl, жирным кислотам → Размножение в потовых и сальных железах.
Механизмы передачи: Контактный (основной), Аэрозольный, Фекально-оральный Заражение может проходить как экзогенным, так и эндогенным путем
Патогенез и заболевания человека. От людей выделены следующие виды стафилококков: S. aureus, S. epidermidis, S. capitis, S. caprae, S. saccharolyticus, S. warneri, S. pasteuri, S. haemolyticus, S. hominis, S. lugdunensis, S. auricularis, S. saprophyticus, S. cohnii, S. xylosus и S. simulans. S. schleiferi вызывает тяжёлые инфекции у человека, S. intermedius вызывает заболевания у людей при укусе собаками.
Стафилококки вызывают большое количество гнойно-воспалительных заболеваний в любом органе или ткани макроорганизма. Обычно они вызывают абсцессы и фурункулы на коже и продуцируют большое количество метаболитов разной степени токсичности. Коагулазоположительные виды золотистого стафилококка в настоящее время являются главной причиной заболеваемости и смертности. Инфекции, вызванные золотистым стафилококком, часто острые и гноеродные, при отсутствии лечения распространяются в окружающие ткани или, при бактериемии, формируют гнойные метастазы в других органах. Золотистые стафилококки вызывают поражения кожи - фурункулы, целюллит, импетиго, синдром “ошпаренной” кожи, послеоперационные нагноения ран различной локализации. Другими заболеваниями являются бактериемия, пневмония, остеомиелит, острый эндокардит, миокардит, перикардит, цервицит, энцефалит, менингит, абсцессы мышц, мочеполового тракта, центральной нервной системы и органов брюшной полости. Пищевое отравление возникает вследствие действия стафилококкового энтеротоксина.
Синдром токсичного шока - это острое заболевание с возможным смертельным выходом, возникающее вследствие инфицирования золотистым стафилококком (обычно фагогруппы I). Заболевание характеризуется признаками острой интоксикации (лихорадка, снижение артериального давления, скарлатиноподобная сыпь) и в большинстве случаев его возникновение связано с использованием гигиенических тампонов с высокой степенью адсорбции при менструации. Развитие синдрома токсического шока, вызванного стафилококками, вызывает экзотоксин, который является суперантигеном, в связи с его способностью к повышенной стимуляции Т-хелперов, что сопровождается значительным выбросом в кровь цитокинов (интерлейкина-2, фактора некроза опухоли- и гамма-интерферона), что ведет к острому системному заболеванию, появлению клинических признаков шока и даже смерти.
Группа коагулазоотрицательных стафилококков является основным компонентом нормальной микрофлоры кожи человека. S. epidermidis был изолирован от пациентов с бактериемией, сердечными инфекциями, искусственными суставами и ортопедическими приспособлениями, перитонитом при продолжительном амбулаторном перитонеальном диализе.
S. saprophyticus является важным оппортунистическим патогеном при инфекциях мочевыделительного тракта человека. S. haemolyticus ассоциируют с эндокардитом, септицемией, перитонитом, инфекциями мочевыделительного тракта, инфекциями костей, суставов и ран. S. hominis, S. warneri, S. capitis, S. simulans, S. cohnii, S. xylosus и S. saccharolyticus связывают с развитием многих инфекций. S. lugdiunensis вызывает развитие эндокардита и при вшивании искусственных клапанов, септицемии, мозговых абсцессов, хронических остеоартритов, инфекций мягких тканей, костей, перитонеальной жидкости и катетеров. S. scheiferi связывают с развитием эмпиемы головного мозга, раневыми инфекциями, бактериемией и остеитом, а также с инфекциями катетеров.
Иммунитет. Характерным симптомом стафилококковых инфекций является развитие вялого хронического течения или рецидивов. Это позволяет предположить, что иммунитет после перенесенных стафилококковых заболеваний является нестойким и кратковременным. Иммунитет после стафилококковых заболеваний возникает благодаря фагоцитозу и наличию антител (антитоксинов, преципитинов, опсонинов и агглютининов). При стафилококковом эндокардите появляются криоглобулины и циркулирующие иммунные комплексы. При химиотерапевтическом лечении стафилококковых инфекций уровень циркулирующих иммунных комплексов снижается. Наличие в тканях и органах человека антигенов, сходных со стафилококками (явление антигенной мимикрии) также предопределяет слабый иммунный ответ. Это вызывает иммунную толерантность к стафилококкам и их токсинам, которые обеспечивает благоприятные условия для неограниченной репродукции возбудителя в организме человека. Широкое использование антибиотиков способствует интенсивной селекции стафилококковых штаммов, резистентных к природным угнетающим факторам.
Лабораторная диагностика. Забор материала для исследования зависит от типа поражения (например, гной при гнойных поражениях, мокрота при инфекциях дыхательных путей). В случае пищевого отравления собирают испражнения и остатки подозрительных пищевых продуктов. Для выявления носителей стафилококков делают мазок из носовой полости; в некоторых особых случаях необходимо брать мазки с промежности, кусочки волос и пупковой культи. Общие микробиологические принципы забора, транспортировки и хранения материала приемлемы для стафилококков, никакие специальные методы или осторожность не нужны при изучении этих микробов, поскольку их легко выделить из клинического материала при различной локализации инфекций, и они являются относительно стойкими к высушиванию и умеренным изменениям температуры. Некоторые штаммы могут нуждаться в анаэробных условиях или наличии оксида углерода для роста, но эти штаммы выдерживают транспортировку и кратковременное хранение в аэробных условиях.
Независимо от вида образца, материал следует засевать на кровяной агар и на жидкую среду (тиогликолевый бульон). На кровяном агаре густой рост стафилококков происходит через 18-24 часа. Для последующего исследования в настоящее время можно брать только отдельные колонии (например, от пациентов с острыми инфекциями). Поскольку большинство видов невозможно дифференцировать на основании изучения морфологии колоний, которые выросли в течение 24-часовой инкубации, колонии следует выращивать в течение еще 2-3 суток до того, как первичная изоляция будет подтверждена установлением вида или штамма. Бактерии из колонии следует окрасить по Граму, повторно культивировать и изучить родовые и видовые особенности (а по возможности - и особенности штамма).
Большинство стафилококков, которые имеют медицинское значение, хорошо растут в анаэробных условиях тиогликолевого бульона или полужидкого агара. Материал из сильно загрязненных источников, таких, как испражнения, следует также параллельно засевать на селективную среду (агар, содержащий маннитол, соль, липазу и др.). Подобные среды угнетают рост грамотрицательных бактерий, но стафилококки на них растут.
Виды стафилококков можно идентифицировать на основе изучения фенотипических признаков. Большинство клинически значимых видов можно идентифицировать на основе молекулярных фенотипических признаков, таких, как содержание клеточных жирных кислот, ферментов и полипептидов, а также на основе генотипических признаков, таких, как рестрикционные фрагменты хромосом и риботипы.
Способность коагулировать плазму остается наиболее широко используемым и общепринятым критерием для идентификации патогенных стафилококков, которые вызывают острые инфекции (золотистый стафилококк, S. intermedius, S. hyicus). Можно использовать 2 различных теста на коагулазу: в пробирках (свободная коагулаза) и на предметном стекле (связанная коагулаза, или фактор свёртывания).
Термостабильная нуклеаза стафилококков, которая имеет эндо- и экзонуклеолитические свойства и может расщеплять ДНК и РНК, продуцируется большинством штаммов S. aureus, S. schleiferi, S. intermedius, S. hyicus. Нуклеазу можно выявить с помощью метода диффузии из метахромного агара и агара, который содержит краситель толуидиновый голубой и ДНК (за 4 часа). С помощью различных коммерческих тестов можно выявить фосфатазу, пиролидонил-ариламилазу, орнитин, уреазу, бета-галактозидазу. Несколько производителей коммерческих наборов для идентификации и автоматических систем производят тесты для простой и быстрой идентификации большого количества видов стафилококков с точностью 70-90 %. В европейских странах наиболее широко используют STAPHYtest-16 (Lachema, Чехия). Дополнительные коммерческие тесты позволяют выявить активность коагулазы, фактора свертывания, орнитин-декарбоксилазы), рост в тиогликолевой среде и устойчивость к новобиоцину.
Для выявления чувствительности к новобиоцину и дифференцирования S. saprophyticus от других клинически важных штаммов используют метод диск-диффузии в кровяном агаре (с дисками, которые содержат 5 мкг новобиоцина). Резистентность к новобиоцину присуща только S. saprophyticus и некоторым другим видам, но не встречается у других клинически важных видов.
Исследуют также чувствительность стафилококков к полимиксину В с использованием дисков, каждый из которых содержит 300 ЕД полимиксина; штамм считают резистентным, если зона задержки роста меньше 10 мм. Резистентными к полимиксину В обычно являются S. aureus, S. eridermidis, S. hyicus, S. chromogenes.
В некоторых лабораториях используют фаготипирование с помощью международного набора фагов. Штамм, который необходимо типировать, засевают на поверхность питательного агара для получения тотального роста. После высушивания на поверхность агара наносят фаги в определенной концентрации в определенные квадраты. Инкубируют в течение 12 часов, после чего определяют, произошел ли лизис бактерий под влиянием тех или других фагов. Фаготип штамма помечают номером фага, который его разрушил. Таким образом, если штамм разрушают только фаги 52, 79 и 80, его называют фаготипом 52/79/80. Фаготипирование имеет большое значение в эпидемиологических исследованиях стафилококковых инфекций.
Стафилококковые инфекции часто развиваются: 1) на фоне других заболеваний (вторичные инфекции), например, после гриппа или других вирусных инфекций 2) в медицинских учреждениях (внутрибольничные инфекции)
Заболевания: более 100 нозологических форм. Основной возбудитель – S. Aureus • Местные нагноительные процессы • Заболевания костей и суставов • Поражения внутренних органов: пневмонии (у детей и пожилых людей), поражения почек (пиелонефрит), цистит (часто S. epidermidis и S. saprophiticus) • Перитонит. После операций на органах брюшной полости. • Поражения ЦНС • Сепсис. Септикопиемия. • Синдром токсического шока. • Синдром «ошпаренных младенцев». У новорожденных детей (инфицирование через пупочную вену) происходит отслоение кожи с пузырями, интоксикация. У старших детей – синдром «ошпаренной кожи» (эритема, пузыри, интоксикация). • Пищевые отравления.
Микробиологическая диагностика Материал для исследования - кровь, гной, слизь из носа и зева, отделяемое ран, мокрота (при пневмонии), испражнения (при колите), подозрительные продукты, рвотные массы и промывные воды желудка, испражнения - при пищевых интоксикациях. бактериологическая диагностика, то есть выделение чистой культуры и идентификацияю. Материал от больных и бактерионосителей засевают немедленно или не позднее 3-4 ч после взятия при условии хранения его на холоде. делают посевы на кровяной агар и элективные для стафилококков среды или молочно-желтково-солевой агар. Чашки с посевами инкубируют при 37 ° С в течение 48 часов. На второй день производят высев из сахарного бульона на указанные элективные среды, исследуют массивность роста и характер колоний после посевов других материалов. На кровяном агаре стафилококки образуют непрозрачные, слегка выпуклые колонии средних размеров с гладкой, блестящей, словно полированной поверхностью, четко очерченным краем, маслянистой консистенции. Бактериоскопический. Из патологического материала готовят мазки, окрашивают по Граму, микроскопируют. Прямая микроскопия позволяет дать только предварительный ответ. Одновременно сеют материал в чашки с кровяным, молочно-солевым и желточно-солевым агаром. Выявляют летальные свойства культуры на кроликах и проводят дерматонекротическую пробу.
58) Стрептококки, их роль в патологии человека. Методы микробиологической диагностики стафилококковых заболеваний. Стрептококки относятся к семейству Streptococcaceae, роду Streptococcus.
По биохимическим свойствам выделяют 21 вид. Большинство из них условно-патогенные.
Наибольшее значение в развитии инфекционных заболеваний имеют:
1) S. pyogenus, возбудитель специфической стрептококковой инфекции;
2) S. pneumonia, возбудитель пневмонии, может вызывать ползучую язву роговицы, отиты, сепсис;
3) S. agalactia, может входить в состав нормальной микрофлоры влагалища; инфицирование новорожденных приводит к развитию у них сепсиса и менингита;
4) S. salivarius, S. mutans, S. mitis, входят в состав нормальной микрофлоры полости рта; при дисбиозе ротовой полости являются ведущими факторами в развитии кариеса.

 Микробиологическая
диагностика. Материал для исследования
– гной, моча, кровь, мокрота.
Бактериоскопический метод: окраска по
Граму мазков из патологического
материала. При положительном результате
обнаруживают цепочки грам «+» кокков.
Бактериологический метод: Исследуемый
материал засевают на кровяной агар в
чашку Петри. После инкубации при 37 °С в
течение 24 ч отмечают характер колоний
и наличие вокруг них зон гемолиза. Из
части материала, взятого из колоний,
готовят мазок, окрашивают по Граму и
микроскопируют. Для получения чистой
культуры 1—3 подозрительные колонии
пересевают в пробирки со скошенным
кровяным агаром и сахарным бульоном.
На кровяном агареStreptococcuspyogenesобразует
мелкие мутноватые круглые колонии. В
бульоне стрептококк дает придонно-пристеночный
рост в виде хлопьев, оставляя среду
прозрачной. По характеру гемолиза на
кровяном агаре стрептококки делятся
на три группы: 1) негемолитические; 2)
а-гемолитиче-ские 3) β-гемолитические,
образующие вокруг колонии полностью
прозрачную зону гемолиза. Заключительным
этапом бактериологического исследования
является идентификация выделенной
культуры по антигенным свойствам. По
данному признаку все стрептококки делят
на серологические группы (А, В, С, D и т.
д.). Серогруппу определяют в реакции
преципитации с полисахаридным
преципитиногеном С. Серовар определяют
в реакции агглютинации. Выявленную
культуру стрептококка проверяют на
чувствительность к антибиотикам методом
дисков. Серодиагностика: устанавливают
наличие специфических антигенов в крови
больного с помощью РСК или реакции
преципитации. Антитела к О-стрептолизину
определяют для подтверждения диагноза
ревматизма.
Микробиологическая
диагностика. Материал для исследования
– гной, моча, кровь, мокрота.
Бактериоскопический метод: окраска по
Граму мазков из патологического
материала. При положительном результате
обнаруживают цепочки грам «+» кокков.
Бактериологический метод: Исследуемый
материал засевают на кровяной агар в
чашку Петри. После инкубации при 37 °С в
течение 24 ч отмечают характер колоний
и наличие вокруг них зон гемолиза. Из
части материала, взятого из колоний,
готовят мазок, окрашивают по Граму и
микроскопируют. Для получения чистой
культуры 1—3 подозрительные колонии
пересевают в пробирки со скошенным
кровяным агаром и сахарным бульоном.
На кровяном агареStreptococcuspyogenesобразует
мелкие мутноватые круглые колонии. В
бульоне стрептококк дает придонно-пристеночный
рост в виде хлопьев, оставляя среду
прозрачной. По характеру гемолиза на
кровяном агаре стрептококки делятся
на три группы: 1) негемолитические; 2)
а-гемолитиче-ские 3) β-гемолитические,
образующие вокруг колонии полностью
прозрачную зону гемолиза. Заключительным
этапом бактериологического исследования
является идентификация выделенной
культуры по антигенным свойствам. По
данному признаку все стрептококки делят
на серологические группы (А, В, С, D и т.
д.). Серогруппу определяют в реакции
преципитации с полисахаридным
преципитиногеном С. Серовар определяют
в реакции агглютинации. Выявленную
культуру стрептококка проверяют на
чувствительность к антибиотикам методом
дисков. Серодиагностика: устанавливают
наличие специфических антигенов в крови
больного с помощью РСК или реакции
преципитации. Антитела к О-стрептолизину
определяют для подтверждения диагноза
ревматизма.
59) Менингококки, биологические свойства, патогенез у человека. Менингококковая инфекция — острая инфекционная болезнь, характеризующаяся поражением слизистой оболочки носоглотки, оболочек головного мозга и септицемией; антропоноз. Относятся к роду Neisseria, род N. meningitidis. Мелкие диплококки. Характерно расположение в виде пары кофейных зерен, обращенных вогнутыми поверхностями друг к другу. Неподвижны, спор не образуют, грамотрицательные, имеют пили, капсула непостоянна. Культуральные свойства. Относятся к аэробам, культивируются на средах, содержащих нормальную сыворотку или дефибринированную кровь лошади, растут на искусственных питательных средах, содержащих специальный набор аминокислот. Элективная среда должна содержать ристомицин. Повышенная концентрация СО2 в атмосфере стимулирует рост менингококков.
Менингококки требовательны к питательным средам – растут только на средах, содержащих человеческий белок (сывороточный агар, асцит-агар), при температуре 37 °C. На сывороточном агаре образуют нежные прозрачные колонии средней величины. В сывороточном бульоне дают рост в виде помутнения и осадка на дне.
Биохимически малоактивны, ферментируют только глюкозу и мальтозу, образуя кислоту, но не образуя газ. Крайне неустойчивы во внешней среде, чувствительны к перемене температуры, погибают при температуре ниже 37 °C.
По капсульному полисахаридному антигену менингококки подразделяют на четыре основные серогруппы (группы А, В, С, D) и три дополнительные (X, Y, Z).
Факторы вирулентности менингококков:
1) адгезины – фимбрии (пили);
2) эндотоксин; защищает от внутриклеточного переваривания, обеспечивая незавершенность фагоцитоза; за счет незавершенности фагоцитоза происходит внутриклеточное размножение возбудителя;
3) ферменты агрессии – гиалуронидаза, нейраминидаза;
4) поверхностные белки, обладающие антилизоцимной активностью;
5) сидерофоры – это клеточные включения, активно связывающие трехвалентное железо, конкурируя с эритроцитами.
Менингококки патогенны только для человека.Менингококковая инфекция – антропонозная инфекция, источником является больной (или бактерионоситель). Основной путь передачи – воздушно-капельный.
Клинические формы могут быть различными: менингококковый назофарингит, цереброспинальный менингит, менингококцемия (менингококковый сепсис), менингококковый эндокардит и др.
После перенесенного заболевания формируется стойкий видоспецифический антимикробный иммунитет. У детей младшего возраста имеется пассивный иммунитет, обусловленный полученными от матери IgG.
Человек — единственный природный хозяин менингококков. Носоглотка служит входными воротами инфекции, здесь возбудитель может длительно существовать, не вызывая воспаления (носительство). Механизм передачи инфекции от больного или носителя воздушно-капельный. Инкубационный период составляет 1—10 дней (чаще 2—3 дня). Различают локализованные (назофарингит) и генерализованные (менингит, менингоэнцефалит) формы менингококковой инфекции. Из носоглотки бактерии попадают в кровяное русло (менингококкемия) и вызывают поражение мозговых и слизистых оболочек с развитием лихорадки, геморрагической сыпи, воспаления мозговых оболочек. Иммунитет. Постинфекционный иммунитет при генерализованных формах болезни стойкий, напряженный.
60) Осложнение менингита, лаб.диагностика, лечение и профилактика. В среднем последствия после менингита наблюдаются у 10-30% пациентов, перенесших данное заболевание, большую часть составляют дети дошкольного возраста и взрослые люди старше 60. Неврологические осложнения после менингита разделяются на ранние и поздние. К ранним относят:
-
Повышенное внутричерепное давление.
-
Эпилептические припадки.
-
Тромбозы венозной или артериальной сети.
-
Субдуральный выпот – скопление жидкости под твердой мозговой оболочкой.
-
Гидроцефалия (водянка головного мозга).
-
Повреждения черепно-мозговых нервов.
Поздние осложнения включают в себя:
-
Остаточные явления очагового неврологического дефицита.
-
Эпилепсия.
-
Слабоумие.
-
Нейросенсорная тугоухость.
Помимо неврологической симптоматики, менингит может осложниться и другими системными поражениями, такими, как: сепсис, эндокардит, пневмония, ТЭЛА (тромбоэмболия легочной артерии), гнойный артрит.
Микробиологическая диагностика: Материал для исследования - кровь, спинномозговая жидкость, носоглоточные смывы. Бактериоскопический метод – окраска мазков из ликвора и крови по Граму для определения лейкоцитарной формулы, выявления менингококков и их количества. Наблюдают полинуклеарные лейкоциты, эритроциты, нити фибрина, менингококки – грам «-», окружены капсулой. Бактериологический метод – выделение чистой культуры. Носоглоточная слизь, кровь, ликвор. Посев на плотные, полужидкие питательные среды, содержащие сыворотку, кровь. Культуры инкубируют в течение 20 ч. При 37С с повышенным содержанием СО2.Оксидазаположительные колонии – принадлежат в данному виду. Наличие N.meningitidis подтверждают образованием уксусной кислоты при ферментации глк. и мальтозы. Принадлежность к серогруппам – в реакции агглютинации (РА). Серологический метод – используют для обнаружения растворимых бактериальных АГ в ликворе, или АТ в сыворотке крови. Для обнаружения АГ применяют ИФА,РИА. У больных, перенесших менингококк – в сыворотке специфические АТ: бактерицидные, аггютинины, гемаггютинины. Лечение. В качестве этиотропной терапии используют антибиотики - бензилпенициллин (пенициллины, левомицетин, рифампицин), сульфамиды. Профилактика. Специфическую профилактику проводят менингококковой химической полисахаридной вакциной серогруппы А и дивакциной серогрупп А и С по эпидемическим показаниям. Неспецифическая профилактика сводится к соблюдению санитарно-противоэпидемического режима в дошкольных, школьных учреждениях и местах постоянного скопления людей.
61) Гонококки, биологические свойства, заболевания у человека, микробиологическая диагностика, лечение и профилактика. Семейство – Neisseriaceae Род – Neisseria Вид – N. Gonorrhoeae В свежих культурах гонококки представляют собой диплококки бобовидной формы, размером 1,25-1,0 х 0,7-0,8 мкм., образующие микрокапсулу. Жгутиков не имеют, спор не образуют. Хорошо окрашиваются анилиновыми красителями (метиленовым синим, бриллиантовым зеленым и др.). По Граму окрашиваются отрицательно. Образуют L- формы, в том числе и под действием пенициллина. Под влиянием химиопрепаратов могут быстро менять свойства и образовывать грамположительные формы. По наличию пилей гонококки разделяются на 5 типов. Ранее их обозначали Т1-Т5, сейчас Р+,Р++, Р+++… Бактерии типов Р+,Р++ снабжены нитями, имеют капсулу и вирулентны, бактерии прочих типов авирулентны. В составе клеточной мембраны (стенки) содержится до 60 % белка I, на его основе осуществляется серотипирование гонококком методом ИФА. Кроме белка I, имеется белок II, который определяет специфичность клинических проявлений заболевания. Культуральные свойства. По типу дыхания - аэробы. Хемоорганотрофы. Требовательны к питательным средам. Растут на свежеприготовленных, влажных питательных средах с добавлением нативного белка (кровь, сыворотка, асцитическая жидкость). Оптимум рН 7,2-7,4; температуры - 370С. Большинство свежевыделенныхштаммов для роста нуждаются в присутствии в атмосфере 4-10% СО2. При дальнейшем культивировании эти свойства утрачиваются. На плотных питательных средах через 24 часа инкубирования гонококки, содержащие в клеточной стенке белок II, образуют прозрачные колонии в виде капелек росы (диаметром 1-3 мм) с ровным краем. На жидких питательных средах растут диффузно и образуют поверхностную пленку, через несколько дней оседающую на дно. Биохимическая активность. Гонококки разлагают только глюкозу с образованием кислоты, образуют каталазу и цитохромоксидазу – типичные для нейссерий ферменты. Протеолитических свойств не имеют (аммиак, сероводород, индол не образуют), не вызывают гемолиза на кровяном агаре, на средах с добавлением молока, желатина и картофеля не растут. Антигенная структура. Антигенная структура гонококков изучена недостаточно, она неоднородна и меняется у дочерних популяций. Очевидно, что экспрессия некоторых антигенов гонококка определяется изменением условий окружающей среды. Во многом это явление связано с тем, что основную антигенную нагрузку несут детерминанты пилей и поверхностных белков, распознаваемых иммунокомпетентными клетками. Гонококки имеют ряд механизмов, снижающих эффективность иммунных реакций, в том числе и за счет изменения антигенной структуры. Основную роль играют фазовые вариации, заключающиеся в изменении или прекращении образования некоторых антигенных детерминант, и антигенные вариации, основанные на изменении структуры распознаваемых антигенов за счет включения новых детерминант. Антигены гонококков: а) капсульные антигены; б) пили; в) белки клеточной оболочки – на их основании выделяют 16 антигенных серотипов; г) липополисахариды. Факторы патогенности. Токсины. Гонококки не продуцируют экзотоксинов. Клеточная стенка содержит липополисахарид – эндотоксин, который оказывает токсическое воздействие. - Структурные и химические компоненты: а) капсула – обладает антифагоцитарным свойством, препятствует прямому контакту бактерицидных веществ с клеточной стенкой, маскирует ее антигенные детерминанты; б) пили – обеспечивают адгезию гонококков к клеткам эпителия, что имеет решающее значение в развитии инфекции; в) Ig А1 – протеаза. Гонококки синтезируют Ig А1 – протеазу, действующую внеклеточно и разрушающую пропин-треониновые связи в тяжелых цепях Ig, а также расщепляющую молекулу Ig в шарпирной части. Эти эффекты инактивируют антитела, препятствующие адгезии, что облегчает приклепление гонококков к рецепторам эпителиальных клеток, а также защищает их от фагоцитоза, опосредованного антителами; г) способность к синтезу β – лактамаз. Патогенез Гонорея – инфекционное венерическое заболевание, проявляющееся воспалением слизистых оболочек преимущественно половых путей. Термин гонорея (от греч. gone – семя, +rhoia – истечение) ввел К. Гален во II в. н.э. В настоящее время гонорея – одно из наиболее распространенных инфекционных заболеваний. Гонококки поражают, в основном, клетки цилиндрического эпителия. У новорожденных могут вызывать бленнорею (конъюктивит). При экстрагенитальной локализации могут поражать прямую кишку и миндалины. Они прикрепляются к цилиндрическому эпителию уретры, влагалищной части шейки матки, прямой кишки, конъюктивы глаза, а также к сперматозоидам и простейшим (трихомонады, амебы). Адгезия происходит за счет пилей и белков наружной мембраны клеточной стенки. Характерной особенностью гонококков является их способность проникать в лейкоциты и размножаться в них. Липополисахаридная часть клеточной стенки бактерий оказывает токсическое действие на организм человека. Капсулярные полисахариды подавляют фагоцитоз. Соединяясь с ворсинками цилиндрического эпителия слизистой уретры, а у женщин - и эндоцервикального канала, гонококки проникают внутрь клетки при участии белков наружной мембраны клеточной стенки. Это приводит к развитию острого уретрита, цервицита и поражению у женщин шейки матки, воспалению придатков (трубы, яичники), у мужчин происходит воспаление семенных семенных пузырьков, предстательной железы. Иммунитет. После перенесенного заболевания иммунитет не вырабатывается. Врожденная невосприимчивость к гонорее отсутствует, возможны супер- и реинфекции. Единственный чувствительный организм – человек. До сих пор остается неясным вопрос, почему антитела, определяемые в сыворотке больного (агглютинины, преципитины, опсонины), не обеспечивают защиту от повторного заражения. Профилактика. Средства специфической иммунопрофилактики отсутствуют, что обусловлено высокой антигенной изменчивостью гонококков. Гоновакцина, на которую возлагалось много надежд, оказалась неэффективной. Общая профилактика основана на мерах предупреждения венерических заболеваний. Для предупреждения гонобленореи новорожденным сразу после рождения закапывают в конъюктивальный мешок (девочкам также в половую щель) 1-2 капли раствора сульфацила натрия или антибиотика (пенициллины, цефалоспарины) Лечение. Основу терапии составляет антимикробная терапия. Препараты выбора – сульфаниламиды и антибиотики, подавляющие жизнедеятельность гонококков (β – лактальные антибиотики, аминогликозиды). Для лечения хронических или осложненных форм гонореи используют гоновакцину.
Микробиологическая диагностика. Бактериоскопическое исследование: Материалом для исследования служит гнойное отделяемое из уретры, влагалища, примой кишки, глотки, сыворотки крови. Готовят мазки, окраска по Граму, При «+» результате – обнаруживают гонококки – грам+ диплококки бобовидной формы., находятся внутри лейкоцитов. Положительный диагноз ставится при острой форме гонореи до применения антибиотиков. Бактериологическое исследование.Материал засевают на чашки Петри со специальными питательными средами — КДС, сывороточным агаром. Среда КДС содержит питательный агар с добавлением в определенной концентрации казеина, дрожжевого экстракта и сыворотки крови. Посевы инкубируют при 37°С в течение 24—72 ч. Гонококки образуют круглые прозрачные колонии, напоминающие капли росы, в отличие от более мутных колоний стрептококков или пигментированных колоний стафилококков, которые также могут расти на этих средах. Подозрительные колонии пересевают в пробирки на соответствующие среды для получения чистых культур, которые идентифицируют по сахаролитическим свойствам на средах «пестрого» ряда (полужидкий агар с сывороткой и углеводом). Гонококк ферментирует только глюкозу с образованием кислоты.. Серодиагностика. В некоторых случаях ставят РСК Борде — Жангу. В качестве антигена используют взвесь убитых гонококков. Реакция Борде—Жангу имеет вспомогательное значение при диагностике гонореи. Она положительна при хронической и осложненной гонорее.
62) Возбудитель дифтерии, биологические свойства. Патогенез, клинические формы и клиника дифтерии. Возбудитель дифтерии - Corynebacterium diphtheriae. Коринебактерии дифтерии - это тонкие плеоморфные палочки длиной 3-6 мкм, шириной 0,6-0,8 мкм с булавовидными утолщениями на одном или обоих концах. Они не образуют спор и капсул, неподвижны, грамположительные, но легко обесцвечиваются. Клетки часто образуют септы, часто наблюдают разветвления. Внутри клеток расположены полиметафосфатные гранулы, которые лучше окрашиваются по Граму, чем остальная бактериальная клетка. При окраске по Леффлеру метиленовым синим гранулы приобретают лазурно-пурпурный цвет, в связи с чем они получили название метахроматических гранул (или волютиновых, или зёрен Бабеша-Эрнста). Часто они расположены на полюсах бактерий и их называют полярными телами. Специальные методы окраски (по Альберту, Нейссеру и Пондеру) позволяют чётко продемонстрировать их наличие. В мазках коринебактерии дифтерии располагаются достаточно характерно - парами или небольшими группами, под острым или прямым углом, в виде латинских букв V и L. Подобное расположение часто называют “китайскими буквами” или “клиновидным”. Это происходит вследствие неполного отделения дочерних клеток после бинарного деления. Вирулентные штаммы дифтерийных бактерий продуцируют очень мощный экзотоксин, который предопределяет их патогенность. Почти все штаммы gravis и intermedius (95-99 %) являются токсигенными, тогда как штаммы mitis - только в 80-85 % случаев, но это зависит от происхождения культуры: штаммы весь трех типов одинаково вирулентны при выделении их от больных острыми формами, а невирулентные штаммы обычно выделяют от переболевших дифтерией лиц, носителей и людей, которые имели контакты с больными. Интенсивность продукции токсина также различна у разных штаммов, но химический состав токсинов одинаковый. Штамм, универсально используемый для продукции токсина, называют штамм Park Williams 8, был описан разными исследователями как mitis и intermedius. Дифтерийный токсин является белком с молекулярной массой около 62000. Он очень сильный, летальная доза для морской свинки массой 250 г составляет 10-14 мг. Он состоит из двух фрагментов - А и В с молекулярной массой, соответственно, 24000 и 38000. Для токсического действия необходимы оба фрагмента. При выделении бактериями токсин является неактивным в связи с тем, что активный участок на фрагменте А замаскирован. Активация происходит за счёт действия протеаз, присутствующих в среде культивирования и инфицированных тканях. Вся ферментативная активность токсина расположена в фрагменте А. Фрагмент В отвечает за связывание токсина с клетками; антитела к фрагменту В препятствуют контакту токсина с клетками макроорганизма. Токсин нестойкий, продолжительное хранение, инкубация при 37ºС в течение 4-6 недель. Антигенная структура. Коринебактерии дифтерии являются антигенно-гетерогенными. По феноме-ну агглютинации все штаммы gravis разделены на 13 типов, intermedius - на 4 и mitis - на 40. Штаммы ИИ типа распространены во всем мире. Не выявлено связи между типоспецифичностью и другими признаками. Патогенез и заболевание человека. Ранее дифтерия была тяжёлым заболеванием детей во всем ми-ре, но в связи с массовой иммунизацией и профилактическими мероприятиями она практически ликвидиро-вана в развитых странах; в других государствах она продолжает оставаться серьёзной проблемой. В эндеми-ческих регионах она является основной детской болезнью. У детей до 1 года она встречается редко в связи с наличием у них пассивного иммунитета от матерей, у детей 2-5 лет заболеваемость резко повышается, мед-ленно снижается у детей 5-10 лет и значительно - 10-15 лет; после чего практически не встречается вследст-вие формирования активного иммунитета после перенесенных субклинических инфекций. Наиболее суще-ственным источником инфекции в эндемических районах являются бессимптомные носители коринебакте-рий дифтерии в носу и глотке в странах с умеренным климатом) и на коже (в тропических странах). На коже бактерии могут персистировать около 3 лет, способствуя развитию природного иммунитета, но чаще они вызывают заболевание у лиц, которые контактируют с носителями. Контактно-бытовой путь передачи не играет важной роли, но описаны случаи передачи дифтерии через игрушки, карандаши и ручки.
Инкубационный период при дифтерии составляет 3-4 дня, но может уменьшиться и до 1 дня, у носи-телей он может быть очень продолжительным. Зачастую возникает дифтерия зева, редко - носа, уха, глаз, кожи, половых органов. На месте входных ворот инфекции возникает воспаление с образованием серовато-жёлтой пленки, прочно спаянной с прилежащей тканью. Иногда процесс из глотки переходит на гортань, трахею, возникает отёк, развивается асфиксия. Заболевание сопровождается общей интоксикацией организ-ма. По степени тяжести течения дифтерию разделяют на: (1) злокачественную или гипертоксическую, при которой развивается сильная токсемия с аденитом (“бычья шея”), возможно развитие параличей, смерть на-ступает вследствие нарушения кровообращения; (2) септическую, при которой возникают язвы, целюллит и даже гангрена вокруг псевдомембран; (3) геморрагическую, которая характеризуется кровотечением из мембран, конъюнктивальными кровоизлияниями, пурпурой и снижением свертывания крови. Основными осложнениями являются: (1) асфиксия вследствие механической обструкции дыхательных путей фибриноз-ными пленками (часто нужно проводить трахеостомию); (2) острая недостаточность кровообращения, кото-рая может быть периферического или сердечного происхождения; (3) параличи, возникающие на 3-4 неде-лю заболевания (часто они спонтанно исчезают); (4) септические осложнения (пневмония или отит). В 1 % случаев может произойти рецидив заболевания.
Дифтерия является токсемией. Бактерии остаются во входных воротах инфекции, где они размножа-ются и продуцируют токсин. Токсин вызывает локальные некротические поражения, в результате чего обра-зуется фибринозний экссудат, который с разрушенными эпителиоцитами, лейкоцитами, эритроцитами и бактериями формирует пленки, характерные для дифтерийной инфекции. “Механические” осложнения дифтерии возникают вследствие появления пленок, системные эффекты - вследствие действия токсина. Не-токсигенные штаммы коринебактерий дифтерии могут вызывать инфекцию даже у иммунизированных лиц, поскольку антитоксический иммунитет не обеспечивает антибактериального иммунитета. Заболевание про-текает в лёгкой форме, но пленки иногда также образуются.
63) Иммунитет при дифтерии, методы лаб.диагностики, специфическое лечение и профилактика. Иммунитет. Перенесенное заболевание не всегда означает отсутствие повторных случаев в будущем. Реконваленсцентов следует вакцинировать анатоксином.
Лабораторная диагностика. Лабораторное подтверждение дифтерии необходимо для эпидемиоло-гического контроля и разработки профилактических мероприятий, а не для лечения больных. Специфическое лечение следует назначать немедленно при подозрении на дифтерию, не дожидаясь результатов лабо-раторных тестов, любая задержка может стать роковой.
Лабораторная диагностика дифтерии производится с целью: • постановки диагноза острого заболевания; • установления бациллоносительства; • определения вирулентности (токсичности) дифтерийных палочек.
Материал для исследования (чаще всего мазок из носа) берут стерильным ватным тампоном. Не следует брать материал после приема пищи или полоскания дезинфицирующими растворами. Посев необходимо произвести сразу после взятия материала (не позже 5—6 ч) в пробирку со свернутой кровяной сывороткой и сывороткой Леффлера, а затем поставить в термостат при 37 °С.
2. Бактериоскопическое и бактериологическое исследования Через 18—20 ч роста в положительных случаях на поверхности среды видны многочисленные бисерные, близко расположенные друг к другу колонии. Предварительный диагноз можно дать уже через 8 ч. Материал с тампона можно засеять на чашку с кровяным теллуровым агаром или на среду Клауберга II. Колонии, выросшие на чашках через 24—48 ч, изучают микроскопически и отсевают на чашки Петри со специальной средой для определения токсичности. На следующие сутки учитывают результаты посева культур на средах для определения токсичности и биохимических свойств и микроскопируют чистую культуру со свернутой сыворотки. Если выделена разлагающая углеводы нетоксичная культура, необходимо поставить дополнительные пробы на цистиназу и реакцию агглютинации с политиповой дифтерийной сывороткой. Реакцию агглютинации ставят на стекле с помощью монотиповых дифтерийных сывороток.
3. Для идентификации чистой культуры дифтерийной палочки и дифференцировки ее от псевдодифтерийной палочки Гормана. Исследуют биохимические свойства выделенной чистой культуры. Исследование проводится на средах Yucca или на водно-сывороточной среде (20%-ной лошадиной сыворотке). Дифтерийная палочка расщепляет только глюкозу — имеет только столбик, дифтероиды ферментируют глюкозу и сахарозу — синий цвет будет у всей среды, ложнодифтерийная палочка не расщепляет Сахаров, но разлагает мочевину — вся среда приобретает оранжевый цвет. На основании реакций ферментации углеводов можно также установить 2 основных биологических типа дифтерийной палочки: гравис и митис. Формулировка окончательного ответа при положительном анализе: «Выделены токсичные (нетоксичные) дифтерийные палочки», в случае изучения культурально-биохимических признаков указывается принадлежность к типу гравис или митис, а при серотипировании культуры указывается серологический тип.
Лечение. Специфическое лечение дифтерии включает антитоксическую терапию и назначение антибиотиков. Антитоксин назначают немедленно при подозрении на дифтерию, промедление приводит к увеличению смертности. В тяжёлых случаях следует вводить 20-100 тысяч единиц, половину этой дозы - внутривенно. Лечение антитоксином не назначают при дифтерии кожи, поскольку эти штаммы обычно не токсигенны. C. diphtheriae чувствительны к пенициллину и их можно элиминировать из зева за несколько дней при лечении пенициллином. Пациентам назначают пенициллин только дополнительно, это не заменяет антитоксического лечения. Для ликвидации носительства назначают эритромицин.
Профилактика. Дифтерию можно контролировать путем иммунизации (активной, пассивной и комбинированной), но только активная иммунизация способна обеспечить стойкий иммунитет и привести к ликвидации заболевания. Пассивная или комбинированная иммунизация может только обеспечить срочную защиту восприимчивым лицам, которые имели контакт с больными дифтерией. Целью иммунизации является увеличение защитных уровней антител в популяции. Ранее использовались пробы Шика. Сейчас их не используют. Если, в некоторых случаях, следует определить уровень циркулирующего антитоксина, это осуществляют с помощью серологических тестов (реакция пассивной гемагглютинации или нейтрализации в клеточной культуре). Индексом иммунитета считают уровень антитоксина 0,01 единицы в 1 мл и более в сыворотке крови.
Активная иммунизация.
Для активной иммунизации используют только 2 препарата - формалиновый анатоксин (жидкий анатоксин) и адсорбированный анатоксин. Адсорбированный анатоксин значительно больше иммуногенен, чем жидкий. В настоящее время адсорбированный анатоксин используют в качестве универсального препарата для внутримышечного введения.
Дифтерийный анатоксин обычно вводят детям в составе трехвалентного препарата, содержащего столбнячный анатоксин и коклюшную вакцину. Существует также четырехвалентная вакцина, в состав которой дополнительно входит инактивированная полиовакцина.
Для детей младшего возраста дифтерийный анатоксин назначают в дозе 10-25 флоккуляционных единиц. Меньшие концентрации (1-2 флоккуляционных единицы) используют для иммунизации детей старше 7 лет и взрослых для предупреждения осложнений. Схема первичной иммунизации грудных детей и детей состоит из трёхкратного введения трёхвалентной вакцины с интервалами в 4-6 недель, через год после этого вводят четвёртую дозу. Иммунизацию повторяют в 7 лет.
Пассивная иммунизация - это экстренная мера при контакте индивидуумов с больными или если больной дифтерией ребенок находился на лечении в неинфекционном детском отделении. Её проводят путем введения подкожно антитоксина в дозе 500-1000 единиц (противодифтерийная сыворотка). Поскольку это лошадиная сыворотка, следует предварительно сделать тест на гиперчувствительность.
Комбинированная иммунизация состоит из введения первой дозы адсорбированного анатоксина в одну руку, тогда как противодифтерийную сыворотку вводят в другую руку, после чего проводят полный курс активной иммунизации. В идеале все лица, которые профилактически получают противодифтерийную сыворотку, должны быть подвергнуты комбинированной иммунизации.
64) Микобактерии туберкулёза, свойства, виды, патогенез заболевания. Возбудитель - Mycobacterium tuberculosis. Известны 3 основных вида возбудителя туберкулеза: 1) М. tuberculosis (человеческий вид); 2) М. bovis (бычий вид); 3) М. avium (птичий). Микобактерии туберкулёза - тонкие прямые или немного изогнутые палочки длиной 1-4 мкм и шириной 0,2-0,8 мкм, гомогенные или зернистые, грамположительные. Они неподвижны, не образуют спор и капсул, могут иметь ветвистые, нитчатые и коккоподобные формы. В цитоплазме, особенно в клеточной стенке, находится большое количество высокомолекулярных липидов, что обусловливает их высокую устойчивость к кислотам, щелочам и спиртам. Они плохо воспринимают анилиновые красители, лучший способ окраски - по Цилю-Нильсену (на голубом фоне туберкулёзные палочки выглядят ярко-красными) или флуоресцирующими красителями (аурамин О, родамин). В молодых культурах можно выявить некислото-устойчивые палочки и гранулы (зерна Муха). Микобактерии туберкулёза не образуют экзотоксин, но содержат эндотоксины, которые высвобождаются при разрушении клеток. Антигены туберкулёзных бактерий состоят из белковых фракций, липидов, фосфатидов и полисахаридов. Антигенная структура разных видов микобактерий туберкулёза сходна. Туберкулиновый протеин имеет выраженные аллергенные свойства. Классификация. Выделяют четыре фаготипа микобактерий туберкулёза - А, В, С и I (промежуточ-ный между А и В). Фаготип А является наиболее распространённым, тип В встречается в Европе и Северной Америке, тип С встречается крайне редко, тип I - в Индии и соседних странах. На основании типирования с использованием бактериоцинов, продуцируемых быстро растущими микобактериями, выделяют два типа микобактерий туберкулёза. Патогенез и заболевания человека. Источником инфекции являются больные люди и животные с открытой формой туберкулёза, которые выделяют возбудитель. Заражение людей туберкулёзом часто происходит воздушно-капельным и воздушно-пылевым способом. Возможно также инфицирование через молоко и молочные продукты, через кожу и слизистые оболочки. В месте проникновения возбудителя возни-кает воспаление, которое сопровождается образованием специфической гранулемы или туберкулёзного бугорка (очага Гона). В центре бугорка находятся гигантские клетки Пирогова-Ланганса, внутри которых могут находиться туберкулёзные палочки. Гигантские клетки окружены эпителиоидными и лимфоидными элементами, которые и составляют основную массу гранулемы. Туберкулёзные поражения первично бывают двух типов - экссудативного и продуктивного. Экссудативный тип является острой воспалительной реакцией с накоплением жидкости, полиморфноядерных лейкоцитов и моноцитов вокруг микобактерий. Поражения могут нагноиться, вызвать развитие некроза или развиться в продуктивный тип, который являются преимущественно клеточным, состоит из большого количества бугорков, которые могут увеличиться, соединиться и подвергнуться казеации. При доброкачественном течении болезни бугорок окружает соединительная ткань, он прорастает коллагеновыми волокнами, просачивается солями кальция, после чего дальнейшее распространение возбудителя прекращается. В первичной гранулёме микобактерии туберкулёза могут сохраняться годами, иногда всю жизнь. Такие люди являются носителями скрытой инфекции. С одной стороны, они имеют относительный иммунитет, а с другой - замаскированную форму туберкулёза, который при неблагоприятных условиях может активизироваться. Тогда бугорок распадается, а микобактерии распространяются в другие участки. При распаде нескольких гранулём в легочной ткани может образоваться полость (каверна). Если она соединяется с бронхом, возбудитель вместе с мокротой выделяется наружу - возникает открытая форма туберкулёза. Если возбудитель с мокротой не выделяется - говорят о закрытой форме. При сниженной резистентности организма (тяжёлые условия труда и быта, физические и психические травмы и др.) первичный туберкулёзный процесс может генерализироваться. Рассеивание микобактерий приводит к образованию в различных органах туберкулёзных очагов, предрасположенных к распаду. Интоксикация организма обусловливает тяжёлое течение болезни. Генерализация может сопровождаться поражением мочеполовых органов, костей, суставов, оболочек мозга, глаз.
65) Специфическая диагностика туберкулёза, лечение, профилактика. Лабораторная диагностика туберкулёза проводится с использованием бактериоскопического, бактериологического, биологического и аллергического методов, серологические исследования проводят нечасто. Материалом для исследования может быть мокрота, слизь из гортани, гной, моча, спинномозговая жидкость, плевральный экссудат, пунктат лимфатических узлов, испражнения. Бактериоскопия мазков, окрашенных по Цилю-Нильсену, даёт возможность быстро выявить микобактерии. Но этот метод являются лишь ориентировочным, так как и сапрофитные микобактерии морфологически сходны. Хорошие результаты дает люминесцентная микроскопия с аурамином или родамином. Микобактерии туберкулёза светятся ярким зелёным светом на темном фоне. При бактериоскопическом исследовании для повышения частоты положительных результатов используют методы обогащения - гомогенизации и флотации. Первый состоит в том, что мокроту сначала гомогенизируют, энергично перемешивая её с раствором едкого натрия, центрифугируют и с осадка готовят мазки. При втором - мокроту гомогенизируют в растворе едкого натрия, потом добавляют 1-2 мл ксилола (бензина, бензола), встряхивают 10 минут и готовят мазки из верхнего пласта, где находятся микобактерии.
Бактериологический метод является основным в лабораторной диагностике туберкулёза. Исследуемый материал заливают двойным объёмом 6 % серной кислоты, встряхивают 10 минут. Смесь центрифугируют, осадок нейтрализуют двумя каплями едкого натрия, отмывают изотоническим раствором натрия хлорида, засевают на среду Левенштейна-Йенсена или др. Выделенные культуры идентифицируют, определяют их чувствительность к противомикробным препаратам.
Используют также ускоренные методы бактериологической диагностики Прайса и Петрова. При исследовании методом Прайса материал наносят на стерильное предметное стекло, высушивают и погружают в 6 % раствор серной кислоты, в котором гибнут все микробы, кроме микобактерий. После промывания мазков в изотоническом растворе натрия хлорида их помещают во флаконы с цитратной кровью. Через 2-3 дня стекла вынимают, фиксируют и окрашивают по Цилю-Нильсену. Микроколонии в мазке имеют вид согнутых жгутов (“кос”), которые образуются под влиянием корд-фактора.
Метод Петрова является одним из простых и наиболее широко используемых. Мокроту инкубируют с равным объемом 4 % натрия гидрохлорида при 37ºС, часто встряхивая, пока смесь не станет прозрачной (примерно 20 минут). Потом смесь центрифугируют 30 минут со скоростью 3000 оборотов в минуту, седимент нейтрализуют N/10 хлористоводородной кислотой, готовят мазки, засевают на питательные среды и проводят биологическую пробу. Биологический метод используют в тех случаях, когда возбудитель туберкулёза тяжело или невозможно выделить на питательных средах. Часто его проводят при диагностике туберкулёза почек. Исследуемый материал после соответствующей обработки кислотой вводят в мышцы бедра кроликам или гвинейским свинкам. Начиная с 5-10 дня, исследуют пунктаты лимфатических узлов бактериоскопическим методом. Заражённых животных наблюдают 1-2 месяца. При их вскрытии во внутренних органах выявляют многочисленные туберкулёзные гранулёмы.
Аллергическую пробу Манту ставят для выявления инфицированных туберкулёзными микобактериями людей, а также для оценки течения заболевания и отбора лиц для ревакцинации. На внутреннюю поверхность предплечья внутрикожно вводят туберкулин (5 туберкулиновых единиц в объеме 0,1 мл), результат пробы оценивают через 72 часа. Положительной её считают при размере инфильтрата не менее 5 мм.
Для ускоренной диагностики туберкулёза используют полимеразную цепную реакцию, которая базируется на идентификации хромосомной вставки-последовательности (IS. 6110) микобактерий, выступающей в качестве транспозона. Её выявление имеет не только диагностическое, но и эпидемиологическое значение.
Лечение осуществляют антибиотиками и химиотерапевтическими препаратами, к которым чувствительны возбудители заболевания. Наиболее эффективными препаратами являются изониазид, рифампицин, пиразинамид. К препаратам средней эффективности относят стрептомицин, канамицин, этионамид, циклосерин. Наименее эффективными являются парааминосалициловая кислота (ПАСК) и тиоцетазон. Большое значение имеют рациональное питание, санаторно-курортное лечение, десенсибилизация организма туберкулином и другими препаратами.
Профилактика. Среди мероприятий общей профилактики туберкулёза имеют значение ранняя диагностика и лечение больных, обеззараживание молока и других пищевых продуктов и широкое проведение социальных мероприятий (улучшение жилищных условий, повышение материального обеспечения, хорошие условия труда). Для специфической профилактики используют живую вакцину БЦЖ (Bacille Calmette-Guerin). Её получили французские ученые А. Кальметт и М. Герен путём продолжительных пассажей M. bovis (239 пересевов в течение 13 лет) на глицериновой картофельной среде с добавлением желчи. За указанное время под влиянием желчи снизилась вирулентность культуры, и её стали использовать как вакцинный штамм. Вакцину вводят внутрикожно всем новорожденным на 3-5 день жизни, ревакцинацию проводят с интервалом в 5-7 лет до тридцатилетнего возраста.
66) Возбудитель лепры, свойства и биологические особенности возбудителя. Патогенез, клиника, лаб.диагностика, лечение и профилактика. Возбудитель лепры (проказы) - Mycobacterium leprae. Морфология. M. leprae являются прямыми или слегка изогнутыми палочками длиной 1-8 мкм и ши-риной 0,2-0,5 мкм с незначительными морфологическими вариациями (встречаются полярные тела и другие внутриклеточные элементы, ветвистые и булавовидные формы). Окрашиваются по Цилю-Нильсену в крас-ный цвет, устойчивость к кислотам, щелочам и спиртам у них менее выражена, чем у туберкулёзных пало-чек. В отличие от последних в мазках из патологического материала возбудители лепры располагаются не поодиночке, а своеобразными скоплениями, которые напоминают пачки сигар. Экзотоксин лепрозные бактерии не продуцируют, но имеют эндотоксин и аллергены. Патогенез и заболевание человека. Единственным резервуаром и источником инфекции в природе являются больные люди. Они передают возбудитель воздушно-капельным путем или через повреждённую кожу. Существует точка зрения, что лепра вообще малоконтагиозное заболевание и заражение наступает лишь при продолжительном контакте больного и здорового человека. Лепра - хроническое генерализован-ное инфекционное заболевание, характеризующееся поражениями кожи, слизистых оболочек, внутренних органов, периферической нервной системы и могущее длиться годами. Инкубационный период в среднем составляет 3-5 лет, но может затягиваться до 20-30 лет. Наиболее часто поражение локализуются на лице, реже - на предплечьях и голенях. Развиваются многочисленные инфильтраты (лепромы), содержащие большое количество лепрозных бактерий. Со временем эти лепромы распадаются, образуя долго незажи-вающие язвы. Выделяют четыре типа заболевания - лепроматозный, туберкулоидный, диморфный и неоп-ределенный. Развитие того или другого типа болезни зависит от состояния иммунной системы человека. Двумя “полярными” типами являются лепроматозный и туберкулоидный. Лепроматозный тип возникает при снижении иммунной резистентности, он является более инфекционным, чем другие, часто возникает бактериемия. У больных с высокой резистентностью развивается туберкулоидный тип, при котором инфек-ционность минимальна. Диморфный тип имеет черты как туберкулоидного, так и лепроматозного типов. Неопределенный тип является нестабильной тканевой реакцией, непохожей на ни один из типов, но он может прогрессировать в любой из них. Лабораторная диагностика. Для лабораторной диагностики, в основном, используют бактериоско-пический метод. Материалом для исследования служат соскобы со слизистой оболочки носа, биоптаты и скарификаты с лепром и язв на коже, при генерализованных формах - кровь. Кроме того, с диагностической целью ставят реакцию связывания комплемента, реакцию косвенной гемаглютинации, а также внутрикож-ную аллергическую пробу с лепромином. Лечение проводят сульфоновими препаратами (дифенилсульфон, солюсульфон), рифампицином, клофазимином. Профилактика. С целью предупреждения возникновения новых заболеваний пациентов изолируют в специальные лепрозории (лагеря закрытого типа). Членов семьи периодически осматривают, здоровых детей, родившихся от больной матери, отдают родственникам по их согласию или в специальные детские учреждения. Проходят испытание первые противолепрозные вакцины.
67) Коклюш, биологические свойства. Патогенез, клинические формы заболевания. Коклюш (Pertussis) - острое инфекционное заболевание, вызываемое коклюшной палочкой, передающееся воздушно-капельным путем, характеризующееся приступообразным судорожным кашлем. Этиология: палочка Борде-Жангу (Haemophilus pertussis). Bordetella pertussis — очень мелкие короткие грамотрицательные палочки. Имеют микрокапсулу, неподвижны. При окраске толуоидиновым синим у них выявляются метахроматически окрашенные гранулы (липоиды), расположенные биполярно. На поверхности имеют фимбрии. Все бордетеллы — строгие аэробы. В. pertussis очень требовательны к условиям культивирования: для их выделения используют сложные питательные среды с добавлением сорбентов или веществ с высокой сорбционной способностью (активированный уголь, кровь, альбумин), так как в процессе жизнедеятельности эти бактерии выделяют ненасыщенные жирные кислоты, сульфиды и перекиси, способные ингибировать их рост. Для выделения бордетелл из клинического материала применяют казеиново-утольный агар (КУА) или среду Борде—Жангу (картофельно-глицериновый агар с добавлением 20 % крови и пенициллина), при повышенном содержании СО2. Патогенез: эпителий дых путей (размножение) – выделение токсина – интоксикация НС, ЦНС, ДС – спазм дыхательных мыщц, спастическое сокращение, нарушение дыхания (невроз респераторного тракта) – нарушение вентиляции и дыхания – гипоксия, гипоксемия, ацидоз. Постоянное возбуждение – спастические проявления (рвота, спазм диафрагмы, переферических сосудов, судорожный синдром) – поражения ЦНС – коклюшная энцефалопатия. Возможна алергическая р-ция с асматическим компонентом. Классификация: типичные (легкие, средние, тяжелые), атипичные (стертая, субклиничная (у привитых)). По течению заболевания выделяют три основные формы коклюша: легкую, среднетяжелую и тяжелую. Кроме них, в последнее время часто встречаются атипичные формы коклюша: стертая и бессимптомная. Легкая форма коклюша Эта клиническая форма заболевания характеризуется небольшой частотой коротких по времени приступов (от 5 до 15 в сутки), редко заканчивающихся рвотой. Общее состояние больного при этом не нарушено. Среднетяжелая форма коклюша Эта клиническая форма коклюша проявляется длительными приступами, имеющими несколько репризов и часто заканчивающимися рвотой, частота которых колеблется от 15 до 24 в сутки. Самочувствие больных умеренно нарушено. Тяжелая форма коклюша Эта форма коклюша характеризуется большим количеством приступов (25—30 в сутки), каждый из которых включает не менее 10 репризов и может длиться до 15 мин, при этом почти все они заканчиваются рвотой. Наблюдаются выраженное расстройство общего самочувствия: вялость, расстройство сна, отсутствие аппетита, нередко длительная лихорадка. По периодам: 1. инкубационный (3-15 дн). 2. катаральный (6-14 дн) – сухой кашель, насморк, t до 38. 3. период спастического кашля (2-5 нед) – усиление кашля, приступообразный, хар-на репризы (глубокие судорожные вздохи после кашля на выдохе), стекловидная моркота, рвота, носовые кровотечения, лицо налитое кровью, слезотечение, язык лодочкой, уздечна травмируется, непроизвольная диффекация и мочеиспускание. Ro – повышенная прозрачность легких. Лейкоцитоз, лимфоцитоз. Легкая степень – 10-15 приступов +3-5 реприз; средняя степень – 20-25 приступов +до 10 реприз; тяжелая степень – 40-50 приступов +более 10 реприз +апное; 4. период разрешения (1-3 нед) – изчезает спазматический хар-р и репризы. Длительность болезни 1,5 – 4 мес.
68)
Методы лаб.диагностики, лечения и
специфической вакцинации
коклюша.


 Генодиагностика
- ПЦР для обнаружения специфических
фрагментов ДНК возбудителя
коклюша.
Микроскопический
метод для
диагностики коклюша и паракоклюша не
применяется. В качестве экспресс-метода
можно использовать ИФМ.
Бактериологический
метод является
основным в лабораторной диагностике
коклюша и паракоклюша. Материал для
исследования берут с помощью стерильного
носоглоточного ватного тампона, у
маленьких детей – тампоном на тонкой
эластичной проволоке, а также методом
«кашлевых пластинок» (в момент приступа
кашля открытую чашку Петри с питательной
средой подносят ко рту ребенка и держат
в течение 6-8 кашлевых толчков). Для посева
чаще всего используют казеиново-угольный
агар (КУА), а также кровяной или
картофельно-глицериновый кровяной агар
(среда Борде-Жангу), содержащие пенициллин
для подавления роста сопутствующей
микрофлоры. Бордетеллы вырастают при
температуре 370
С через
48-72 часа в виде мелких (около 1 мм в
диаметре), выпуклых, блестящих колоний,
напоминая капельки ртути (рис. 17). Из
колоний готовят мазки и окрашивают их
по Граму. При наличии в препаратах мелких
овоидных грамотрицательных палочек
ставят реакцию агглютинации с коклюшной
и паракоклюшной сыворотками и делают
пересев для выделения чистой культуры.
Чистую культуру идентифицируют на
основании изучения комплекса биологических
свойств. Bordetella
pertussis не
растет на простых питательных средах,
не меняет цвета специальных сред.
Серотипирование проводится с помощью
РА на стекле с адсорбированным факторными
сыворотками. Фактор (антиген) 7 является
родовым, общим для всех бордетелл, фактор
1 специфичен для Bordetella
pertussis,
фактор 14 – для Bordetella
parapertussis
фактор 12 – для Bordetella
bronchiseptica.
Лечение. При
легком течении заболевания постельный
режим пациенту с коклюшем не показан.
Наоборот, больной нуждается в частых
прогулках на свежем воздухе, во время
которых желательно избегать шумных,
богатых раздражителями мест.
Антибиотики
назначают лишь в катаральный период.
Достаточно эффективен ампициллин и
макролиды (эритромицин, азитромицин),
детям старше 12 лет можно назначать
тетрациклины. Данные антибактериальные
средства принимают в средних дозах
короткими курсами.
Стандартные
противокашлевые препараты при приступах
коклюша неэффективны. Для снижения
активности очага возбуждения в головном
мозге назначают психотропные средства
– нейролептики
(аминазин или дроперидол в возрастных
дозировках). Поскольку данные медикаменты
действуют успокаивающе, их лучше
принимать перед дневным или ночным
сном. С этой же целью можно использовать
транквилизатор
(реланиум
– внутримышечно или внутрь в возрастной
дозировке).
При легких формах коклюша
для купирования приступов кашля назначают
антигистаминные
препараты –
пипольфен и супрастин, которые имеют
противоаллергическое и успокаивающее
действие. Димедрол не используют,
поскольку данное лекарственное средство
вызывает сухость слизистых оболочек и
может способствовать усилению кашля.
При
тяжелых формах коклюша с выраженным
аллергическим компонентом отмечают
значительное улучшение при использовании
глюкокортикоидов
(преднизолон).
Все вышеперечисленные
средства принимают до исчезновения
приступов спазматического кашля (как
правило, 7-10 дней).
Кроме того, для
разжижения вязкой мокроты используют
ингаляции протеолитических
ферментов
– химопсина и химотрипсина, а при тяжелых
приступах кашля для профилактики
гипоксии центральной нервной системы
препараты, улучшающие кровообращение
в головном мозге (пентоксифилин,
винпроцетин).
Для улучшения отхождения
мокроты показаны массаж
и дыхательная гимнастика.
В периоды разрешения и реконвалесценции
назначают общеукрепляющие
физиотерапевтические процедуры и курсы
витаминотерапии.
Генодиагностика
- ПЦР для обнаружения специфических
фрагментов ДНК возбудителя
коклюша.
Микроскопический
метод для
диагностики коклюша и паракоклюша не
применяется. В качестве экспресс-метода
можно использовать ИФМ.
Бактериологический
метод является
основным в лабораторной диагностике
коклюша и паракоклюша. Материал для
исследования берут с помощью стерильного
носоглоточного ватного тампона, у
маленьких детей – тампоном на тонкой
эластичной проволоке, а также методом
«кашлевых пластинок» (в момент приступа
кашля открытую чашку Петри с питательной
средой подносят ко рту ребенка и держат
в течение 6-8 кашлевых толчков). Для посева
чаще всего используют казеиново-угольный
агар (КУА), а также кровяной или
картофельно-глицериновый кровяной агар
(среда Борде-Жангу), содержащие пенициллин
для подавления роста сопутствующей
микрофлоры. Бордетеллы вырастают при
температуре 370
С через
48-72 часа в виде мелких (около 1 мм в
диаметре), выпуклых, блестящих колоний,
напоминая капельки ртути (рис. 17). Из
колоний готовят мазки и окрашивают их
по Граму. При наличии в препаратах мелких
овоидных грамотрицательных палочек
ставят реакцию агглютинации с коклюшной
и паракоклюшной сыворотками и делают
пересев для выделения чистой культуры.
Чистую культуру идентифицируют на
основании изучения комплекса биологических
свойств. Bordetella
pertussis не
растет на простых питательных средах,
не меняет цвета специальных сред.
Серотипирование проводится с помощью
РА на стекле с адсорбированным факторными
сыворотками. Фактор (антиген) 7 является
родовым, общим для всех бордетелл, фактор
1 специфичен для Bordetella
pertussis,
фактор 14 – для Bordetella
parapertussis
фактор 12 – для Bordetella
bronchiseptica.
Лечение. При
легком течении заболевания постельный
режим пациенту с коклюшем не показан.
Наоборот, больной нуждается в частых
прогулках на свежем воздухе, во время
которых желательно избегать шумных,
богатых раздражителями мест.
Антибиотики
назначают лишь в катаральный период.
Достаточно эффективен ампициллин и
макролиды (эритромицин, азитромицин),
детям старше 12 лет можно назначать
тетрациклины. Данные антибактериальные
средства принимают в средних дозах
короткими курсами.
Стандартные
противокашлевые препараты при приступах
коклюша неэффективны. Для снижения
активности очага возбуждения в головном
мозге назначают психотропные средства
– нейролептики
(аминазин или дроперидол в возрастных
дозировках). Поскольку данные медикаменты
действуют успокаивающе, их лучше
принимать перед дневным или ночным
сном. С этой же целью можно использовать
транквилизатор
(реланиум
– внутримышечно или внутрь в возрастной
дозировке).
При легких формах коклюша
для купирования приступов кашля назначают
антигистаминные
препараты –
пипольфен и супрастин, которые имеют
противоаллергическое и успокаивающее
действие. Димедрол не используют,
поскольку данное лекарственное средство
вызывает сухость слизистых оболочек и
может способствовать усилению кашля.
При
тяжелых формах коклюша с выраженным
аллергическим компонентом отмечают
значительное улучшение при использовании
глюкокортикоидов
(преднизолон).
Все вышеперечисленные
средства принимают до исчезновения
приступов спазматического кашля (как
правило, 7-10 дней).
Кроме того, для
разжижения вязкой мокроты используют
ингаляции протеолитических
ферментов
– химопсина и химотрипсина, а при тяжелых
приступах кашля для профилактики
гипоксии центральной нервной системы
препараты, улучшающие кровообращение
в головном мозге (пентоксифилин,
винпроцетин).
Для улучшения отхождения
мокроты показаны массаж
и дыхательная гимнастика.
В периоды разрешения и реконвалесценции
назначают общеукрепляющие
физиотерапевтические процедуры и курсы
витаминотерапии.
Биопрепараты для диагностики, профилактики и лечения коклюша: · АКДС-вакцина (адсорбированная коклюшно-дифтерийно-столбнячная вакцина) содержит взвесь убитых коклюшных бактерий, дифтерийный и столбнячный анатоксины, адсорбированные на гидроокиси алюминия. Применяется для активнойиммунизации детей против перечисленных инфекций; · Тетракокк –комбинированная вакцина для профилактики дифтерии, коклюша, столбняка и полиомиелита производства фирмы Пастер Мерье Коннот (Франция). · агглютинирующие сыворотки - для серологической идентификации коклюшных бактерий; · иммуноглобулин донорский. Получен из венозной крови человека, содержит антитела против ряда патогенных микроорганизмов (включая бордетеллы), применяется для профилактики и лечения коклюша, создает пассивный иммунитет; · агглютинирующие адсорбированные факторные сыворотки. Диагностические сыворотки, подвергнутые адсорбции родственными микробами с целью удаления групповых антител. Применяются для постановки РА при антигенной идентификации бордетелл.
69) Возбудитель сифилиса, свойства и биологические особенности возбудителя. Возбудителем сифилиса- Treponema pallidum – блед. трипонелла, она относится к с-ву спирохет(С). Бледная трипонема имеет спиралевидную форму. Для нее характерно наличие от 8 до 12 завитков. Эти завитки равномерны по длине и небольшие по амплитуде. Спирохеты отличаются значительной подвижностью, причем для них характерны несколько типов движения – поступательное, маятникообразное, сгибательное, вращательное. Движения очень плавное, что отличает трипонему от других спирохет. Клетка трипонемы в структурном отношении представляет собой цитоплазматический цилиндр. В цитоплазме содержится – нуклеоид, органоиды, включения. Цитоплазма ограничена цитоплазматической мембраной. Кнаружи от нее располагается тонкая и эластичная клеточная стенка, которая в свою очередь окружена слизистым чехлом. Между клеточной стенкой и цитоплазматической мембраной располагаются фибриллы. Они прикрепляются на концах микробной клетки с помощью блефаробластов и направлены на встречу друг к другу. Фибриллы состоят из белка флагелина и являются аналогами жгутиков. Именно за их счет происходит движение. Под влиянием неблагоприятных условий трипонемы могут формировать формы устойчивого выживания – L формы и цисты. Циста – свернутая в клубок трипонема, которая покрыта непроницаемой муциновой оболочкой. В форме цист трипонемы могут длительное время сохраняться в организме больного не проявляя патогенных свойств, однако при ослаблении защитных сил макроорганизма, а также в случае прекращения действия на микроорганихм неблагоприятных факторов из цист могут вновь образовываться патогенные невегетативные формы трипонемы, что приводит к обострению заболевания. Размножаются путем поперечного или множественного деления. Из-за малого количества нуклеопротеидов в клетке трипонемы очень плохо воспринимают анилиновые красители. По методу Гр – не окрашиваются. Для их окраски можно использовать метод Романовского – Гимзе – в слабо розовый цвет, или серебриным по Морозову – темно коричневые. Окрашиваются 3-5% трипонем. Это стало причиной того, что их практически не красят. Бледная трипонема – строгий анаэроб, требователен к питательным средам, на простых не растет, на специальных средах – культивируется с огромным трудом. В настоящее время в лабораторных условиях ее культивируют в ткани яичек кролика. Она сохраняет жизнеспособность, неплохо размножается, значительно утрачивает вирулентность. Биохимия изучена слабо. Разные штаммы обладают различной ферментативной активностью. До 70% штаммов расщепляют белки, до 20% - липиды и углеводы. Возбудитель сифилиса имеет сложную антигенную структуру. Антигенные свойства трипонем обусловлены входящими в состав микробной клетки липидными полисах. и белковыми комплексами. Определение антигенов трипонем практического значения не получило. Бледная трипонема мало устойчива к различным факторам окружающей среды. Они чувствительны к высыханию, действию высоких температур, химических веществ. При 55 градусах Цельсия погибают в течении 15 минут. При кипячении – праткически мгновенно. Чувствительны к кислотам, солям тяжелы металлов, дезинфицирующим веществам в обычных концентрациях.
70) Патогенез, клиника, лаб.диагностика, профилактика и лечение сифилиса. Патогенез. Сифилис является типичным антропонозным заболеванием. В естественных условиях болеют только люди. Источник заболевания – больной человек. Основной путь передачи – половой. Значительно реже имеет контактно-бытовой(путь опосредованного контакта – через предметы обихода). Возможна передача возбудителя гемотрансфузионным путем, препаратами крови, использование нестерильных инструментов. Также трансплацентарно (вертикально). Внедриться возбудитель может в самых разных местах, через кожу или слизистые оболочки. В течении заболевания выделяют несколько периодов – инкубационный – от момента заражения до появления первых симптомов – 4-5 недель. Первичный период сифилиса. Характеризуется появлением на месте внедрения возбудителя безболезненной очень плотной на ощупь язвы, которая получила название – твердый Шанкр. Во время первичного периода – увеличение регионарных Шанкру лимфоузлов, безболезненных при пальпации. Первичный период – 6-8 недель, далее даже без увеличения – узлы нормализуются в размерах. Возбудитель после этого проникает в кровоток и происходит генерализация инфекции, а заболевания переходит во вторичный период. При вторичном сифилисе на коже и слизистых оболочках появляются высыпания, их характер различен – пятна, бугорки, гнойнички. Как правило повышается температура, появляются боли в мышцах, суставах, головные боли. Так 2-3 дня. Через 2-3 месяца сыпь самопроизвольно пропадает и болезнь переходит в латентный период, который может продолжаться несколько месяцев. Эти периоды чередуются несколько раз – высыпание, латентный, высыпание и тд. Длится вторичный период сифилиса до 3х лет, но затем наступает третичный период, который характеризуется формированием бугорковых или гуммозных инфильтратов в различных органах и тканях (костная ткань, печень). Поражается ЦНС.(возможна смерть). Иммунитет. Приобретенный иммунитет при сифилисе характеризуется защитными клеточными реакциями, но они направлены не на выведение возбудителя из организма, а на фиксацию трипонемы в тканях. Образующиеся антимикробные антитела к трипонемме вообще не обладают защитными свойствами. Иммунитет при сифилисе – нестерильный характер (пока есть возбудитель в организме). Перенесенное заболевание не оставляет невосприимчивости. При сифилисе развивается аллергия, которую можно выделить внутрикожной аллергической пробой. Раньше – один из методов диагностики. Лабораторная диагностика сифилиса. Зависит от стадии заболевания. При первичном и вторичном периодах болезни можно использовать бактериоскопический метод. Материалом для исследования при этом служит отделяемое твердого Шанкра или тканевая жидкость, полученная из элементов сыпи. Из клинического материала готовят препараты по типу раздавленная капля и исследуют с помощью темнопольной или фазово-контрастной микроскопии. При этом обращают внимание на количество и характер завитков, а также на спектр движения микроорганизмов. Начиная с конца 3ей недели заболевания возможно использование серологического метода диагностики. Он же может быть сразу применим при подозрении на врожденный сифилис. Антитела к возбудителю сифилиса выявляют комплексом серологических реакций. Он включает несколько реакций – связывания комплимента, непрямой иммунофлюоресценции, реакция непрямой гемагглютинации, реакция иммобилизации трипонем, иммуноферментный анализ. Реакция связывания комплимента – Вассермана. Эта реакция ставится параллельно с 2мя антигенами. 1ый- специфический трипонемный, который представляет собой экстракт из тканевой структуры бледных трипонемм, разрушенных ультразвуком. 2й – неспецифический кардиолипиновый антиген, который получают из бычьих сердец. Реакция Вассермана традиционно учитывается в крестах – резко положительная – 4 креста(все эритроциты падают в осадок) 0 – полный гемолиз – отрицательная, между ними 3,2,1. Может давать ложно «+» результат, при некоторых инфекционных заболеваниях, таких как малярия, бруцилез, сыпной тиф, при циррозе печени, системных заболеваниях соединительной ткани – системная красная волчанка, васкулит и даже на поздних сроках беременности. Сейчас эта реакция потеряла свое значение. Более специфичная непрямая реакция иммунофлюоресценции. Для постановки этой реакции на предметное стекло наносят взвесь тканевой культуры трипонем с последующей фиксацией, затем на препарат наносят сыворотку крови, обследуемого человека. Если она содержит антитела к трипонеме – взаимодействие антител и возбудителя. Далее препарат промывают и обрабатывают люминисцентной сывороткой, содержащей меченные антитела к иммуноглобулину человека. Этот препарат исследуется в люминисцентном микроскопе. В положительном случае можно наблюдать специфическое желто-зеленое свечение бледных трипонем. Используют реакцию непрямой гемаагглютинации с эритроцитарным трипонемным диагностикумом. Реакция иммобилизации трипонемм. Принцип этой реакции – заключается в угнетении движения бледных трипонемм антителами сыворотки крови больных в присутствии комплемента. Эта реакция считается «+», если процент иммобилизации 50 и выше. На современном этапе – имунноферментный анализ. Эта реакция ставится в общепринятом смысле. Как и для любых других заболеваний. При массовых исследованиях на сифилис – существует микро реакция преципитации. Она ставится с кардиолипиновым антигеном. Серологические реакции используются не только с чисто диагностическими целями, но и для оценки эффективности проводимости лечения и излеченности больных. В настоящее время для диагностики сифилиса можно использовать генетический метод – полимеразная цепная реакция. Профилактика и лечения. Специфической профилактики не существует. Остается одна не специфика. Для лечения применяют антибиотики, причем трипонемы до сих пор чувствительны к пенициллину, можно использовать современные препараты – ретарпен, экстенцилин. Можно использовать макролиды – эритромицин, сумомед, при непереносимости антибиотиков. При рецидиве – соли тяжелы металлов – дополнительно к основному лечению – висмута, йода. Сейчас они практически не применяются.
71) Возбудитель столбняка, свойства и биологические особенности возбудителя, лечение и профилактика. Clostridium tetani (столбнячная палочка) является этиологическим агентом столбняка. Это грамположительные тонкие клостридии размером 4-8*0,5 мкм, хотя длина может варьировать. Они имеют прямую ось, параллельные стороны и закругленные концы; в мазках располагаются одиночно или цепочками (редко). Споры сферические, терминальные и большие, они придают клостридиям столбняка характерный вид “барабанных палочек”. Морфология спор зависит от стадии их развития, молодые споры могут быть овальными, а не сферическими. Столбнячные палочки не образуют капсул, двигаются за счет перитрихеальных жгутиков. Молодые культуры грамположительные, старые клетки - грамвариабельны и даже грамнегативные.
Культивирование. Столбнячные палочки - строгие анаэробы, которые растут только при отсутствии кислорода. Оптимальной температурой является 37ºC, рН - 7,4. Они растут на простых средах, рост усиливается при добавлении крови или сыворотки, но не глюкозы. Ферментативные свойства. Столбнячные палочки обладают протеолитической активностью, но не расщепляют ни один из сахаров; образуют индол, не образуют сероводород; медленно разжижают желатин. Тесты с метиленовым красным и Фогеса-Проскауэра отрицательные. На средах, которые содержат нейтральный красный, образуют зеленоватую флуоресценцию. Токсинообразование. Столбнячные палочки продуцируют минимум 2 различных токсина- гемолизин (тетанолизин) и мощный нейротоксин (тетаноспазмин), которые являются антигенно и фармакологически различными, а их продукция - независимой. Третий токсин - неспазмогенный нейротоксин с периферической активностью - стимулирует синтез ацетилхолина в нейромышечных синапсах. Столбнячные палочки имеют небольшую инвазивность; спора, попавшая в рану, способна превратиться в вегетативное тело и размножаться только в благоприятных условиях. Токсин, продуцируемый локально, адсорбируется двигательными нервными окончаниями и транспортируется к центральной нервной системе вдоль осевых цилиндров периферических нервов. Токсин специфически и сильно связывается ганглиозидами серого вещества нервной ткани. Тетаноспазмин напоминает по своим эффектам стрихнин. Резистентность спор столбнячных палочек к нагреванию зависит от типа штамма: большинство гибнет при кипячении через 10-15 минут, но некоторые выдерживают кипячение в течение 3 часов. Для гарантированного уничтожения спор необходимо автоклавировать материал в течение 20 минут при 121ºC.
Лечение. Больных столбняком следует лечить в условиях стационаров, желательно в специализированных отделениях. Необходимость их изоляции обусловлена тем, что шум и свет могут спровоцировать развитие конвульсий. Больные столбняком являются незаразными, передача столбняка от одного человека к другому никогда не наблюдалась. Лечение заключается в обеспечении тишины, контроле судорог, поддержании проходимости дыхательного тракта путем проведения трахеотомии. Следует вводить противостолбнячный человеческий иммуноглобулин человека в дозе 10000 МЕ медленно внутривенно, и позже, при необходимости, еще 5000 МЕ: если он даже не нейтрализует токсин, который уже связался с нервной тканью, он может обезвредить несвязанный токсин.
Профилактика. Столбняк являются заболеванием, развитие которого можно предотвратить. Поскольку споры являются убиквитарными, невозможно предотвратить загрязнение ран. Заболевание возникает вследствие действия токсина, и, таким образом, наиболее очевидным и надежным методом профилактики является создание антитоксического иммунитета путем активной иммунизации. Выбор метода профилактики зависит от типа раны и иммунного статуса больного, существуют следующие способы: (1) первичная хирургическая обработка, (2) антибиотикотерапия и (3) иммунизация - пассивная, активная или комбинированная. Целью первичной хирургической обработки является удаление чужеродных частиц, некротизированных тканей и кровяных сгустков для предотвращения создания анаэробных условий. Объем хирургического вмешательства может варьировать от простой очистки до радикальной эктомии, в зависимости от типа раны. Целью антибиотикопрофилактики является разрушение или угнетение роста клостридий столбняка и гноеродных бактерий в ранах для предупреждения продукции ними токсина. Препаратом выбора является пенициллин, можно использовать эритромицин, локально - бацитрацин и неомицин. Антибиотики следует назначать до первичной обработки раны; они не влияют на токсин и не заменяют иммунизацию. Пассивную иммунизацию проводят путем введения 3000 МЕ противостолбнячной сыворотки по Безредке. Активную иммунизацию проводят путем введения столбнячного анатоксина взрослым (трижды, внутримышечно, с интервалом 4-6 недель между первыми двумя инъекциями) или коклюшно-дифтерийно-столбнячной вакцины детям. Полный курс иммунизации обеспечивает стойкий иммунитет в течение 10 лет, после чего следует провести бустер-инъекцию (многоразовое введение антигена с целью стимуляции синтеза антител).
При ранении непривитых лиц следует проводить активно-пассивную иммунизацию: ввести подкожно 0,5 мл столбнячного анатоксина и внутримышечно 3000 МЕ противостолбнячной сыворотки или 3 мл противостолбнячного иммуноглобулина.
72) Возбудитель ботулизма, свойства и биологические особенности возбудителя, лечение и профилактика. Clostridium botulinum вызывает ботулизм, тяжёлую форму пищевого отравления. Название “ботулизм” походит от лат. botulus - колбаса - пищевого продукта, которое обычно ассоциируют с этим типом пищевого отравления.
Клостридии ботулизма - это грамположительные бактерии размером 5*1 мкм, не образующие капсул, подвижные за счет перитрихеальних жгутиков; они образуют субтерминальные овальные крупные споры.
Культивирование. Возбудители ботулизма являются строгими анаэробами. Оптимальной темпера-турой для роста является 35ºC, но некоторые штаммы растут даже при 1-5ºC. Клостридии хорошо растут на обычных питательных средах, на поверхности которых образуют крупные полупрозрачные колонии неправильной формы с нитевидными краями. При культивировании на желатиновых средах с добавлением глюкозы и щелочей при 20-25ºС образуют споры (при более высоких температурах спор не образуют).
Ферментативные свойства. C. botulinum (серовары А и В) являются протеолитическими бактериями, которые расщепляют кусочки тканей и яичный альбумин в жидкой среде. Они разрежают желатин, продуцируют сероводород, аммиак, кетоны, алкоголь, уксус, масляные и молочные кислоты, расщепляют молоко (с образованием газа), глюкозу, левулезу, мальтозу и глицерин (с образованием кислоты и газа). Токсинообразование. C. botulinum продуцируют сильный экзотоксин, обеспечивающий их патогенность; этот токсин отличается от других экзотоксинов тем, что во время жизни бактерий он из них не выделяется. Он образуется внутриклеточно и появляется в среде только после гибели и автолиза клеток. Считают, что инициально он синтезируется в виде нетоксичного протоксина (токсина-предшественника). Трипсин и другие протеолитические ферменты активируют протоксин, превращая его в активный токсин. Он является нейротоксином с медленным действием, убивающим в течение несколько часов. Антигенная структура и классификация. На основании иммунологических различий токсинов вы-делено 8 типов клостридий ботулизма (типы A, B, C1, C2, D, E, F, G). Токсины являются идентичными по фармакологической активности, но нейтрализуются только гомологической антисывороткой. Исключение составляет токсин С2, являющийся цитотоксином, повышающим проницаемость сосудов, другие токсины являются нейротоксинами. Резистентность. Споры выдерживают кипячение в течение 3-4 часов и даже температура 105ºC не убивает их в течение 100 минут. Споры непротеолитических клостридий типов В, Е и F менее резистентны к нагреванию. Лечение. При пищевом ботулизме проводят искусственную вентиляцию легких, немедленно вводят внутривенно лошадиный поливалентный антитоксин против серотипов А, В и С (после пробы на гиперчув-ствительность). При ботулизме грудных детей используют только поддерживающую терапию.
Профилактика. Для профилактики ботулизма большое значение имеет правильная организация производства консервов. Всем людям, которые употребляли продукты, послужившие причиной отравления, вводят с профилактической целью по 1000-2000 МЕ противоботулиновой сыворотки типов А, В, С и Е. Для активной иммунизации используют поливалентный ботулиновый анатоксин.
При подозрении на заболевание ботулизмом после промывания желудка следует немедленно ввести антитоксическую противоботулиновую сыворотку типов А, В, С и Е, а после определения типа токсина пе-рейти на введение гомологической сыворотки. Сыворотку типов А, С и Е вводят по 10000 МЕ, типа В - 5000 МЕ по методу Безредки 4-6 раз в сутки в течение 2-4 дней.
73) Возбудитель анаэробной инфекции, виды. Патогенез, иммунитет. Методы микробиологической диагностики. Анаэробная инфекция — болезнь, вызываемая облигатными анаэробными бактериями в условиях, благоприятствующих жизнедеятельности этих микробов. Анаэробы могут поражать любые органы и ткани. Основными возбудителями болезни являются микробы, размножающиеся в бескислородной среде: клостридия перфрингенс, бацилла злокачественного отека и септический вибрион. В сочетании с ними разрушительный эффект может проявлять гистолитическая клостридия. В большинстве случаев названные анаэробы действуют сочетанно с другими возбудителями гнойной инфекции. Наиболее опасным является перфрингенс, продуцирующий ряд опасных экзотоксинов, которые вызывают некроз и разложение тканей, гемолиз. Бацилла злокачественного отека вызывает отек тканей (вследствие повышения проницаемости сосудистой стенки и тромбообразования) и гемолиз. Токсин септического вибриона нарушает ритм сердца, приводит к падению артериального давления. Облигатные анаэробы разделяются на две группы: 1) бактерии, образующие споры (клостридии) 2) неспорообразующие или так называемые неклостридиальные анаэробы. Первые вызывают клостридиозы, вторые — гнойно-воспалительные заболевания различной локализации. Представители обеих групп бактерий относятся к условно-патогенным микробам. Виды: Clostridium perfringens, Clostridium novyi, Clostridium histolyticum, Clostridium botulinum. Газовая гангрена — раневая инфекция, вызываемая бактериями рода Clostridium, характеризуется быстро наступающим некрозом преимущественно мышечной ткани, тяжелой интоксикацией и отсутствием выраженных воспалительных явлений. Таксономия Возбудители — несколько видов рода Clostridium, отдел Firmicutes. Основными представителями являются C.perfringens, C.novii, C.ramosum, C.septicum и др. Первое место по частоте встречаемости и тяжести вызываемого заболевания занимает C.perfringens. Патогенез Возникновению газовой гангрены способствует ряд условий: попадание микробов в рану (заболевание обычно вызывается ассоциацией нескольких видов анаэробов и реже одним из них), наличие некротических тканей, снижение резистентности. В некротических тканях анаэробы часто находят условия гипоксии, благоприятные для их размножения. Образуемые ими токсины и ферменты приводят к повреждению здоровых тканей и тяжелой общей интоксикации организма; а-токсин, лецитиназа, расщепляет лецитин — важный компонент клеточных мембран. Выделяемые гиалуронидаза и коллагеназа увеличивают проницаемость тканей, а также способствуют распространению микроба в окружающей ткани. В развитии заболевания выделяют фазу отека и фазу газообразования. Газообразование является результатом ферментативного разложения гликогена мышц, а также белка. Патологические процессы сопровождаются характерными изменениями окраски кожи от мертвенно-бледной до фона с гаммой сине-багровых, черных, зеленых пятен, придающих конечности мраморный вид. На разрезе подкожная клетчатка в одних случаях содержит то светлую, то шоколадного цвета отечную жидкость, которая может истекать с пузырьками газа, в других — ткани остаются сухими, но из них с шипением выходят пузырьки газа. Последнее бывает при поражении ткани клостридией перфрингенс. Пораженная мышечная ткань имеет вид вареного мяса, при развитии отека — кашицеобразной массы, коричневой за счет гемолиза. Клиника гангрены чрезвычайно разнообразна и зависит от вирулентности возбудителей, общего состояния больного (раненого), глубины и быстроты распространения инфекции, локализации раны, ее характера, величины разрушенного мышечного массива. Длительность инкубационного периода от нескольких часов до нескольких недель, в среднем 2—5 суток. В зависимости от наличия отека и газа (эмфиземы) в тканях выделяют эмфизематозную, отечную, или токсическую, газовоотечную, гнилостно-гнойную и смешанную формы анаэробной инфекции. По скорости распространения различают быстро и медленно распространяющуюся, по глубине — поверхностную и глубокую. Основными ранними признаками инфекции являются отек, чувство распирающей боли в ране и газообразование. При газовой форме можно при дотрагивании пальцами ощутить характерный звук, напоминающий хруст снега под ногами. Крепитацию газов под кожей можно вызвать, проводя ребром руки по коже (симптом «бритвы» Н. Н. Петрова). Иммунитет Перенесенная инфекция не оставляет иммунитета. Ведущая роль в защите от токсина принадлежит антитоксинам. Микробиологическая диагностика Материал для исследования (кусочки пораженных тканей, раневое отделяемое) микроскопируют. Диагноз подтверждается при обнаружении грам «+» палочек в материале в отсутствии лейкоцитов. Проводят бактериологическое исследование – обнаружение С.perfringens в фекалиях – пищевая токсикоинфекция; Лечение. Хирургическое: удаляют некротические ткани. Вводят антитоксические сыворотки, применяют антибиотики и гипербарическую оксигенацию. Антитоксические сыворотки - в жидком и сухом виде после очистки методом ферментативного гидролиза анатоксических сывороток, полученных при иммунизации лошадей анатоксинами. Применяют для экстренной профилактики и специфической терапии. Профилактика. Хирургическая обработка ран, соблюдение асептики и антисептики при операциях. Для специфической активной иммунизации применяют анатоксин в составе секстанатоксина, создающий приобретенный, искусственный, активный, антитоксический иммунитет.
74) Возбудитель чумы, свойства и биологические особенности возбудителя. Yersinia pestis – возбудитель чумы. Является зоонозом. Возбудители чумы имеют форму мелких грамотрицательных овоидных палочек размером 1,5*0,7 мкм с закруглёнными концами, которые в мазках располагаются одиночно, короткими цепочками или небольшими группами. В мазках, окрашенных по Романовскому-Гимзе или метиленовым синим, имеют характерную биполярную окраску, когда концы палочек окрашиваются интенсивнее, чем середина, которая остаётся бледной. Характерным является полиморфизм, в старых культурах чумные микробы образуют инволюционные формы - кокковидные, булавовидные, нитчатые и гигантские. Полиморфизм усиливается при культивировании в средах, которые содержат 3 % NaCl. Они неподвижны, спор не образуют, имеют нежную капсулу, которую выявляют в мазках из патологического материала.
Культивирование. Возбудители чумы являются факультативными анаэробами, растут при рН от 5 до 9,6 (оптимум - 7,2) и температуре 2-45ºС (оптимальной температурой является 27ºC, но капсула образует-ся только при 37ºC). Они нетребовательны к факторам роста и культивируются на обычных питательных средах. При культивировании на мясо-пептонном агаре образуют мелкие нежные прозрачные круглые ко-лонии (напоминают кружевной платочек), которые при продолжительном культивировании становятся непрозрачными. На кровяном агаре имеют тёмно-коричневый цвет вследствие адсорбции ними пигмента гемина. На жидких средах палочки чумы образуют поверхностную плёнку, от которой вниз опускаются нитчатые образования, похожие на пещерные сталактиты, на дне пробирок возникает осадок. Ферментативные свойства. Палочки чумы разлагают до кислоты без газа глюкозу, мальтозу и маннитол, не расщепляют лактозу, сахарозу и рамнозу, не продуцируют индол. Тест с метиленовым красным - положительный, тесты Фогеса-Проскауэра и на цитрат - отрицательные. Желатин не разжижают, молоко не свёртывают, каталазо- и эскулинположительны, оксидазо- и уреазоотрицательны. Девиньо выделил 3 физиологических типа Y. pestis на основании способности ферментировать глицерол и расщеплять нитраты . Это разделение имеет эпидемиологическое значение в связи с различной географической распространённостью типов. Вирулентные штаммы продуцируют бактериоцин (пестицин I), который угнетает рост штаммов Y. pseudotuberculosis, Y. enterocolitica и E. coli, а также коагулазу и фибринолизин.
Токсинообразование. Термином “чумные токсины” обозначают минимум 2 класса токсинов, обнаруженных в фильтратах культур и клеточных лизатах. Первый является эндотоксином - липополисахаридом, похожим на эндотоксины кишечных бактерий. Токсины второго класса имеют белковую природу и обладают некоторыми свойствами как экзотоксинов, так и эндотоксинов. Они являются термолабильными и из них можно приготовить анатоксины, но они плохо растворяются в средах и высвобождаются только при лизисе бактериальных клеток. Их называют “мышиными токсинами”, поскольку они действуют на крыс и мышей и не влияют на гвинейских свинок, кроликов и приматов. Антигенная структура является сложной. При диффузии в геле и биохимическом анализе было выявлено минимум 20 антигенов, большинство из которых являются факторами вирулентности. Термолабильный белковый капсульный антиген (фракция I) лучше всего образуется в культурах, которые инкубируют при 37ºC; он угнетает фагоцитоз и присутствует только у вирулентных штаммов. Два антигена (V и W), которые всегда продуцируются вместе, также являются факторами вирулентности, которые угнетают фагоцитоз и внутриклеточное разрушение возбудителей; их продукция кодируется плазмидами. Классификация. Возбудители чумы являются антигенно гомогенными, серотипов не существует.
Резистентность. Чумные палочки быстро разрушаются под действием нагревания (до 55ºC), солнечного света, высушивания и химических дезинфектантов (0,5 % раствор фенола убивает их через 15 минут). Они долго сохраняют жизнеспособность в холодной и мокрой среде; выживают несколько месяцев и даже размножаются в почве нор грызунов. Все штаммы лизируются специфическим противочумным бактериофагом при 22ºC.
75) Пути передачи, патогенез, клинические проявления и диагностика чумы. Патогенез и заболевание человека. Заражение человека может происходить различными путями: трансмиссивным (через укусы блох), контактным (при снятии шкурок с инфицированных промышленных грызунов), алиментарным (при употреблении в пищу продуктов, контаминированных чумными бактериями), воздушно-капельным (от больных легочной чумой людей).
У людей чума может протекать в трёх формах: бубонной, пневмонической и септицемической. При бубонной форме после инкубационного периода в 2-5 дней инфицируются лимфатические узлы, расположенные возле очага инвазии бактерий. Поскольку возбудители чумы попадают в организм через укусы блох за ноги, инфицируются паховые лимфатические узлы, отсюда и название - “бубон” (от bubon - пах). Узлы увеличиваются и начинают гноиться, бактерии попадают в кровоток и вызывают септицемию, иногда возникают кровоизлияния в кожу и слизистые оболочки. Диссеминированное внутрисосудистое свертывание крови возникает очень часто и может привести к гангрене кожи, пальцев и полового члена. При отсутствии лечения смертность составляет 30-90 %.
При эпидемиях бубонной чумы в некоторых случаях возникает чумная пневмония. Очень редко может развиться первичная пневмоническая чума в эпидемической форме. Пневмоническая чума передаётся воздушно-капельным путем, бактерии распространяются по лимфатической системе, вызывая геморрагическую пневмонию с цианозом и выделением большого количества возбудителей с мокротой при кашле. Пневмоническая чума является чрезвычайно инфекционной и при отсутствии лечения вызывает смерть в 90-100 % случаев.
Септицемическая чума является обычно терминальным проявлением бубонной или пневмонической чумы, но в некоторых случаях может возникать первично. При некоторых эпидемиях наблюдали случаи “мягкой чумы” (Pestis minor). Крайне редко могут развиваться менингеальные симптомы, носительство не описано, но бессимптомную инфекцию горла наблюдали у контактных лиц.
Иммунитет. После перенесенного заболевания развивается стойкий продолжительный иммунитет, который носит клеточный характер. В его формировании значительную роль играют протективные антигены возбудителей (капсульный антиген используют для изготовления химической противочумной вакцины).
Лабораторная диагностика. Чума - это особо опасная инфекция, в связи с чем микробиологические исследования проводит в специальных лабораториях соответственно подготовленный персонал в противочумных костюмах со строгим соблюдением противоэпидемического режима. Для лабораторного подтверждения диагноза чумы используют бактериоскопический, бактериологический, биологический, серологический и экспресс-методы. Материалом для исследования могут быть выделения из язв, пунктат бубона, мокрота, кровь, моча, испражнения, трупы грызунов, блохи. Мазки для микроскопии фиксируют в смеси Никифорова, окрашивают метиленовым синим, по Романовскому-Гимзе и по Граму. Первичная бактериоскопия дает возможность сделать лишь предварительное заключение. Более доказательным является выделение чистой культуры и её идентификация. Для этого материал засевают на мясо-пептонный или кровяной агар с добавлением стимуляторов роста и антифаговой сыворотки. Выделенные культуры идентифицируют по морфологическим, культуральным и биохимическим свойствам и лизису чумным фагом. При использовании биологического метода исследуемый материал вводят в брюшную полость гвинейским свинкам, при наличии возбудителей чумы свинка гибнет через 5-7 дней. Положительная биологическая проба имеет решающее значение в диагностике чумы. Из серологических методов для ретроспективной диагностики используют реакцию пассивной гемагглютинации с эритроцитами, покрытыми белковым капсульным антигеном (фракция I), иммуноферментный анализ.
Важное значение имеют экспресс-методы диагностики: реакция иммунофлуоресценции, быстрый рост возбудителя на обогащённой элективной среде, фагодиагностика.
76) Бруцеллы, виды, биологические свойства, пути передачи, патогенез. Род Brucella составляют очень мелкие неподвижные аэробные грамотрицательные коккобактерии, плохо растущие на обычных питательных средах и слабо или совсем не ферментирующие углеводы и другие вещества. Они являются строгими паразитами животных и могут также инфицировать людей. Бруцеллёз (мальтийская лихорадка) является зоонозом, который первично поражает коз, овец, крупный рогатый скот, буйволов, свиней и других животных и передаётся человеку при контакте с инфицированными животными или через их мясо и молоко. Виды: Brucella melitensis, B. abortus, B. suis, B. сanis, B. оvis, B. Neotomae. В 2004 г. B. abortus, B. canis, B. ovis и B. suis были переименованы в Brucella melitensis. Бруцеллы являются коккобактериями или короткими палочками размером 0,5-0,7*0,6-1,5 мкм, которые в мазках располагаются одиночно или короткими цепочками. Их клетки настолько малы, что могут быть по ошибке приняты за кокки. В старых культурах можно наблюдать появление нетипичных форм. Они неподвижны, не образуют спор и капсул, грамотрицательные, часто окрашиваются биполярно.
Культивирование. Бруцеллы являются строгими аэробами. B. abortus являются капнофилами, многие штаммы нуждаются в присутствии 5-10 % двуокиси углерода для роста. Оптимальной температурой является 37ºС (растут при 20-40ºС), рН - 6,6-7,4. Они могут расти на простых средах, но очень медленно, их трудно изолировать из исследуемого материала. Для культивирования бруцелл используют сывороточно-декстрозный агар, сывороточно-картофельный агар, соевый агар с триптиказой или агар с триптозой. Если к этим средам добавляют бацитрацин, полимиксин и циклогексимид, они становятся селективными. В жидких средах рост бруцелл неравномерен, старые культуры образуют муть и слизистый осадок; на плотных средах они образуют небольшие, влажные, прозрачные и сияющие колонии трех типов (слизистые, S- и R-формы) в зависимости от изменений антигенной структуры и вирулентности.
Бруцеллы растут на хорионаллантоисной мембране куриных эмбрионов, приводя к их гибели через несколько дней. Все растут внутриклеточно - в эктодермальных клетках, клетках мезодермального происхождения и в эндотелии. Эритритол стимулирует рост большинства штаммов бруцелл.
Ферментативные свойства. Бруцеллы не ферментируют карбогидраты, но имеют окислительную активность. Они являются каталазо- и оксидазоположительными (кроме B. neotomae и B. ovis, которые являются отрицательными) и уреазоположительными, редуцируют нитраты до нитритов, не утилизируют цитрат, не продуцируют индол, тесты с метиленовым красным и Фогеса-Проскауэра отрицательные.
Токсинообразование. Бруцеллы не продуцируют растворимые токсины. При разрушении бактериальных клеток выделяется эндотоксин с высокой аллергенной активностью, который используют для проведения аллергических кожных проб. Антигенная структура. Соматические антигены бруцелл содержат 2 основные антигенные детерминанты - А и М, которые присутствуют в различных количествах у трёх основных видов.
Резистентность. Бруцеллы гибнут при нагревании до 60ºС через 10 минут, при действии 1 % раствора фенола - через 15 минут. Они выживают в грунте и удобрениях на протяжении нескольких недель; остаются жизнеспособными в течение 10 дней в замороженном молоке (но гибнут при пастеризации), 1 месяц - в мороженом, 4 месяца - в масле и мясе и в течение разного времени в сырах в зависимости от их рН. Они чувствительны к действию прямого солнечного света и кислот. B. melitensis остаются жизнеспособными в моче в течение 6 дней, в пыли - 6 недель и в воде - 10 недель.
Патогенез и заболевание человека. Все четыре основных вида бруцелл являются патогенными для людей, наиболее патогенными являются B. melitensis, наименее - B. abortus и B. canis, B. suis занимают промежуточное положение. У человека бруцеллёз возникает вследствие прямого или непрямого заражения от животных; от человека к человеку заболевание не передаётся. Источником инфицирования людей являются обычно козы, овцы, крупный рогатый скот, буйволы и свиньи; в некоторых частях света - собаки, северные олени, карибу, верблюды и яки. Пути передачи - алиментарный, контактный, аэрогенный.
Бруцеллы распространяются из первичного очага инфекции через лимфатические сосуды к локальным лимфатическим железам, в клетках которых они размножаются. Потом они попадают в кровоток и распространяются по всему организму. Они имеют тропность к плаценте вследствие присутствия в ней эритритола - ростового фактора для культивирования бруцелл. Бруцеллёз первично является заболеванием ретикулоэндотелиальной системы. Бруцеллы имеют особую склонность к внутриклеточному росту и растут даже в фагоцитах, что предопределяет их устойчивость к химиотерапии и феномен одновременного существования живых бактерий и высоких титров циркулирующих антител. Иммунитет при бруцеллёзе является, в основном, клеточно-опосредованным, активированные макрофаги способны разрушать бактерии. Это, возможно, является наиболее важным механизмом в выздоровлении больных и в формировании иммунного ответа при бруцеллёзе. Тканевой ответ на внедрение бруцелл формируется из образования гранулёмы из эпителиальных и гигантских клеток, лимфоцитов и плазмоцитов; гранулёмы заменяются соединительной тканью и иногда кальцинируются.
Инфекция у человека может быть трёх типов: (1) латентный бруцеллёз только с серологическими проявлениями, (2) острый или подострый бруцеллёз и (3) хронический бруцеллёз.
Острый бруцеллёз, который называют волнообразной лихорадкой, вызывают преимущественно B. melitensis. Он ассоциирован с продолжительной бактериемией. Лихорадка является нерегулярной, обычно состоит из нестойких волн или колебаний высокой температуры чёткого обратного типа. Симптомы варьируют, наблюдают боль в мышцах и суставах, приступы астмы, ночное потоотделение, истощение, анорексию, запор, повышенную раздражительность и снижение температуры. Частыми осложнениями являются нарушения слухового анализатора, костей, внутренних органов или нервной системы.
Хронический бруцеллёз, обычно не сопровождающийся развитием бактериемии, является бессимптомной инфекцией с периодическими обострениями; основными симптомами, которые относят к состоянию гиперчувствительности у пациента, являются потоотделение, утомляемость и боль в суставах при отсутствии лихорадки. Заболевание длится годами.
77) Микробиологическая диагностика туляремии, лечение и профилактика. Материал для исследования : Гной из бубонов, пунктат лимфатических узлов, соскоб из язвы, отделяемое конъюнктивы, налет из зева мокрота, кровь, паталого-анатомический материал. • Бактериоскопический метод • Бактериологический метод • Серологический метод • Аллергопробы • Биологический метод • Экспресс-методы диагностики Бактериоскопическое исследование: Из исследуемого материала готовят мазки, окрашивают по Грамму. В чистой культуре - мелкие кокки. В мазках из органов преобладают палочковидные формы. Спор не образуют, грамотрицательные, иногда выражена биполярная окраска. Бактериологическое исследование и биопроба. Применяются для выделения чистой культуры бактерий туляремии. Наиболее чувствительными животными являются мыши и морские свинки, которые погибают даже при подкожном введении единичных бактерий. Выделение бактерий туляремии проводят на свернутой яично-желточной среде, глюкозоцистиновом кровяном агаре. Вирулентные штаммы образуют S-формы колоний—мелкие, гладкие, беловатого цвета с голубоватым оттенком. Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, биохимическим и антигенным свойствам. Биохимические свойства этих бактерий выявляются на специальной плотной среде с ограниченным содержанием белка. Бактерии туляремии содержат оболочечный антиген, с которым связаны их вирулентные и иммуногенные свойства, и О-соматический антиген. По антигенным свойствам близки к бруцеллам. Серодиагностика. Ставится реакция агглютинации с туляремийным диагностикумом. Относительно позднее появление агглютининов в крови (на 2-й неделе болезни) затрудняет применение этой реакции для ранней диагностики, однако их длительное сохранение делает возможной ретроспективную диагностику. Обязательно прослеживается нарастание титра агглютинации. Наиболее чувствительным методом серодиагностики туляремии является РПГА. Для экспресс-диагностики применяется кровяно-капельная реакция: кровь из пальца наносят на стекло, добавляют каплю дистиллированной воды (для лизиса эритроцитов), вносят каплю диагностикума и смешивают стеклянной палочкой. При наличии в крови агглютининов в диагностическом титре (1:100 и выше) в капле немедленно наступает агглютинация диагностикума; при титрах ниже диагностических агглютинация происходит через 2—3 мин. Кожно-аллергическая проба. Выпускаются два вида тулярина: для внутрикожной пробы и для надкожной. Проба высокочувствительна и дает положительные результаты у больных, начиная с 3—5-го дня болезни, но также и у переболевших и вакцинированных, поэтому оценка реакции должна проводиться с осторожностью. Лечение: антибиотики стрептомицинового и тетрациклинового ряда. В случае затяжного течения – комбинированная антибиотикотерапия с использованием убитой лечебной сыворотки. Профилактика: специфическая профилактика - применяют живую туляремийную вакцину. Иммунитет длительный, проверяется с помощью пробы с тулярином. Туляремийный диагностикум – взвесь убитых бактерий туляремии, применяется в случае постановки реакции агглютинации при серодиагностике. Тулярин – взвесь туляремийных бактерий (вакцинного штамма), убитых нагреванием, для постановки кожно-аллергической пробы. Туляремийная живая сухая накожная вакцина – высушенная живая культура вакцинного штамма, для профилактики.
78) Сибирская язва, биологические особенности, патогенез. Возбудитель сибирской язвы — Bacillus anlhracis — типичный представитель патогенных бацилл. Относится к семейству Bacillaceae, роду Bacillus. Этот микроб часто называют бациллой антракса. Сибирская язва (Anthrax) — зооантропоноз. Инфекционный процесс протекает преимущественно остро, с явлениями септицемии или с образованием различной величины карбункулов. Болезнь регистрируют в виде спорадических случаев, возможны энзоотии и даже эпизоотии. Бациллы антракса довольно крупные (1... 1,3x3,0... 10,0 мкм) палочки, неподвижные, грамположительные; образуют капсулу и споры (рис.25, 26, 27, 28). Микроб встречается в двух формах: вегетативной, в виде палочки различной величины клеток (капсульных и бескапсульных), и споровой. Споры могут быть заключены в хорошо выраженный экзоспориум и находиться внутри и вне палочек в виде изолированных телец. В окрашенных препаратах из крови и тканей, больных или погибших от сибирской язвы животных бациллы располагаются одиночно, попарно и в виде коротких цепочек (3...4 клетки, окруженные капсулой). Концы палочек в цепочках прямые, с резко обрубленными концами, а свободные — слегка закругленные. Иногда цепочки имеют форму бамбуковой трости. В мазках из культур, на плотных и в жидких питательных средах палочки располагаются длинными цепочками. Сибиреязвенная бацилла во внешней среде при неблагоприятных условиях существования формирует споры. В каждой вегетативной клетке образуется только одна эндоспора, чаше располагающаяся центрально, реже — субтерминально. Споры овальные, иногда округлые. Размеры зрелых спор колеблются в пределах 1,2...1,5 мкм в длину и 0,8...1,0 мкм в поперечнике. Сибиреязвенный микроб по способу дыхания относят к факультативным анаэробам: он хорошо размножается в обычных атмосферных условиях и в условиях пониженного содержания кислорода. Бацилла антракса нетребовательна к условиям питания и хорошо растет на универсальных средах (МПБ, МПА, МПЖ, картофеле, молоке). Кроме того, может расти на различных растительных субстратах: настоях соломы, сена, экстрактах гороха, сои, вики, ломтиках вареного картофеля, свеклы, моркови и др. Оптимальная температура роста культуры 35...37 "С; при температуре ниже 12 и выше 45 °С она не растет; оптимум рН среды 7,2...7,6. Биохимия. В. anthracis вырабатывает следующие ферменты: липазу, диастазу, протеазу, желатиназу, дегидразу, цитохромоксидазу, пероксидазу, каталазу и др. Некоторые штаммы образуют сероводород, выделяют аммиак. Токсинообразование. Бацилла антракса образует сложный экзотоксин, включающий в себя три компонента (фактора): эдематогенный фактор (EF), протективный антиген (РА) и летальный фактор (LF), или соответственно факторы I, II, III. Их синтезируют капсульные и бескапсульные варианты микроба. Антигенная структура. В состав антигенов бациллы антракса входят неиммуногенный соматический полисахаридный комплекс и капсульный глутаминполипептид. Сибиреязвенный соматический антиген очень часто обозначают буквой С, капсульный полипсптид — буквой Р. Устойчивость. Возбудитель сибирской язвы проявляет высокую чувствительность к пенициллину, хлортетрациклину и левомицетину, а также к литическому действию лизоцима. Патогенез. Бацилла антракса обладает выраженной инвазивностью и легко проникает через царапины кожных покровов или слизистых оболочек. Заражение животных происходит преимущественно алиментарным путем. Через поврежденную слизистую оболочку пищеварительного тракта микроб проникает в лимфатическую систему, а затем в кровь, где фагоцитируется и разносится по всему организму, фиксируясь в элементах лимфоидномакрофагальной системы, после чего снова мигрирует в кровь, обусловливая септицемию. Размножаясь в организме, бацилла антракса синтезирует капсульный полипептид и выделяет экзотоксин. Капсулъное вещество ингибирует опсонизацию, в то время как экзотоксин разрушает фагоциты, поражает центральную нервную систему, вызывает отек, гипергликемию и повышение активности щелочной фосфатазы. В терминальной фазе процесса в крови снижается содержание кислорода до уровня, несовместимого с жизнью. Резко нарушается метаболизм, развивается вторичный шок, и наступает гибель животных. Возбудитель сибирской язвы может выделяться из организма с бронхиальной слизью, слюной, молоком, мочой и испражнениями.
79) Лаб.диагностика сибирской язвы, лечение и профилактика. Исследование проводят по обычной схеме: бактериоскопия мазков, выделение и изучение свойств чистой культуры, биопроба на лабораторных животных, при необходимости серологические исследования — реакция преципитации и иммунофлюорссцентный анализ. Бактериоскопия. Из патологического материала готовят мазки, часть которых красят по Граму и обязательно на наличие капсулы — по Михину, Ребигеру, Ольту и др. Важным диагностическим признаком является обнаружение типичных по морфологии капсульных палочек. Посев на питательные среды. Исходный материал засевают в МПБ и на МПА (рН 7,2...7,6), посевы инкубируют при 37 °С в течение 18...24 ч; при отсутствии роста выдерживают в термостате еще 2 сут. Культуры просматривают, определяют их типичность, готовят препараты, микроскопируют. В мазках из культур обнаруживают бескапсульные палочки, расположенные длинными цепочками, и споры. Биологическая проба. Заражают белых мышей, морских свинок, кроликов одновременно с посевом материала на питательные среды. Белым мышам вводят подкожно в заднюю часть спины (по 0,1...0,2 мл), морским свинкам и кроликам — под кожу в область живота (по 0,5...1,0 мл). Мыши погибают через 1...2 сут, морские свинки и кролики — через 2...4 сут. Павших животных вскрывают, делают мазки и посевы из крови, сердца, селезенки, печени и инфильтрата на месте инъекции исследуемого материала. Идентификация бациллы антракса. В природе существует несколько видов аэробных споровых сибиреязвенноподобных сапрофитов: В. сегеш, В. megaterium, В. mycoides и В. subtilis. По морфологии они схожи с В.антракс, поэтому следует их дифференцировать. Идентификацию и дифференциацию культуры проводят на основании главных и дополнительных признаков. К главным относят патогенность, капсулообразование, определение подвижности, тест «жемчужного ожерелья, пробу со специфическим фагом, иммунофлюоресцентный тест, к дополнительным — тесты на отсутствие гемолиза и лицетиназной активности, образование фосфатазы. Бацилла антракса патогенна для лабораторных животных. Сибиреязвенноподобные сапрофиты не вызывают их гибель, за исключением В. cereus, которая убивает белых мышей при внутрибрюшинном заражении. Массивную с четкими контурами капсулу в организме образует только возбудитель сибирской язвы. Тест «жемчужного ожерелья» основан на способности пенициллина угнетать синтез клеточной стенки бациллы антракса и образовывать сферопласты. Испытуемую трехчасовую бульонную культуру высевают на МПА в чашки Петри: в первой чашке содержится 0,5, во второй —0,05 ЕД пенициллина в 1 мл среды, третья —контрольная. Посевы инкубируют 3 ч при 37 °С. На агаре с пенициллином бацилла антракса растет в виде цепочек, состоящих из шарообразных клеток, напоминающих ожерелье из жемчуга. Сибиреязвенноподобные сапрофиты на агаре с пенициллином этого феномена не образуют. Проба с бактериофагом (лизабельность фагом). Сибиреязвенный фаг, взаимодействуя с гомологичной культурой, вызывает ее лизис. Эту высокоспецифичную реакцию применяют для идентификации бациллы антракса, а также дифференциации ее от ложносибиреязвенных бацилл. Иммунофлюоресцентный тест. Идентификация возбудителя сибирской язвы при помощи флюоресцирующих антител — ориентировочный метод, который требует дополнительного изучения вирулентности, капсулообразования, фагочувствительности. Подвижность устанавливается микроскопически или путем посева культуры уколом в столбик 0,3%-го МПА. Неподвижные культуры растут только по ходу укола, подвижные — дают диффузный рост. Возбудитель сибирской язвы неподвижен, тогда как многие спорообразующие аэробные сапрофиты подвижны. Гемолитическая активность не может быть надежным критерием дифференциации: как правило, бациллы антракса не гемолизируют эритроциты барана или же лизируют их очень медленно и незначительно, но этот признак у разных штаммов вариабелен. Лецитиназная активность у возбудителя сибирской язвы низкая: медленно свертывает или вообще не свертывает желток куриного яйца. Серологическое исследование. Для обнаружения сибиреязвенных антигенов применяют реакцию преципитации по Асколи. Эту реакцию используют для исследования на сибирскую язву кожевенного и мехового сырья, загнившего патологического материала, в котором происходит лизис бациллы антракса, а также для исследования свежего патологического материала и серологической идентификации выделенных культур. РП по Асколи— достоверный и широко применяемый в практике тест серологической диагностики сибирской язвы. В качестве серологического теста, главным образом для изучения антигенного спектра бациллы антракса, применяют реакцию диффузионной преципитации (РДП). Для идентификации и дифференциации возбудителя сибирской язвы от сходных микроорганизмов применяют селективную агаровую среду для выявления щелочной фосфатазы по изменению цвета колоний после воздействия паров аммиака. При этом сибиреязвенные колонии цвет не изменяют. С целью дифференциации от антракоидов рекомендована реакция диск преципитации, которая сочетает бактериологическую и серологическую диагностики.
Лечение и профилактика. Используют живую вакцину ВГНКИ, ассоциированную живую вакцину против сибирской язвы и эмфизематозного карбункула крупного рогатого скота. Для лечения и пассивной профилактики применяют антибиотики, противосибиреязвенную гипериммунную сыворотку и гамма-глобулин. Пассивный иммунитет наступает через несколько часов и сохраняется до 14 сут.
80) Эшерихии, морфология, культивирование, эпидемиология. Патогенез и клинические формы эшерифиозов. Триба I: Ешерихии. Род: 1. Escherichia. 2. Edwardsiella. 3. Citrobacter. 4. Salmonella. 5. Shigella.
Морфология. E. coli являются грамотрицательными прямыми палочками длиной 1-3 мкм, шириной 0,4-0,7 мкм, в мазках располагаются хаотически, поодиночке или парами. Большинство штаммов имеет жгутики (перитрихи), хотя встречаются и неподвижные варианты. Некоторые разновидности образуют капсулы и фимбрии; спор не образуют.
Культивирование. Кишечные палочки являются факультативными анаэробами. Хорошо растут на обычных средах при оптимальной температуре 37ºC (10-40ºC), образуют плосковыпуклые, гладкие, полупрозрачные серовато-белые круглые колонии - S-формы; R-формы имеют плоскую поверхность и неправильную форму. S-R-вариации возникают как последствие повторных субкультивирований и связаны с потерей поверхностных антигенов и вирулентности. Некоторые штаммы образуют “слизистые” колонии.
Многие штаммы, особенно изолированные из патологического материала, вызывают гемолиз при культивировании на кровяном агаре. На средах Эндо и МакКонки колонии окрашены в насыщенный красный цвет с металлическим блеском вследствие ферментации лактозы. Кишечные палочки хорошо растут в бульоне, вызывая диффузное помутнение с образованием осадка. Более 85 % штаммов кишечных палочек синтезируют колицины - вещества с антагонистическим действием на патогенные энтеробактерии. Кроме того, они способны синтезировать витамины K2, E и группы В, необходимые для жизнедеятельности организма человека.
Патогенез и заболевание человека. Кишечные палочки, как обычные комменсалы толстой кишки, у здоровых людей не вызывают заболеваний. Они являются условно-патогенными микроорганизмами и лишь при ослаблении защитных сил организма (иммунодефицитные состояния) могут вызвать развитие определённых болезнетворных процессов. E. coli вызывают четыре вида инфекций: (1) инфекции мочевыделительного тракта; (2) диарею или гастроэнтерит; (3) гнойные инфекции и (4) септицемию. Инфекции мочевыделительного тракта вызывают серогруппы О1, О2, О4, О6, О7 и др. Диарею вызывают энтеропатогенные, энтеротоксигенные, энтероинвазивные и энтерогеморрагические кишечные палочки. Эпидемиология. Источником инфекции есть люди, больные эшерихиоз, реже - реконвалесценты и здоровые бактерионосители. Изредка источником инфекции становятся инфицированные животные и птицы (поросята, телята, куры). Основной механизм передачи инфекции фекально-оральный через инфицированные молочные продукты, овощи, фрукты, в меньшей степени - через мясные продукты. Кроме пищевого пути передачи инфекции возможны водный и контактно-бытовой. Дети обычно заражаются от взрослых (мать, медицинский персонал). В детских коллективах инфекция распространяется через загрязненные игрушки, предметы ухода, руки персонала. У взрослых механизм передачи такой, как и при дизентерии (инфицированные продукты питания, вода, загрязненные руки, предметы ухода, мухи, почва и т.д.). Среди кишечных инфекций у детей эшерихиоз составляет 15-30%, среди взрослых этот показатель меньше (5-15%). Иммунитет при эшерихиозы преимущественно типоспецифический, непродолжителен.
81) Лаб.диагностика эшерихиозов, лечение и профилактика. Лабораторная диагностика колиэнтеритов сводится к выделению культуры патогенного серовара от больного и его идентификации. Материалом для исследования являются испражнения больных, рвотные массы, выделения из рото- и носоглотки. Материал засевают на среды МакКонки и Эндо, потом характерные колонии (красные с металлическим блеском) агглютинируют с соответствующими диагностическими ОК-поливалентными сыворотками. Колонии, которые дали положительную реакцию агглютинации на стекле, засевают на скошенный агар и выделенную чистую культуру идентифицируют по морфологическим, биохимическим и антигенным свойствам. Решающей является постановка развёрнутой реакции агглютинации. Для ускоренной идентификации эшерихий применяют реакцию иммунной флуоресценции, что даёт возможность получить ответ через 1-2 часа. Лечение. Для лечения используют антибиотики (тетрациклин, левомицетин, ампициллин) и нитрофурановые препараты. Хорошие результаты дает применение бифидумбактерина, лактобактерина, бификола. Профилактика. Для предупреждения колиэнтеритов и других коли-инфекций необходимо проводить раннюю диагностику и немедленное лечение. Большое значение имеет соблюдение санитарно-гигиенического режима в родильных домах, детских садах и яслях, молочных кухнях. Специфическая профилактика не разработана.
82) Возбудители брюшного тифа и паратифов. К роду Salmonella относятся возбудитель брюшного тифа S. typhi, паратифов — S. paratyphi A. Морфология и тинкториальные свойства. S. typhi, S. paratyphi A, S. schottmuelleri — короткие палочки с закругленными концами, имеют перитрихиальные жгутики, грамотрицательные.
Культивирование и ферментативные свойства. На дифференциально-диагностических средах (Эндо, Левина) образуют прозрачные бесцветные колонии. Сальмонеллы обладают сахаролитическими свойствами: S. typhi ферментирует глюкозу, мальтозу, маннит до кислоты, S. paratyphi и S. schottmuelleri — те. же сахара, но до кислоты и газа, что служит дифференциально-диагностическим признаком. При разложении белков S. typhi и S. schottmuelleri образуется сероводород. Желатин не разжижают.
Антигенная структура и токсинообразование сальмонелл. Сальмонеллы содержат О-антиген—липополисахаридно-протеиновый комплекс, идентичный эндотоксину, Н-антиген и К-антиген — поверхностный, оболочечный, капсульный. В Н-антигенах выделяют две фазы: первую — специфическую и вторую — не специфическую. При идентификации сальмонелл используются диагностические агглютинирующие адсорбированные сыворотки.
Сложная антигенная структура S. typhi включает О-, Н- и Vi-антигены, но такие полноценные в антигенном отношении бактерии выделяются только в разгар заболевания, а в период реконвалесценции и при пересевах в лабораторных условиях Vi-антиген теряется.
Резистентность. Сальмонеллы довольно устойчивы во внешней среде. В зависимости от условий (температура, влажность, инсоляция и др.) они могут сохраняться до года. Дезинфицирующие вещества вызывают гибель сальмонелл в течение нескольких минут, нагревание до 60 °С — через 10—15 мин.
Патогенез и клиника. Возбудители брюшного тифа и паратифов, проникнув через рот в организм человека, попадают в тонкую кишку и находят наиболее благоприятные условия для размножения в нижнем ее отрезке — фаза инвазии. Затем из тонкой кишки бактерии проникают через лимфатические образования (пейеровы бляшки и солитарные фолликулы) в регионарные лимфатические узлы, — наступает фаза мезентериального лимфаденита, продолжающаяся 10—12 дней. Это время инкубации, когда микробы интенсивно размножаются, что составляет главную биологическую сущность паразитирования. Затем бактерии постепенно проникают в кровоток, что соответствует появлению первых признаков заболевания, — наступает фаза бактериемии.
Клинические симптомы заболевания характеризуются постепенным повышением температуры, общим недомоганием, которое переходит в состояние глубокой интоксикации организма, за что заболевание и получило название typhus. Это состояние обусловлено действием эндотоксина, который в разгар заболевания выделяется в больших количествах в результате массовой гибели микробов, чему способствуют образующиеся антитела.
Бактерии с кровью попадают в печень, селезенку, костный мозг, лимфатические узлы тонкой кишки, где размножаются, обогащая кровь возбудителем. Наступает фаза паренхиматозной диффузии. Сальмонеллы, накапливаясь в желчном пузыре в массовом количестве, вторично попадают в тонкую кишку и размножаются в лимфатических образованиях, которые воспаляются, некротизируются, изъязвляются, что может привести к разрушению стенки кишечника, т.е. перфорации — одному из тяжелейших осложнений брюшного тифа. Особенно благоприятные условия для размножения тифозные бактерии находят в желчном пузыре, где они задерживаются наиболее долго и, выделяясь в кишечник, усиливают патологические его поражения. Выделительно-аллергическая фаза выделения микробов — составляет следующий этап патогенеза. Выделяются бактерии из организма не только с испражнениями, но и с мочой, молоком кормящей матери. Выделительная стадия переходит в стадию выздоровления, сопровождающуюся возрастанием титра специфических антител.
Иммунитет. Врожденного иммунитета к инфекциям, вызываемым возбудителями брюшного тифа и паратифов, не существует. Перенесенное заболевание оставляет прочный иммунитет и случаи повторного заболевания редки. Однако возможны рецидивы, а переболевшие брюшным тифом становятся хроническими бактерионосителями.
Лабораторная диагностика сальмонелл. При диагностике учитываются эпидемиологические данные и клинические симптомы. С первого дня заболевания необходимо исследовать кровь. Метод гемокультуры является решающим и ранним методом. Наилучшей элективной питательной средой служит среда с желчью, нейтрализующая антитела, бактерицидные свойства сыворотки крови. Можно выделять культуру возбудителя из костного мозга, мочи, розеол, но эти методы применяются редко. В период реконвалесценции выделяют возбудителя из испражнений. Выделенные культуры идентифицируются по биохимическим и антигенным свойствам.
При определении вида сальмонелл сначала ставится реакция агглютинации с поливалентной сывороткой, дающей возможность определить принадлежность выделенной культуры к роду сальмонелл, затем определяется группа с помощью отдельных групповых адсорбированных сывороток, а затем и вид сальмонелл — в реакции агглютинации с монореценторными специфическими Н-сыворотками.
Исследование сыворотки больных может проводиться в первые дни заболевания обнаружением неполных антител с помощью реакции Кумбса и с 4—5-го дня — полных антител в реакции Видаля, которую ставят повторно через несколько дней с целью определения нарастания титра антител. С целью обнаружения антител в сыворотках крови больных брюшным тифом применяется реакция непрямой гемагглютинации (РНГА).
Большую трудность представляет выявление бактерионосителей. Бактериологические исследования, носящие массовый характер при периодических обследованиях работников пищевых предприятий и детских учреждений, занимают много времени и не всегда результативны, так как даже от заведомо известного носителя трудно бывает выделить микроб. В настоящее время для обнаружения носителя широко используют серологический метод—реакцию Vi-гемагглютинации с сывороткой носителя. Vi-антиген по химической природе является полисахаридом, его извлекают в чистом виде и адсорбируют на поверхности эритроцитов 0 группы крови человека. Сыворотка носителя вызывает реакцию гемагглютинации при взаимодействии с Vi-эритроцитарным диагностикумом. У носителя реакция положительна в небольших разведениях. Выявленные реакцией Vi-гемагглютинации носители обследуются бактериологическими методами (выделение культуры из испражнений, дуоденального содержимого).
Специфическое лечение и профилактика. Для лечения больных применяются антибиотики широкого спектра действия, группа тетрациклина, левомицетин. Антибиотикотерапия, однако, не предупреждает рецидивы и длительное бактерионосительство.
Кроме антибиотиков, рекомендуют проводить лечение средствами, которые специфически стимулируют иммуногенез (корпускулярная вакцина, парциальные антигены). При комплексной иммуноантибиотикотерапии (антибиотики и раздельно моновакцина и Vi-антиген) у больных брюшным тифом значительно сокращается частота рецидивов, отсутствует формирование бактерионосительства. С целью профилактики применяются брюшнотифозная спиртовая вакцина, обогащенная Vi-антигеном (по эпидемическим показаниям). Для иммунизации военнослужащих используется химическая сорбированная тифозно-паратифозно-столбнячная вакцина (TABle), coдержащая выделенные из брюшнотифозных, паратифозных А и В бактерий комплексные антигены и очищенный столбнячный анатоксин.
83) Возбудители сальмонеллезов и острых гастроэнтеритов. Сальмонеллёзы - это острые инфекционные зоонозные заболевания, которые вызывают сальмонеллы, и характеризуются преобладающим поражением кишок и интоксикацией. Чаще всего заболевание вызывают S. typhimurium, S. haldar, S. enteritidis, S. heidelberg, S. agona, S. virchow, S. seftenberg, S. indiana, S. newport и S. anatum.
Антигенная структура. Возбудители сальмонеллёзов выделяют энтеротоксины и имеют эндотокси-ны, которые обусловливают клиническую симптоматику заболеваний и явления интоксикации организма.
Гастроэнтериты — группа полиэтиологичных острых инфекционных болезней человека, животных и птиц с фекально-оральным механизмом передачи.
Основные возбудители сальмонеллезного гастроентерита — S. typhimurium, S. heidelberg, S. enteritica, S. derby. Большинство возбудителей выделяют у человека и различных животных (основной резервуар), но также регистрируют серовары, имеющие только одного или ограниченное количество хозяев (например, S. sendai выделяют только у человека, a S. gallinarum-pullorum — у птиц). Основной источник заражения человека (до 50%) — домашняя птица (особенно куры и водоплавающие птицы) и яйца (сальмонеллы способны не только инфицировать скорлупу, но и проникать внутрь). Эпидемиологическую опасность могут представлять инфицированные сальмонеллами крупный рогатый скот, свиньи, овцы и лошади. Сальмонеллы передаются с мясом и мясными продуктами. Реже выявляют поражения, вызванные употреблением рыбы, овощей и фруктов. Заболевания сальмонеллезным гастроэнтеритом регистрируют повсеместно, в теплый сезон (с мая по октябрь) отмечают подъём заболеваемости. Патогенез поражений нередко связан с предшествующими медицинскими манипуляциями (фиброэзофагогастродуоденоскопия и др.), а бактерии выделяют из смывов с различных предметов оборудования, вентиляционных решёток и из воздуха палат. Клинически выделяют гастроинтестинальные и генерализованные формы сальмонеллеза. Последние разделяют на тифоподобные (с гастроэнтеритом, поражениями ЦНС и сыпью) и септикопиемические (сепсис сальмоиеллёзной этиологии) варианты сальмонеллеза. Наиболее часто сальмонеллез вызывают S. typhimurium, S. haifa, S. anatum, S. panama, S. infantus, S. enteritidis. Морфология. Соответствует общей характеристике семейства Enterobacteriaceae. Сальмонеллы подвижные, перитрихи. Культивирование. Сальмонеллы - факультативные анаэробы; оптимум роста 37°С; хорошо растут на обычных питательных средах. Ферментативные свойства. Сальмонеллы не разжижают желатин, не продуцируют индол, большинство видов выделяет сероводород, ферментирует глюкозу, маннит с образованием кислоты и газа. Токсинообразование. Сальмонеллы экзотоксин не образуют, их болезнетворное действие на организм животных и людей связано с эндотоксином, который характеризуется высокой токсичностью. Антигенная структура. По схеме Кауфмана-Уайта S. enteritidis отнесена в группу D, S. typhimurium - в группу В, S. cholerae-suis - в группу С. Резистентность. Сальмонеллы сравнительно устойчивы к действию высокой температуры (60 - 75°С), больших концентраций хлорида натрия и некоторых кислот. Не погибают в 8 - 10% растворе уксусной кислоты в течение 18 ч. Эндотоксины их могут длительно сохраняться и после варки мяса в толще больших кусков или при недостаточном прожаривании в котлетах и других изделиях. Характерной особенностью пищевых продуктов, обсемененных сальмонеллами, является то, что в них отсутствуют изменения, обнаруживаемые органолептически. Патогенез заболевания у человека. Основными источниками заражения людей являются больные сальмонеллезом животные и птицы Возбудители сальмонеллеза попадают в организм человека с пищей. Из просвета кишечника они внедряются в энтероциты и в составе фагосомоподобных вакуолей достигают собственной пластинки слизистой оболочки тонкой кишки, где подвергаются фагоцитозу макрофагами и лейкоцитами. Всасывание продуктов жизнедеятельности и эндотоксина, высвобождающегося при распаде микроорганизмов, наступает в результате внедрения сальмонелл в энтероциты и воздействия на них микробных ферментов (протеаз, муциназ, декарбоксилаз и др.). В макрофагах сальмонеллы размножаются, а при гибели фагоцитов освобождаются медиаторы воспаления (гистамин, серототонин и др.). По лимфатическим путям бактерии проходят в лимфатические узлы, а у некоторых больных генерализация процесса приводит к попаданию и размножению сальмонелл во внутренних органах. Токсины сальмонелл (эндотоксин, энтеротоксин, цитотоксин) оказывают прямое повреждающее действие на клетки слизистой оболочки, что приводит к диарее, нарушают проницаемость клеточных мембран, в результате чего развивается интоксикация, усиливается диарея, наступает обезвоживание организма. Возбудитель сальмонеллеза и его токсины играют роль пускового механизма, а затем вызванные ими нарушения функции пищеварительной, сердечно-сосудистой, нервной систем доминируют в клинических проявления болезни. Обычно заболевание протекает как острый гастроэнтероколит и через 3-5 дней заканчивается выздоровлением. Из переболевших около 2-3 % остаются носителями сальмонелл. Таким образом, сальмонеллезы являются зоонозноантропонозными заболеваниями. Лабораторная диагностика. Испражнения, рвотные массы, промывные воды, кровь, моча, органы трупов, остатки пищи, смывы с предметов, собранные самым тщательным образом, изучают в определенной последовательности: вначале производят посевы на те же питательные среды, которые используются для диагностики брюшного тифа и паратифов А и В, затем определяют культуральные, серологические и биологические свойства выделенных культур. Биологическую пробу ставят не только с культурами, но и с остатками пищи, вызвавшей отравление. Для ретроспективного диагноза на 8 - 10-й день исследуют кровь реконвалесцентов на наличие агглютининов путем постановки реакции Видаля с диагностикумами основных видов возбудителей пищевых токсикоинфекций. Лечение. Производят промывание желудка, вливание глюкозы и изотонического раствора хлорида натрия, по показаниям назначают антибактериальные препараты (левомицетин, тетрациклин, поливалентный бактериофаг). Профилактика. Профилактика сальмонеллезных токсикоинфекций обеспечивается ветеринарно-санитарным надзором за состоянием скота, убойных площадок, предприятий мясной и рыбной промышленности, лабораторным контролем выпускаемой в продажу мясной продукции, стерилизацией условно годного мяса. Медико-санитарная служба выявляет носителей среди работников пищевых предприятий, столовых и других пищевых блоков, контролирует строжайшее выполнение санитарного режима на пищевых предприятиях, в магазинах, складах, столовых, проведение санитарно-просветительной работы среди населения, санируют носителей из реконвалесцентов сальмонеллезным фагом.
Помимо сальмонелл, пищевые отравления могут быть вызваны стафилококками, стрептококками и условно-патогенными бактериями.
