
- •Введение
- •Часть I Материаловедение
- •1. Строение и свойства материалов
- •1.1. Классификация материалов
- •Плазма газ жидкость твердое тело
- •1.2. Кристаллическое строение материалов
- •1.3. Дефекты кристаллического строения
- •1.3.1. Точечные дефекты
- •1.3.2. Линейные дефекты
- •1.3.3. Поверхностные и объемные дефекты
- •2. Крсталлизация металлов и сплавов
- •2.1. Межатомное взаимодействие
- •2.2. Гомогенная и гетерогенная кристаллизация
- •2.3. Строение металлического слитка
- •2.4. Аморфные металлические сплавы
- •3. Деформация и разрушение металлов
- •3.1. Упругая и пластическая деформация
- •3.2 Деформация моно- и поликристаллов
- •3.3. Влияние нагрева на структуру деформированного металла
- •3.4. Свойства материалов и методы их испытаний
- •4. Основы теории двойных сплавов
- •4.1. Строение сплавов
- •4.2. Диаграммы состояния двойных сплавов
- •5. Железоуглеродистые сплавы
- •5.1. Компоненты и фазы
- •5.2. Превращения в сплавах системы железо–цементит
- •5.2.1. Первичная кристаллизация сталей
- •5.2.2. Вторичная кристаллизация сталей
- •5.2.3. Влияние углерода и постоянных примесей на свойства стали
- •5.2.4. Кристаллизация белых чугунов
- •5.3. Превращения в сплавах системы железо–графит
- •6. Основы термической обработки сталей
- •6.1. Основные превращения в стали
- •6.2. Отжиг стали
- •6.3. Закалка и отпуск
- •7. Поверхностное упрочнение деталей
- •7.1. Упрочнение методом пластической деформации
- •7.2. Упрочнение методом поверхностной закалки
- •7.3. Химико-термическая обработка
- •8. Легированные стали
- •8.1. Маркировка легированных сталей
- •8.2. Классификация легированных сталей
- •8.2.1. Конструкционные стали
- •8.2.2. Инструментальные стали
- •8.2.3. Стали и сплавы с особыми свойствами
- •9. Цветные металлы и сплавы
- •9.1. Титан и его сплавы
- •9.2 Алюминий и его сплавы
- •9.3. Магний и его сплавы
- •9.4. Медь и ее сплавы
- •9.5. Другие цветные металлы и сплавы
- •10. Неметаллические и композиционные материалы
- •10.1. Полимеры
- •10.2. Пластмассы
- •10.3. Композиционные материалы
- •10.3. Керамические материалы
- •Часть 2 Технология конструкционных материалов
- •11. Металлургическое производство
- •11.1. Основные сведения о производстве чугуна
- •11.2. Производство стали
- •11.3. Разливка стали
- •12. Литейное производство
- •12.1. Литейные свойства сплавов
- •12.2. Литье в песчано-глинистые формы
- •12.3. Плавильные печи
- •12.4. Специальные способы литья
- •12.5. Сплавы для изготовления отливок
- •13. Обработка металлов давлением
- •13.1. Прокатка
- •13.2. Волочение и прессование
- •13.3. Ковка
- •13.4. Штамповка
- •14. Обработка металлов резанием
- •14.1. Основы резания металлов
- •14.2. Обработка на токарных станках
- •14.3. Обработка на сверлильных станках
- •14.4. Обработка на фрезерных станках
- •14.5. Обработка на строгальных и долбежных станках
- •14.6. Обработка на шлифовальных и отделочных станках
- •14.7. Точность и качество поверхности при обработке
- •15. Сварка, резка и пайка
- •15.1. Сварка металлов плавлением
- •15.2. Сварка металлов давлением
- •15.3. Термическая резка металлов
- •Области применения способов термической резки
- •15.4. Пайка металлов
- •16. Электрофизические и электрохимические способы обработки материалов
- •16.1. Электрофизические способы
- •16.2. Электрохимические способы
- •17. Основы рационального выбора материалов
- •17.1. Выбор материала
- •17.2. Основные направления экономии материалов
- •Литература
- •Оглавление
- •Евгений Петрович Чинков
- •Андрей Геннадьевич Багинский
- •Материаловедение и технология
- •Конструкционных материалов
- •Подписано к печати.
2.2. Гомогенная и гетерогенная кристаллизация
Переход металла из жидкого или парообразного состояния в твердое (кристаллическое) состояние называется первичной кристаллизацией. Образование новых кристаллов в твердом теле называют вторичной кристаллизацией. Процесс кристаллизации, как установил Д.К. Чернов, осуществляется в два этапа:
возникновение центров кристаллизации (зародышей);
рост кристаллов из образовавшихся центров.
Различают два варианта зарождения кристаллов – гомогенное (в объеме жидкой фазы) и гетерогенное (на поверхности твердых частиц, неметаллических включений, стенок изложниц и др.).
Гомогенная кристаллизация. Состояние системы характеризуется внутренней энергией, которая складывается из энергии движения атомов (ионов), электронов, энергии упругих искажений кристаллической решетки и т. д. Часть энергии, которая при изотермических условиях может быть превращена в работу, называется свободной:
F = U – T S,
где F – свободная энергия, U – полная внутренняя энергия, T – температура; S – энтропия. Вещество может находиться в твердом, жидком или газообразном агрегатных состояниях. Переход в новое состояние возможен, если оно обладает меньшим запасом свободной энергии.
С ростом температуры свободная энергия F металла в жидком и твердом состояниях уменьшается (рис. 2.4):
![]() .
.
П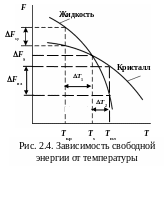 ри
равновесной
температуре
кристаллизации Тs
свободные
энергии жидкой
и твердой фаз одинаковы, обе фазы
сосуществуют одновременно, изменение
энергии не происходит:
ри
равновесной
температуре
кристаллизации Тs
свободные
энергии жидкой
и твердой фаз одинаковы, обе фазы
сосуществуют одновременно, изменение
энергии не происходит:
Fs = Fж – Fт = 0.
Процесс кристаллизации должен быть термодинамически выгоден, сопровождаться уменьшением свободной энергии. Это возможно тогда, когда жидкая фаза будет охлаждена ниже Тs до практической температуры кристаллизации Ткр. Переход из жидкого состояния в твердое сопровождается выделением энергии: Fкр = Fж – Fт > 0.
Охлаждение расплава ниже равновесной температуры называют переохлаждением и характеризуют степенью переохлаждения:
T1 = Тs – Ткр.
Плавление – процесс обратный кристаллизации – происходит при перегреве выше равновесной температуры. Переход из твердого состояния в жидкое сопровождается поглощением энергии: Fпл = Fж – Fт < 0.
Нагревание расплава выше равновесной температуры называют перегревом и характеризуют степенью перегрева: T2 = Тпл – Тs.
Разница между реальными температурами плавления и кристаллизации – температурный гистерезис.
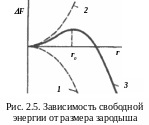
Механизм процесса кристаллизации. Наиболее распространена теория зародышеобразования Гиббса-Фольмера. При переходе из жидкого в твердое состояние выигрыш в свободной энергии (рис. 2.5, кривая 1) должен быть больше затрат энергии на образование поверхности раздела жидкость-кристалл, т. е. поверхности зародыша (кривая 2). Изменение свободной энергии зародыша определяется алгебраической суммой объемной и поверхностной энергий соответственно:
![]()
 .
.
Чем меньше зародыш, тем больше отношение его поверхности к объему, большая доля от общей энергии приходится на поверхностную энергию. Поэтому образование зародышей малого радиуса (r < r0) – термодинамически невыгодный процесс.
Т аким
образом, увеличение размера зародыша
сначала приводит к росту свободной
энергии, при некотором значении r0
–
к
уменьшению (рис. 2.5, кривая 3).
Минимальный размер способного к росту
зародыша называется критическим,
зародыш – устойчивым.
Поскольку при
r
= r0
функция проходит через максимум, то
критический размер зародыша определяется
из условия
аким
образом, увеличение размера зародыша
сначала приводит к росту свободной
энергии, при некотором значении r0
–
к
уменьшению (рис. 2.5, кривая 3).
Минимальный размер способного к росту
зародыша называется критическим,
зародыш – устойчивым.
Поскольку при
r
= r0
функция проходит через максимум, то
критический размер зародыша определяется
из условия
![]() .
Зародыш
критического размера r0
с
одинаковой вероятностью может, как
увеличить свой размер, так и уменьшиться
(расплавиться).
.
Зародыш
критического размера r0
с
одинаковой вероятностью может, как
увеличить свой размер, так и уменьшиться
(расплавиться).
Зародыши образуются независимо друг от друга, растущие кристаллы имеют правильную форму (рис. 2.6). При срастании с другими кристаллами начальная форма нарушается, кристаллы называют зернами. Их рост продолжается в направлениях оставшихся участков жидкого металла.
Для образования и роста зародышей требуется диффузионное перемещение атомов. Каждой температуре кристаллизации (степени переохлаждения) отвечает определенный размер устойчивого зародыша: мелкие растворяются в жидкости, крупные растут. Чем ниже температура (больше степень переохлаждения), тем меньше размер зародыша, тем больше центров кристаллизации образуется в единицу времени, тем быстрее идет процесс кристаллизации.
П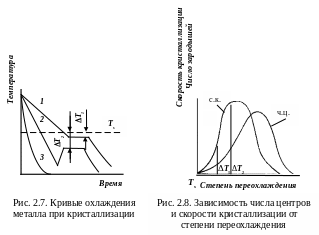 ри
медленном охлаждении (рис. 2.7,
кривая 1)
степень
переохлаждения T1
мала (рис. 2.8),
кристаллизация
протекает при высокой температуре,
близкой к равновесной.
На кривой
температура-время
появляется горизонтальная площадка,
так как отвод тепла компенсируется
выделяющейся при кристаллизации скрытой
теплотой кристаллизации.
В
расплаве за единицу времени в единице
объема образуется мало зародышей
(размерность
–
мм-3∙с-1)
из которых вырастают крупные кристаллы.
Новые зародыши, как правило, не образуются.
ри
медленном охлаждении (рис. 2.7,
кривая 1)
степень
переохлаждения T1
мала (рис. 2.8),
кристаллизация
протекает при высокой температуре,
близкой к равновесной.
На кривой
температура-время
появляется горизонтальная площадка,
так как отвод тепла компенсируется
выделяющейся при кристаллизации скрытой
теплотой кристаллизации.
В
расплаве за единицу времени в единице
объема образуется мало зародышей
(размерность
–
мм-3∙с-1)
из которых вырастают крупные кристаллы.
Новые зародыши, как правило, не образуются.
С увеличением скорости охлаждения кристаллизация протекает при более низкой температуре. Скрытая теплота бурно выделяется в начальный момент кристаллизации, температура резко повышается (кривая 2). Число зародышей увеличивается, из них вырастает много мелких кристаллов. Скорость увеличения линейных размеров кристалла (скорость кристаллизации) имеет размерность мм∙с-1. При большой степени переохлаждения (кривая 3) число центров кристаллизации и скорость роста кристаллов равны нулю и образуется аморфная структура – металлическое стекло.
Степень переохлаждения зависит от объема жидкого металла и его чистоты. При большом объеме жидкого металла выделяющаяся при кристаллизации теплота повышает температуру практически до равновесной; при малом объеме – выделяющейся теплоты недостаточно, кристаллизация происходит с большей степенью переохлаждения. Значительное переохлаждение достигается только при затвердевании очень чистых металлов. У технически чистых металлов и сплавов степень переохлаждения невелика: 10–30 °С. Соли, силикаты, органические вещества, наоборот, склонны к переохлаждению.
Гетерогенная кристаллизация. Самопроизвольное образование зародышей происходит только в чистом жидком металле. Образование зародышей часто происходит на инородных включениях (примесях), которые всегда присутствуют в расплаве.
Если атомы примеси и затвердевающего металла имеют одинаковые кристаллические решетки (структурный фактор) и размеры атомов не отличаются более чем на 5–7 % (размерный фактор), то такие изоморфные примеси играют роль готовых центров кристаллизации. Структурное сходство между поверхностями сопряжения зародыша и включения приводит к уменьшению критического размера зародыша. Затвердевание начинается при меньшем переохлаждении, чем при самопроизвольной кристаллизации. Чем больше примесей, тем больше центров кристаллизации и мельче зерно. Такое образование зародышей называют гетерогенным. Кристаллизация обычно начинается от стенок формы, которые играют ту же роль, что и включения.
Если неизоморфные примеси имеют контакт с затвердевающим металлом, то строение их поверхностного слоя изменяется, приспосабливаясь к строению кристаллов металла – активация примесей. На активированной примеси осаждаются атомы затвердевающего металла.
Растворенные в жидком металле поверхностно-активные примеси могут измельчать зерно и изменять форму растущего кристалла, осаждаясь тонким слоем на его поверхности. Это приводит к уменьшению поверхностной энергии на границе раздела.
модифицирование – введение в расплав различных веществ (модификаторов) с целью повышения механических, технологических и эксплуатационных свойств отливок путем измельчения структуры. Кроме модифицирования, применяют физические воздействия на структуру кристаллизующегося металла: регулирование температуры расплава и его охлаждение при переливе, вибрацию, ультразвук, электромагнитное перемешивание и др. Есть и комбинированные способы: ввод модификаторов и наложение колебаний с ультразвуковой частотой.
Установлено два типа воздействия модификаторов на структуру.
Монотонное измельчение зерна с повышением содержания модификатора. При содержании более 0,2–0,6 % оно стабилизируется.
Немонотонное измельчение зерна с областью оптимальной концентрации 0,01–0,1 %. Превышение приводит к увеличению размера зерна. Монотонное уменьшение размера зерна с повышением концентрации модификатора характерно для нерастворимых примесей (титан в алюминии), немонотонное – для поверхностно-активных растворимых примесей (например, магний в цинке).
При модифицировании стали используются алюминий, титан, ванадий, для чугунов – магний, церий.
Демодификаторы – добавки, повышающие размер зерна. Они увеличивают работу образования зародыша, задерживают его образование и понижают вероятность возникновения центра кристаллизации.
