
- •Введение
- •Часть I Материаловедение
- •1. Строение и свойства материалов
- •1.1. Классификация материалов
- •Плазма газ жидкость твердое тело
- •1.2. Кристаллическое строение материалов
- •1.3. Дефекты кристаллического строения
- •1.3.1. Точечные дефекты
- •1.3.2. Линейные дефекты
- •1.3.3. Поверхностные и объемные дефекты
- •2. Крсталлизация металлов и сплавов
- •2.1. Межатомное взаимодействие
- •2.2. Гомогенная и гетерогенная кристаллизация
- •2.3. Строение металлического слитка
- •2.4. Аморфные металлические сплавы
- •3. Деформация и разрушение металлов
- •3.1. Упругая и пластическая деформация
- •3.2 Деформация моно- и поликристаллов
- •3.3. Влияние нагрева на структуру деформированного металла
- •3.4. Свойства материалов и методы их испытаний
- •4. Основы теории двойных сплавов
- •4.1. Строение сплавов
- •4.2. Диаграммы состояния двойных сплавов
- •5. Железоуглеродистые сплавы
- •5.1. Компоненты и фазы
- •5.2. Превращения в сплавах системы железо–цементит
- •5.2.1. Первичная кристаллизация сталей
- •5.2.2. Вторичная кристаллизация сталей
- •5.2.3. Влияние углерода и постоянных примесей на свойства стали
- •5.2.4. Кристаллизация белых чугунов
- •5.3. Превращения в сплавах системы железо–графит
- •6. Основы термической обработки сталей
- •6.1. Основные превращения в стали
- •6.2. Отжиг стали
- •6.3. Закалка и отпуск
- •7. Поверхностное упрочнение деталей
- •7.1. Упрочнение методом пластической деформации
- •7.2. Упрочнение методом поверхностной закалки
- •7.3. Химико-термическая обработка
- •8. Легированные стали
- •8.1. Маркировка легированных сталей
- •8.2. Классификация легированных сталей
- •8.2.1. Конструкционные стали
- •8.2.2. Инструментальные стали
- •8.2.3. Стали и сплавы с особыми свойствами
- •9. Цветные металлы и сплавы
- •9.1. Титан и его сплавы
- •9.2 Алюминий и его сплавы
- •9.3. Магний и его сплавы
- •9.4. Медь и ее сплавы
- •9.5. Другие цветные металлы и сплавы
- •10. Неметаллические и композиционные материалы
- •10.1. Полимеры
- •10.2. Пластмассы
- •10.3. Композиционные материалы
- •10.3. Керамические материалы
- •Часть 2 Технология конструкционных материалов
- •11. Металлургическое производство
- •11.1. Основные сведения о производстве чугуна
- •11.2. Производство стали
- •11.3. Разливка стали
- •12. Литейное производство
- •12.1. Литейные свойства сплавов
- •12.2. Литье в песчано-глинистые формы
- •12.3. Плавильные печи
- •12.4. Специальные способы литья
- •12.5. Сплавы для изготовления отливок
- •13. Обработка металлов давлением
- •13.1. Прокатка
- •13.2. Волочение и прессование
- •13.3. Ковка
- •13.4. Штамповка
- •14. Обработка металлов резанием
- •14.1. Основы резания металлов
- •14.2. Обработка на токарных станках
- •14.3. Обработка на сверлильных станках
- •14.4. Обработка на фрезерных станках
- •14.5. Обработка на строгальных и долбежных станках
- •14.6. Обработка на шлифовальных и отделочных станках
- •14.7. Точность и качество поверхности при обработке
- •15. Сварка, резка и пайка
- •15.1. Сварка металлов плавлением
- •15.2. Сварка металлов давлением
- •15.3. Термическая резка металлов
- •Области применения способов термической резки
- •15.4. Пайка металлов
- •16. Электрофизические и электрохимические способы обработки материалов
- •16.1. Электрофизические способы
- •16.2. Электрохимические способы
- •17. Основы рационального выбора материалов
- •17.1. Выбор материала
- •17.2. Основные направления экономии материалов
- •Литература
- •Оглавление
- •Евгений Петрович Чинков
- •Андрей Геннадьевич Багинский
- •Материаловедение и технология
- •Конструкционных материалов
- •Подписано к печати.
2. Крсталлизация металлов и сплавов
2.1. Межатомное взаимодействие
Движущими силами объединения атомов или молекул вещества (твердого, жидкого, газообразного) являются силы взаимного притяжения и отталкивания. Зная характер взаимодействия между атомами, можно прогнозировать свойства материалов.
Если энергия взаимодействующих атомов меньше суммарной энергии изолированных атомов, то между ними возникает взаимодействие. Между атомами могут действовать гравитационные, магнитные и электрические силы. Роль магнитных взаимодействий мала (10-6 эВ), а гравитационными силами можно вообще пренебречь (10-32 эВ). Электростатическая энергия взаимодействия элементарных электрических зарядов, находящихся на расстоянии 0,2–0,3 нм составляет:
U = e2 / r = – (5 – 7) эВ.
Это значение соответствует по порядку величины энергии связи атомов в кристаллах, обусловленной электрическим взаимодействием. При этом связь осуществляется валентными электронами атомов. Существенное различие между типами межатомных связей в твердых телах обусловлено качественным различиям в характере распределения валентных электронов и ионных остовов атомов.
П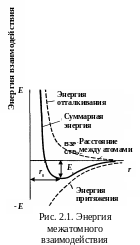 отенциальная
энергия взаимодействия двух атомов
зависит от расстояния r
между ними и может быть представлена в
виде суммы потенциалов притяжения и
отталкивания (рис.
2.1).
Энергия
притяжения в системе ион-электрон
является причиной металлической связи
и проявляется при всех значениях r.
Энергия отталкивания связана с деформацией
электронных оболочек ионов и проявляется
только на малых расстояниях. Величина
r0
– равновесное расстояние между атомами.
Энергию связи Eс
оценивается как работа, которую
необходимо затратить, чтобы оторвать
атом и
удалить в бесконечность.
отенциальная
энергия взаимодействия двух атомов
зависит от расстояния r
между ними и может быть представлена в
виде суммы потенциалов притяжения и
отталкивания (рис.
2.1).
Энергия
притяжения в системе ион-электрон
является причиной металлической связи
и проявляется при всех значениях r.
Энергия отталкивания связана с деформацией
электронных оболочек ионов и проявляется
только на малых расстояниях. Величина
r0
– равновесное расстояние между атомами.
Энергию связи Eс
оценивается как работа, которую
необходимо затратить, чтобы оторвать
атом и
удалить в бесконечность.
Химические связи. Тип связи в значительной степени определяется разностью электроотрицательностей элементов:
Δχ = χА – χВ,
где χА и χВ – электроотрицательности атомов А и В. Ионная связь возникает при полном или частичном обмене валентными электронами, ковалентная – при частичном. Металлическая связь по природе ковалентная, но при этом обобществляется множество электронов. Силы Ван-дер-Ваальса возникают без обмена зарядами.
Ковалентная (гомеополярная) связь возникает при небольшой разнице в электроотрицательностях атомов (Δχ < 2) за счет перекрытия электронных облаков. Обычно осуществляется двумя электронами с противоположно направленными спинами. В пространстве между атомами электроны создают состояния с повышенной электронной плотностью. Отрицательный заряд стремится сблизить ядра атомов. Если электронная плотность распределена симметрично между атомами, то ковалентная связь называется неполярной, если смещена в сторону одного из атомов, то такая связь называется полярной. Насыщенность связи – ограниченное число внешних электронов между ядрами образует ограниченное число химических связей. Направленность проявляется в одинаковом геометрическом строении близких по составу химических частиц. Поляризуемость выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер. Ковалентные кристаллы – в основном полупроводники и диэлектрики.
Ионная (гетерополярная) связь возникает при большой разнице в электроотрицательностях связываемых атомов (Δχ > 2). Менее электроотрицательный атом отдает свои валентные электроны и превращается в катион, более электроотрицательный присоединяет электроны и становится анионом. Связь образуется за счет электростатического взаимодействия противоположно заряженных ионов, которое не зависит от направления. О связи говорят как о ненаправленной и ненасыщенной. В ионных кристаллах не существует отдельных молекул, «молекулой» считается весь кристалл. Энергия связи – несколько электронвольт. Ионные кристаллы, в основном диэлектрики, имеют высокие температуры плавления, прозрачны в широком диапазоне частот.
Идеальной ионной связи нет. Полного перехода электронов не происходит, они частично остаются в общем пользовании. Кристаллическое строение типичного ионного кристалла NaCl нельзя объяснить, только исходя из сферического характера сил электростатического притяжения катионов к анионам. Ионы хлора имеют полностью достроенную внешнюю оболочку, включающую 2s-электрона и 6p-электронов. Электронная плотность s-электронов распределена в виде сферы, три пары p-электронов образуют гантели, вытянутые по осям координат. Размер этих орбиталей превышает диаметр сферы. В образовании структуры NaCl основную роль приобретает взаимодействие p-электронов. Под действием кулоновских сил ионы натрия и хлора сближаются, их внешние электронные орбитали частично перекрываются (рис. 2.2). Такое перекрытие, связанное с обменным взаимодействием, приводит к структуре элементарного куба.
Т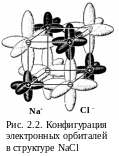 аким
образом, центральные ненаправленные
силы электростатического притяжения
лишь сближают катионы и анионы. Образование
кристаллической решетки происходит
благодаря обменному взаимодействию
p-орбиталей.
аким
образом, центральные ненаправленные
силы электростатического притяжения
лишь сближают катионы и анионы. Образование
кристаллической решетки происходит
благодаря обменному взаимодействию
p-орбиталей.
Металлическая связь. В кристаллической решетке металла внешние электроны покидают атомы, превращая их в катионы. Электростатическое взаимодействие обусловлено отталкиванием ионов (электронов) и притяжением ионов и электронов. Электроны стремятся приблизить катионы, уравновешивая силы отталкивания. Благодаря свободным электронам металлы хорошо проводят электрический ток и тепло. При нагревании колебания катионов увеличиваются, электронам труднее продвигаться между ними и электрическое сопротивление металла увеличивается. Металлическая связь существует в твердом, расплавленном и аморфном состоянии металлов.
П редставление
о том, что связи в металлах осуществляются
взаимодействием положительных ионов
с электронным газом нельзя считать
исчерпывающим. В качестве примера
рассмотрим возникновение химической
связи в кристалле натрия. Атомы
ионизированы не полностью, часть
валентных электронов остается связанной.
Кулоновское взаимодействие сближает
катионы натрия. Это приводит к частичному
перекрытию p-орбиталей
(рис. 2.3). Возникающие силы обменного
взаимодействия обеспечивают формирование
кристаллической структуры. Вклады
ионной
и ковалентной составляющих связи
обнаружены во многих металлах.
редставление
о том, что связи в металлах осуществляются
взаимодействием положительных ионов
с электронным газом нельзя считать
исчерпывающим. В качестве примера
рассмотрим возникновение химической
связи в кристалле натрия. Атомы
ионизированы не полностью, часть
валентных электронов остается связанной.
Кулоновское взаимодействие сближает
катионы натрия. Это приводит к частичному
перекрытию p-орбиталей
(рис. 2.3). Возникающие силы обменного
взаимодействия обеспечивают формирование
кристаллической структуры. Вклады
ионной
и ковалентной составляющих связи
обнаружены во многих металлах.
Молекулярная связь. Молекулярные кристаллы образованы молекулами, связанными слабыми ван-дер-ваальсовыми силами. Взаимодействие молекул не приводит к разрыву или образованию новых связей.
Ориентационное взаимодействие. В полярных молекулах центры тяжести положительного и отрицательного зарядов не совпадают и они ориентируются так, чтобы рядом находились концы молекул с противоположными зарядами, в результате возникают силы притяжения.
Индукционное взаимодействие возникает между полярными и неполярными молекулами. Неполярная молекула поляризуется и становится полярной, молекулы притягиваются слабее, чем в случае двух полярных молекул.
Дисперсионное взаимодействие возникает между неполярными молекулами. При движении электроны создают состояния с повышенной электронной плотностью с одной стороны молекулы. Неполярная молекула становится полярной. Это вызывает перераспределение зарядов в соседних молекулах, между ними устанавливаются кратковременные связи. Если бы молекулы только притягивались, то это привело бы к их слиянию. При сближении молекул, на малых расстояниях возникает межмолекулярное отталкивание электронных оболочек.
Внутри молекул атомы соединены прочными ковалентными связями. В молекулярных кристаллах плавление, испарение, возгонка (переход вещества из твердого состояния в газообразное, минуя жидкое) происходит без разрушения отдельных молекул. Для молекулярных кристаллов характерны низкие температуры плавления, большие коэффициенты теплового расширения, малая твердость. Молекулярные кристаллы образуют многие органические, металлоорганические и комплексные соединения, бинарные соединения (Н2О, СО2, НСl), некоторые твердые простые вещества (Н2, N2, O2). В кристаллах твердых инертных газов (Ar, Ne, Kr, Xe) силы Ван-дер-Ваальса связывают между собой не молекулы, а атомы. В электрическом отношении молекулярные кристаллы являются диэлектриками.
В реальных кристаллах химические связи в чистом виде встречаются редко: имеет место их наложение. Одна из них преобладает, определяя структуру и свойства твердого тела.
