
- •Введение
- •Часть I Материаловедение
- •1. Строение и свойства материалов
- •1.1. Классификация материалов
- •Плазма газ жидкость твердое тело
- •1.2. Кристаллическое строение материалов
- •1.3. Дефекты кристаллического строения
- •1.3.1. Точечные дефекты
- •1.3.2. Линейные дефекты
- •1.3.3. Поверхностные и объемные дефекты
- •2. Крсталлизация металлов и сплавов
- •2.1. Межатомное взаимодействие
- •2.2. Гомогенная и гетерогенная кристаллизация
- •2.3. Строение металлического слитка
- •2.4. Аморфные металлические сплавы
- •3. Деформация и разрушение металлов
- •3.1. Упругая и пластическая деформация
- •3.2 Деформация моно- и поликристаллов
- •3.3. Влияние нагрева на структуру деформированного металла
- •3.4. Свойства материалов и методы их испытаний
- •4. Основы теории двойных сплавов
- •4.1. Строение сплавов
- •4.2. Диаграммы состояния двойных сплавов
- •5. Железоуглеродистые сплавы
- •5.1. Компоненты и фазы
- •5.2. Превращения в сплавах системы железо–цементит
- •5.2.1. Первичная кристаллизация сталей
- •5.2.2. Вторичная кристаллизация сталей
- •5.2.3. Влияние углерода и постоянных примесей на свойства стали
- •5.2.4. Кристаллизация белых чугунов
- •5.3. Превращения в сплавах системы железо–графит
- •6. Основы термической обработки сталей
- •6.1. Основные превращения в стали
- •6.2. Отжиг стали
- •6.3. Закалка и отпуск
- •7. Поверхностное упрочнение деталей
- •7.1. Упрочнение методом пластической деформации
- •7.2. Упрочнение методом поверхностной закалки
- •7.3. Химико-термическая обработка
- •8. Легированные стали
- •8.1. Маркировка легированных сталей
- •8.2. Классификация легированных сталей
- •8.2.1. Конструкционные стали
- •8.2.2. Инструментальные стали
- •8.2.3. Стали и сплавы с особыми свойствами
- •9. Цветные металлы и сплавы
- •9.1. Титан и его сплавы
- •9.2 Алюминий и его сплавы
- •9.3. Магний и его сплавы
- •9.4. Медь и ее сплавы
- •9.5. Другие цветные металлы и сплавы
- •10. Неметаллические и композиционные материалы
- •10.1. Полимеры
- •10.2. Пластмассы
- •10.3. Композиционные материалы
- •10.3. Керамические материалы
- •Часть 2 Технология конструкционных материалов
- •11. Металлургическое производство
- •11.1. Основные сведения о производстве чугуна
- •11.2. Производство стали
- •11.3. Разливка стали
- •12. Литейное производство
- •12.1. Литейные свойства сплавов
- •12.2. Литье в песчано-глинистые формы
- •12.3. Плавильные печи
- •12.4. Специальные способы литья
- •12.5. Сплавы для изготовления отливок
- •13. Обработка металлов давлением
- •13.1. Прокатка
- •13.2. Волочение и прессование
- •13.3. Ковка
- •13.4. Штамповка
- •14. Обработка металлов резанием
- •14.1. Основы резания металлов
- •14.2. Обработка на токарных станках
- •14.3. Обработка на сверлильных станках
- •14.4. Обработка на фрезерных станках
- •14.5. Обработка на строгальных и долбежных станках
- •14.6. Обработка на шлифовальных и отделочных станках
- •14.7. Точность и качество поверхности при обработке
- •15. Сварка, резка и пайка
- •15.1. Сварка металлов плавлением
- •15.2. Сварка металлов давлением
- •15.3. Термическая резка металлов
- •Области применения способов термической резки
- •15.4. Пайка металлов
- •16. Электрофизические и электрохимические способы обработки материалов
- •16.1. Электрофизические способы
- •16.2. Электрохимические способы
- •17. Основы рационального выбора материалов
- •17.1. Выбор материала
- •17.2. Основные направления экономии материалов
- •Литература
- •Оглавление
- •Евгений Петрович Чинков
- •Андрей Геннадьевич Багинский
- •Материаловедение и технология
- •Конструкционных материалов
- •Подписано к печати.
5. Железоуглеродистые сплавы
5.1. Компоненты и фазы
Железо (Fe) – металл серебристо-белого цвета. Температура плавления – 1539 °С, плотность – 7,87 г/см3, атомная масса – 55,85. Атомный радиус – 0,127 нм, ионный: Fe2+ – 0,078 нм, Fe3+ – 0,064 нм. Имеет полиморфные модификации: -железо (Fe) с ОЦК решеткой ниже 911 °С и выше 1392 °С, -железо (Fe) с ГЦК решеткой, существующее в интервале 911–1392 °С. Высокотемпературную модификацию Fe называют δ-железо (Feδ). Период решетки -железа – 0,286 нм, -железа – 0,365 нм. При сильном сжатии -железо переходит в гексагональную -модификацию, плотность которой в 1,15 раза больше. При атмосферном давлении гексагональная модификация может быть достигнута путем легирования. До температуры 768 °С (точка Кюри) железо ферромагнитно. Твердость чистого железа (99,99 %) равна 490 МПа (49 НВ). Техническое железо также обладает низкой твердостью (80 НВ) и прочностью (σв = 250 МПа), высокой пластичностью (δ = 50 %, ψ = 80 %).
Железо со многими элементами образует твердые растворы: с металлами – замещения, с углеродом, азотом и водородом – внедрения.
Углерод (C) – неметалл. Атомная масса – 12,011. Атомный радиус – 0,077 нм; ковалентные радиусы: 0,077, 0,067 и 0,060 нм в одинарной, двойной и тройной связях; ионный радиус С4+ – 0,015 нм. Имеет несколько кристаллических модификаций (рис. 5.1).
У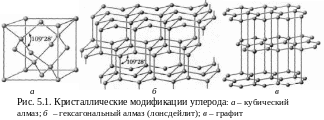 гексагонального -графита
(а
= 0,142 нм, с
= 0,335 нм) положение слоев повторяется
через один, слои связаны между собой
слабыми ван-дер-ваальсовыми силами
(рис. 5.1,в).
Плотность – 2,2 г/см3,
температура плавления – 3500 °С.
гексагонального -графита
(а
= 0,142 нм, с
= 0,335 нм) положение слоев повторяется
через один, слои связаны между собой
слабыми ван-дер-ваальсовыми силами
(рис. 5.1,в).
Плотность – 2,2 г/см3,
температура плавления – 3500 °С.
Углерод имеет 4 валентных электрона. В слое каждый атом углерода связан с тремя другими атомами углерода тремя компланарными sp2-гибридными орбиталями. Негибридизованные р-электроны образуют электронное облако как в металлах. В этом причина электропроводности графита и его блеска. Слоистое строение графита определяет анизотропию свойств: вдоль слоя электропроводность в 5000 раз больше, чем в поперечном направлении. Один слой связанных атомов легко скользит по другому слою. Графит хороший смазочный материал.
У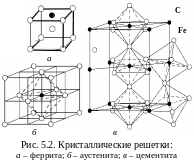 ромбоэдрического β-графита
каждый четвертый слой повторяет первый;
в
чистом виде не встречается. Атомы
углерода могут объединяются в линейные
цепочки – карбин
(sp-гибридизация),
который при температурах выше 1500 °С и
давлениях выше 4 ГПа (1 ГПа = 104
атм.) без катализатора превращается в
алмаз
(sp3-гибридизация).
Процесс ускоряется в присутствии
расплавленных металлов (Cr, Fe, Ni) и
неметаллов (красный фосфор), но алмазы
часто имеют черный цвет. Новый метод
синтеза прозрачных алмазов сантиметровых
размеров – выращивание из раствора
углерода в расплавленных карбонатах
щелочноземельных металлов при высоких
температурах и давлениях.
ромбоэдрического β-графита
каждый четвертый слой повторяет первый;
в
чистом виде не встречается. Атомы
углерода могут объединяются в линейные
цепочки – карбин
(sp-гибридизация),
который при температурах выше 1500 °С и
давлениях выше 4 ГПа (1 ГПа = 104
атм.) без катализатора превращается в
алмаз
(sp3-гибридизация).
Процесс ускоряется в присутствии
расплавленных металлов (Cr, Fe, Ni) и
неметаллов (красный фосфор), но алмазы
часто имеют черный цвет. Новый метод
синтеза прозрачных алмазов сантиметровых
размеров – выращивание из раствора
углерода в расплавленных карбонатах
щелочноземельных металлов при высоких
температурах и давлениях.
Фазы образующиеся при взаимодействии компонентов сплава.
Жидкая фаза (Ж). В жидком состоянии железо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
Феррит (Ф) (от лат. ferrum – железо) – твердый раствор внедрения углерода и других примесей (например, Mn, Si) в -железе (рис. 5.2,а). Атомы углерода располагаются в центре граней ОЦК решетки, в вакансиях, на дислокациях. Свойства феррита близки к свойствам железа. Он обладает малой прочностью (65–130 НВ, в = 250 МПа), высокой пластичностью ( = 50 %), магнитен до 768 °С. Максимальная растворимость углерода при 20°С – 0,006 % (точка Q на рис. 5.3), при 727 °С – 0,02 % (точка P). В интервале 1392–1539 °С существует высокотемпературный δ-феррит с предельной растворимостью углерода 0,1 % при 1499 °С (точка J).
Аустенит (А) (по имени английского ученого Р. Аустена) – твердый раствор углерода в -железе (рис. 5.2,б). Аустенит высокотемпературная фаза. При минимальной температуре существования – 727 °С имеет растворимость углерода 0,8 % (линия PSK на рис. 5.3), максимальную растворимость – 2,14 % при 1147 °С (точка Е). Аустенит прочнее феррита (200 НВ, = 40–50 %), парамагнитен.
Цементит (Ц) – химическое соединение железа с углеродом (карбид железа Fe3C) содержит 6,69 % углерода. Решетка состоит из октаэдров (рис. 5.2,в), оси которых наклонены друг к другу. При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при 210 °С, плотность – 7,82 г/см3. Цементит – метастабильная фаза: при нагревании разлагается на железо и углерод. Температура плавления указывается примерно: 1250–1550 °С. Цементит имеет высокую твердость (800 НВ, царапает стекло), но чрезвычайно низкую пластичность. Цементит первичный ЦI образуется из жидкой фазы в виде крупных пластинчатых кристаллов, вторичный ЦII – из аустенита в виде непрерывной сетки по границам зерен (при дальнейшем охлаждении вокруг зерен перлита), третичный ЦIII – из феррита в виде мелких межзеренных включений; их химические и физические свойства одинаковы.
