
- •Предисловие
- •Введение
- •1 Предмет курса "поверхностные явления
- •2 Классификация поверхностных явлений
- •3 Дисперсность, удельная поверхность
- •4 Классификация дисперсных систем
- •4.1 Классификация дисперсных систем по размерам частиц дисперсной фазы
- •4. 2 Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •4.3 Классификация по интенсивности взаимодействия дисперсной фазы и дисперсионной среды
- •4.4 Классификация по интенсивности взаимодействия
- •5 Поверхностные явления на границе раздела фаз
- •5.1 Поверхностная энергия, поверхностное натяжение
- •5.2 Термодинамика поверхности раздела фаз
- •5.3 Пути понижения энергии Гиббса на границе раздела фаз
- •5.4 Когезия. Работа когезии
- •5.5 Адгезия, работа адгезии, термодинамические основы адгезии
- •5.6 Смачивание, краевой угол смачивания, теплота смачивания, гидрофилизация и гидрофобизация поверхностей.
- •5.7 Растекание, критерий растекания, поверхностные пленки, двумерный газ
- •5.8 Адсорбция
- •5.8.1 Общие положения, классификация изотерм адсорбции
- •5.8.2 Фундаментальное термодинамическое уравнение адсорбции Гиббса
- •5.8.3 Адсорбция газов и паров на поверхности твердых тел
- •5.8.4 Уравнение адсорбции Фрейндлиха. Его анализ и решение
- •5.8.5 Мономолекулярная теория (теория Ленгмюра)
- •5.8.6 Полимолекулярная теория (теория Поляни)
- •5.8.7 Теория полимолекулярной адсорбции бэт
- •Пористые адсорбенты, классификация пористых тел по Дубинину
- •5.8.10 Влияние природы и структуры адсорбента, природы и свойств газов и паров на адсорбцию. Адсорбция из смеси газов.
- •5.9 Адсорбция из раствора на границе с газом
- •5.8.10.1. Молекулярная адсорбция
- •5.8.11.2. Ионная адсорбция (адсорбция электролитов)
- •5.8.12 Ионобменная адсорбция
5.9 Адсорбция из раствора на границе с газом
Термодинамический анализ состояния поверхностного слоя раствора на границе с газом позволяет выяснить влияние поверхностного натяжения раствора и термодинамической активности растворенного вещества на величину адсорбции. Впервые такую зависимость нашел Гиббс:
![]() ,
(V.32)
,
(V.32)
где a - термодинамическая активность;
- поверхностное натяжение раствора на границе с газом;
d/da - изменение поверхностного натяжения раствора при бесконечно малом изменении термодинамической активности.
Для
разбавленных растворов (для которых
![]() )
уравнение (V.32)
принимает вид:
)
уравнение (V.32)
принимает вид:
![]() ,
(V.33)
,
(V.33)
где С - концентрация раствора.
Это наиболее употребительная форма уравнения Гиббса. При этом надо помнить, что выражение (V.33) применимо только для сильно разбавленных растворов. С увеличением концентрации раствора активность компонента все в большей степени может отличаться от концентрации, а это может привести к появлению экстремума на изотерме адсорбции.
Величина g = – d/dС называется поверхностной активностью растворенного вещества для разбавленных растворов.
Выясним, влияет ли природа растворенного вещества на его адсорбцию?
По отношению к воде (в дальнейшем будем в качестве растворителя использовать воду) различают поверхностно-активные (ПАВ), поверхностно-инактивные (ПИАВ) и безразличные вещества.
П АВ
- это вещества, добавление которых
уменьшает поверхностное натяжение
воды. К ним относятся дифильные вещества,
молекулы которых состоят из радикала
и полярной функциональной группы
(например, R-COOH , R-NH2
, R-OH и т.д.). Условно ПАВ обозначают
так . Кружочком обозначают
функциональную группу, а черточкой -
углеводородный радикал.
АВ
- это вещества, добавление которых
уменьшает поверхностное натяжение
воды. К ним относятся дифильные вещества,
молекулы которых состоят из радикала
и полярной функциональной группы
(например, R-COOH , R-NH2
, R-OH и т.д.). Условно ПАВ обозначают
так . Кружочком обозначают
функциональную группу, а черточкой -
углеводородный радикал.
ПИАВ – это вещества, добавление которых увеличивает поверхностное натяжение воды. К таким веществам относятся неорганические электролиты (минеральные кислоты, щелочи, соли).
Безразличные вещества - это вещества, добавление которых не влияет на величину поверхностного натяжения. Так ведут себя сахара.
Проанализируем вид изотермы в зависимости от природы растворенного вещества.
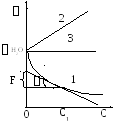
1. При растворении ПАВ с увеличением его концентрации раствора уменьшается (рис. V.27, кривая 1), следовательно, -d/dc>0 и величина адсорбции во всей области концентрации положительна (рис. V.28, кривая 1). Растворенное ПАВ стремится из объема раствора перейти на поверхность, при малой концентрации ПАВ ведет себя как двухмерный газ (имеет две степени свободы, рис. V.29а), а при значительной концентрации образует конденсированную пленку (рис. V.29б). Достигается максимальная величина адсорбции Гmax, которая на единице поверхности будет равна:
Гmax = 1/(NASo),
где So- площадь, занимаемая одной молекулой ПАВ (точнее ее полярной группой) в насыщенном монослое;
NA - число Авогадро.
Отсюда
So=1/(Гmax NA). (V.34)
При адсорбции ПАВ-гомологов с увеличением их концентрации величина адсорбции вначале возрастает до некоторого значения Гmax (часто обозначают Г), а затем остается неизменной. Существенно то, что у гомологов Гmax одинакова, так как в предельном случае образования конденсированной пленки (рисунок 7б) в поверхностном слое может располагаться одинаковое количество молекул гомологов, хотя они отличаются величиной неполярного углеводородного радикала.
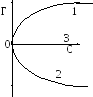
Рисунок
V.28
– Изотерма адсорбции различных веществ
на границе раствор-газ
Рисунок
V.27 – Изотерма поверхностного
натяжения при растворении различных
веществ в воде
2. При добавлении ПИАВ с повышением его концентрации (C) поверхностное натяжение раствора увеличивается (рис. V.27, кривая 2), поэтому -d/dС<0, а величина адсорбции во всей области имеет отрицательную величину (Г < 0) (рис. V.28, кривая 2), т.е. идет десорбция - ПИАВ стремится с поверхности уйти в объем раствора.
3. Растворение безразличных веществ не влияет на величину раствора (рис. V.27, кривая 3), т.е. d /dС = 0 и Г = 0, следовательно, безразличные вещества не адсорбируются на границе раздела фаз раствор- газ (рис. V.28, кривая 3).
Рассмотрим подробнее адсорбцию ПАВ.
Для построения изотермы адсорбции ПАВ на границе раздела жидкость -газ необходимо знать значения d/dС. Если экспериментально изучена зависимость = f (С) и построена изотерма поверхностного натяжения (рис. V.27, кривая 1), то графически путем проведения касательных к точкам, соответствующих концентрациям C, легко определить поверхностную активность G (рис. V.27), а затем рассчитать величину адсорбции Г. Например, для концентрации C1:
(V.35)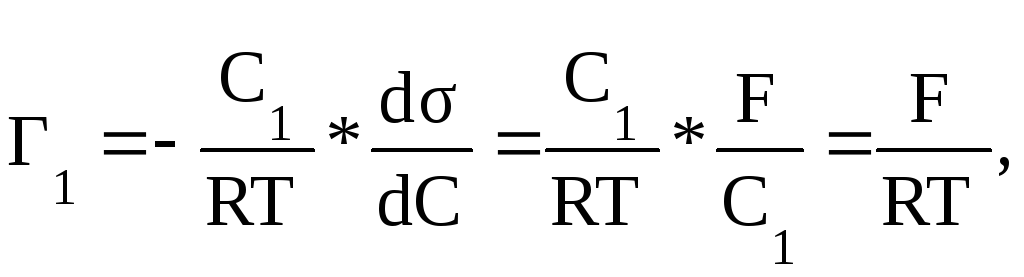
где F -отрезок, заключенный между точкой пересечения касательной с осью , при C=0 (значениев точке касания).
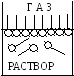
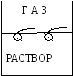
Рисунок
V.29
– Поведение растворенного ПАВ в
поверхностном слое в зависимости от
концентрации
а б
Поверхностная активность зависит как от химического строения молекулы ПАВ, так и от природы растворителя. Дюкло, а затем Траубе установили, что поверхностная активность предельных жирных кислот в водном растворе при температурах, близких к комнатной, возрастает в их гомологическом ряду на каждую группу -CH2 в среднем в 3,2 раза. Эта закономерность названа правилом Траубе и в подавляющих случаях соблюдается для адсорбции различных гомологов из водных растворов.
Таким образом, изотермы адсорбции различных жирных кислот-гомологов будут иметь вид, представленный на рисунке V.30.
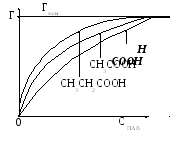
Рисунок
V.30
– Изотермы адсорбции жирных кислот
Анализ уравнения Гиббса показывает, что для построения изотермы адсорбции необходимо знать закономерность изменения поверхностного натяжения раствора от концентрации ПАВ. Такую закономерность можно установить экспериментально, однако надо помнить о трудоемкости и необходимой тщательности проведения такого эксперимента. Часто при построении изотерм поверхностного натяжения в широкой области концентрации ПАВ пользуются эмпирическим уравнением Шишковского:
=o- B ln (1+KС), (V.36)
где , o - поверхностное натяжение растворителя и раствора с концентрацией ПАВ;
B - константа для всех гомологов, учитывающая площадь, занимаемую полярной группой ПАВ в конденсированной пленке;
K -константа, характеризующая взаимодействие молекул ПАВ друг с другом в сплошном монослое и меняется в гомологическом ряду в соответствии с правилом Траубе.
Часто константы В, К в уравнении Шишковского заменяют на a и b:
=o- a ln (1+bС). (V.36a)
Для больших концентраций растворов, когда Kc>>1, уравнение (12) можно привести к линейному виду:
o - = =B ln K + B ln c. (V.37)
Измерив поверхностное натяжение раствора ПАВ всего лишь нескольких концентраций (не менее двух) в области больших концентраций, можно графически (рис. V.31) найти константы B и K , а затем рассчитать как , так и Г для любой концентрации раствора.
Рисунок
V.31
– Графическое нахождение констант
уравнения Шишковского
Ленгмюр, используя уравнение Шишковского, привел уравнение Гиббса (V.37) к виду:
G=G Kc/(1+KС), (V.38)
где G=B/(RT).
Уравнение (V.38) легко привести к линейному виду, решив его относительно либо С/G, либо 1/G:
C/G = 1/GmaxK + C/ Gmax , (V.39)
1/G = 1/ Gmax KC + 1/Gmax , (V.40) (16)
а затем графически (рис. V.37) найти константы уравнения (V.36).
Для построения графиков (рис. V.30, V.31) достаточно двух-трех значений, рассчитанных по уравнению (V.35) по данным изотермы поверхностного натяжения (рис. V.27) при С < 0,1.
Адсорбция из раствора на твердой поверхности
Адсорбция из раствора на твердом теле является практически наиболее распространенной, так как является основным методом разделения смесей и очистки производственных растворов от смесей.
Адсорбция из раствора более сложна по сравнению с адсорбцией из газовой фазы тем, что здесь явление сильно усложняется наличием третьего компонента – растворителя, который является конкурентом при адсорбции растворенного вещества.
В зависимости от степени взаимодействия растворенного вещества с растворителем различают молекулярную и ионную адсорбции из раствора на твердом теле.
