
- •I. Правила техники безопасности при работе в лаборатории
- •II. Классификация органических соединений. Номенклатура и изомерия.
- •Лабораторная работа № 1
- •Лабораторная работа № 2.
- •Предельные углеводороды.
- •Лабораторная работа № 3.
- •1.Насыщенных углеводородов.
- •2.Ненасыщенных углеводородов
- •Лабораторная работа № 5
- •Лабораторная работа № 6
- •Лабораторная работа № 7.
- •Лабораторная работа № 8.
- •Лабораторная работа № 10
- •Лабораторная работа № 11
- •Лабораторная работа № 12
- •Лабораторная работа № 13
- •Лабораторная работа № 14
- •Лабораторная работа №16
- •Лабораторная работа №17
- •Лабораторная работа №18
- •Лабораторная работа №19
- •Лабораторная работа № 20
- •Лабораторная работа № 20
- •Лабораторная работа № 21.
- •Содержание
Лабораторная работа № 11
Тема: Амины ароматические.
Ароматические мины – это производные аммиака, у которого атомы водорода (один, два или все три) замещены на радикалы и хотя бы один из них ароматический. По числу радикалов у атома азота амины делят на первичные ArNH2, вторичные Ar2NH и третичные Ar3N. Вторичные и третичные могут быть чисто ароматическими или смешанными. Анилин (фениламин), дифениламин, метилфениламин, аминотолуолы-толуидины орто-, мета- и пара-. Наличие ароматического радикала уменьшает основность амина, т.к. сдвиг электронной плотности к ядру уменьшает отрицательный заряд на азоте. Ароматическое же ядро активируется под влиянием аминогруппы – ориентанта 1 рода и реакции электрофильного замещения в бензольном ядре идут легче.
Для ароматических аминов характерно поглощение в ИК-спектрах в области 3500-3300см-1 (νN-H) и 1300см-1(νС-H)
Студент должен знать:
Реакцию Зинина – способ получения анилина восстановлением нитробензола.
Цветные реакции на анилин.
Основные свойства анилина. Образование солей, ацетанилида, растворимость анилина и его солей в воде.
Реакции электрофильного замещения анилине.
Свойства дифениламина: взаимодействие его с а)серной кислотой б) азотной кислотой.
Студент должен уметь:
Проводить реакцию Зинина, а также реакции, отражающие основные свойства и ароматичность ароматических аминов.
Доказывать основность ароматических аминов.
Сравнивать основность ароматических и алифатических аминов.
Проводить цветные реакции анилина и дифениламина.
Оборудование: пробирки, пробки с газоотводными трубками, газетная бумага.
Реактивы: нитробензол, анилин, к.HCI,мет. натрий или цинк, 40%-ный формалин, 2н.H2SO4, 0,5н. NaNO2, 0,2н CuSO4, 2н. NH4OH, 0,2 н. аминоуксусная к-та, уксусный ангидрид, 2н. NaOH, этанол, 0,2%-ный раствор индикатора метилового красного, к. HNO3, 0,5н. K2Cr2O7, насыщенный раствор хлорной извести, 2н.HCI, соль анилина,раствор сернокислого дифениламина.
Опыт 1. Получение анилина восстановлением нитробензола (реакция Зинина). К маленькой капле нитробензола прибавить 3 капли к. HCI и маленький кусочек мет. Na или цинка, пробирку все время встряхивать, чтобы нитробензол все время перемешивался с выделяющимся водородом, пробирку можно немного подогреть. Когда весь кусочек цинка растворится, вы получили раствор солянокислого анилина.
![]()

Опыт 2. Цветные реакции анилина.
А. Капельку раствора соли анилина поместить на кусочек газетной бумаги (она содержит лигнин) – появляется желто-оранжевое окрашивание. Чем лучше бумага, тем слабее пятно, т.к. в ней меньше лигнина.
Б. 2 капли р-ра соли анилина поместить на предметное стекло. К одной из них добавить каплю 0,5н. K2Cr2O7 и каплю 2н. Н2SO4, к другой – 1 каплю насыщенного р-ра хлорной извести. Вследствие окисления анилина капли окрашиваются: первая – в темно-синий цвет, вторая – в темно – фиолетовый, переходящий в темно-синий.
Опыт 3. Растворимость анилина и его солей в воде. Доказательство основных свойств анилина.
К капле анилина добавить 3 капли воды, взболтать – образуется мутная эмульсия анилина в воде, анилин плохо растворяется в воде, добавить еще 3 капли воды – эмульсия не растворяется, испытать ее на лакмус – посинения нет. Разделить эмульсию пополам, к одной части добавить 1каплю 2н. HCI – анилин превращается в хорошо растворимую солянокислую соль, во вторую часть добавить 1 каплю 2н. H2SO4. При встряхивании выпадает кристаллический осадок трудно растворимой сернокислой соли анилина. Перекристаллизовать эту соль: нагреть пробирку до растворения выпавшего осадка. При быстрой кристаллизации выпадают игольчатые кристаллы, которые под микроскопом имеют вид удлиненных призм со скошенными углами. При кристаллизации из более разбавленных растворов выпадают удлиненные шестиугольные таблички.
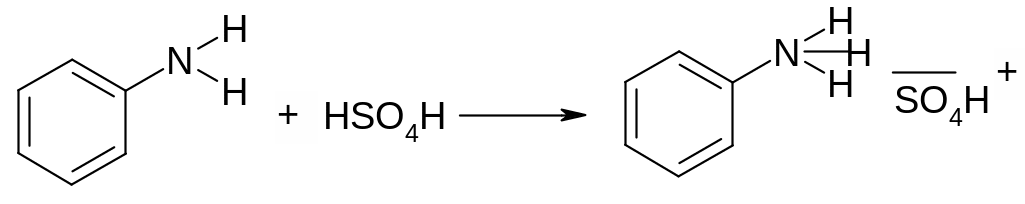
гидросульфат анилина
Опыт 4. Образование триброманилина. К 1 капле анилина прибавить 5-6 капель воды, взболтать, добавить несколько капель бромной воды до появления белого осадка 2,4,6 –триброманилина. Записать схему реакции.
Опыт 5. Образование ацетанилида. К 1 капле анилина добавить 2 капли уксусного ангидрида, раствор разогревается, нагревать пробирку полминуты и после остывания добавить10 капель воды, встряхнуть.
Наблюдения записать в тетрадь. Продукт перекристаллизовать из воды: нагреть пробирку до полного растворения продукта, затем остужать, все время встряхивая пробирку. Выделяются кристаллы в виде призматических пластинок. Ацетанилид используется для синтеза лекарственных препаратов.

анилин уксусный ангидрид ацетанилид
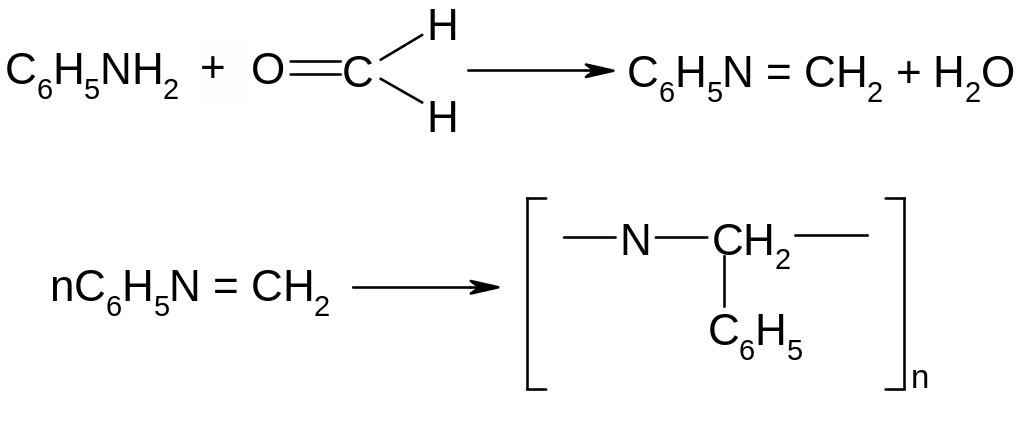
Опыт 6. Конденсация анилина с формальдегидом. К 1 капле анилина в10 каплях воды добавить несколько капель формалина – образуется белый осадок полимера.
Опыт 7. Образование и гидролиз сернокислой соли дифениламина.
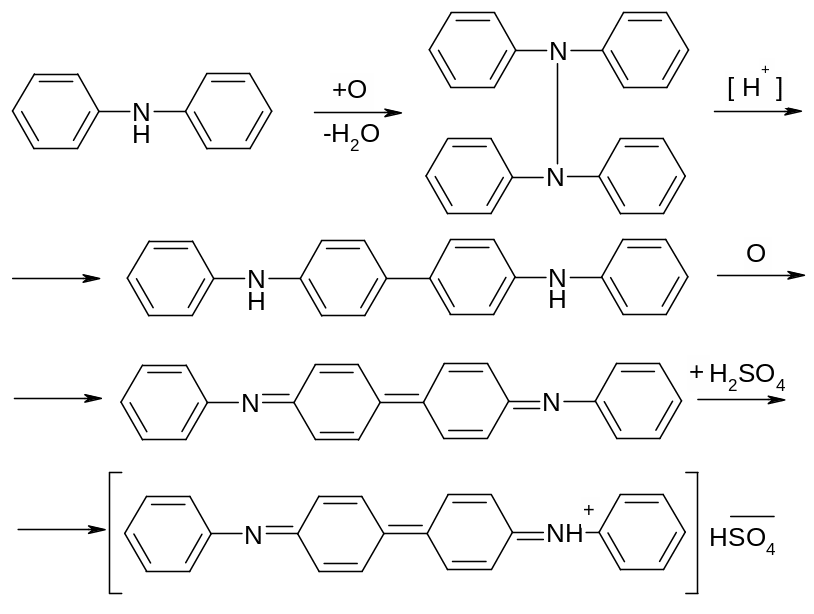
Несколько кристаллов дифениламина поместить на предметное стекло сбоку и 1 каплю к. H2SO4, размешать кристаллы до растворения (образования сернокислой соли). Каплю р-ра перенести на другую сторону предметного стекла стеклянной палочкой, разбавить каплей воды – выделяется осадок свободного дифениламина. Написать схему образования сернокислой соли дифениламина и его гидролиза. Введение второй фенильной группы еще больше ослабляет основные свойства амина.
Опыт 8. Цветная реакция дифениламина с азотной кислотой.
Одну каплю сильно разбавленной азотной кислоты нанести рядом с каплей сернокислого раствора дифениламина. В месте соприкосновения появляется интенсивное синее окрашивание – это продукты окисления дифениламина. Эта реакция очень чувствительна и используется для санитарно – химического контроля загрязнения рек сточными водами.
Контрольные вопросы, вопросы для самостоятельной работы
Какие вещества называют аминами?
Классификация аминов.
Как амины ведут себя с азотистой кислотой?
Как получить анилин по методу Зинина?
Взаимодействие аминов с соляной и серной кислотами.
Реакция бромирования анилина.
Амфотерность аминокислот.
Литература:
Л.Б.Дзараева Руководство к проведению лабораторных занятий по органической химии. Владикавказ, 2011
Э.Т.Оганесян Органическая химия.М. «Академия», 2011.
Под ред. Н.А.Тюкавкиной.Органическая химия. Основной курс.– М.: Дрофа, 2002.
Тестовые задания к работе №11.
Амины – это органические вещества, содержащие группу…
– NH 2
– NO2
– COOН
– NH2 и – COOH
Какие свойства проявляют амины?
кислотные
основные
амфотерные
Формула анилина
CH3NH2
C2H5 NO2
C2H5 NO
C6H5NH2
Укажите соответствие между классификацией амина и веществом, к которому она принадлежит.
Первичный 1) (C6H5)2 NH2
Вторичный 2) (С6Н5)3N
Третичный 3) C6H5NH
Наиболее выраженными основными свойствами в водных растворах обладает
метилпропиламин
анилин
N-метиланилин
диэтиламин
Дифениламин:
имеет специфический запах
относится ко вторичным аминам
является жидкостью при комнатной температуре
содержит атом азота с неподеленной электронной парой
реагирует с кислотами
Аминогруппа в анилине – это ориентант
первого рода (электронодонорный)
второго рода ( электроноакцепторный)
Основные свойства ароматических аминов по сравнению с алифатическими
слабее
сильнее
одинаковы по силе
Расположить следующие амины в порядке увеличения их основности:
СH3NH2
(C2H5)2NH2
C2H5NH2
C6H5NH2
Для заместителей первого рода характерны следующие свойства:
являются электронодонорами
являются электроноакцепторами
затрудняют реакции SЕ
направляет электрофил в мета-положение
направляют электрофил в орто- и пара-положения .
Ответы: 1-а; 2-б; 3-г; 4-(а-3, б-1,в-2); 5-а; 6-а-д; 7-а; 8-а; 9 - г,а,в,б; 10-а,д.
Занятие 15
