
- •1.1.Предмет органической химии в историческом аспекте.
- •1.2. Теория химического строения
- •1.4. Природа химической связи.
- •1.4.2. Ковалентная связь.
- •1.4.2. Ионная связь.
- •1.4.3. Водородная связь.
- •2.1.Образование связей с участием углерода.
- •2.2. Основные характеристики ковалентной связи.
- •2.3. Электронные эффекты строения.
- •3.1. Классификация органических соединений
- •3.2. Номенклатура органических соединений
- •3.2.1. Тривиальная номенклатура
- •3.2.2. Рациональная номенклатура
- •3.2.3. Систематическая номенклатура
- •3.2.3.1. Заместительная номенклатура июпак
- •Последовательность составления названия.
- •3.2.3.2. Радикально-функциональная номенклатура июпак
- •4.1. Понятийный аппарат в стереоизомерии.
- •4.2. Конформационная изомерия.
- •4.3. Элементы симметрии.
- •4.4. Энантиомерия или зеркальная изомерия.
- •4.5. Наблюдение оптической активности.
- •4.6. Изображение структуры стереоизомеров на плоскости.
- •4.7. Рацематы.
- •4.8. Конфигурация и знак вращения.
- •4.9. Стереоизомерия веществ с несколькими асимметричными центрами.
- •4.10. Обозначение абсолютной конфигурации молекул.
- •4.11. Причины хиральности молекулы.
- •4.12. Геометрическая изомерия (-диастереомерия).
- •5.1. Понятие о механизме реакции.
- •5.2. Реакционная способность, субстраты и реагенты.
- •5.3. Классификация органических реакций.
- •5.4. Номенклатура органических реакций.
- •5.5. Примеры механизмов реакций.
- •5.6. Селективность (избирательность) химических реакций.
2.2. Основные характеристики ковалентной связи.
Основных характеристик 5: длина связи, энергия связи, ее пространственная направленность, поляризация и поляризуемость.
Длина связи – расстояние между ядрами атомов, ее образовавшими.
Энергия связи – энергия, необходимая для гомолитического разрыва связи на радикалы или на атомы. Здесь необходимо остановиться на понятиях гомолитического и гетеролитического разрыва связи:
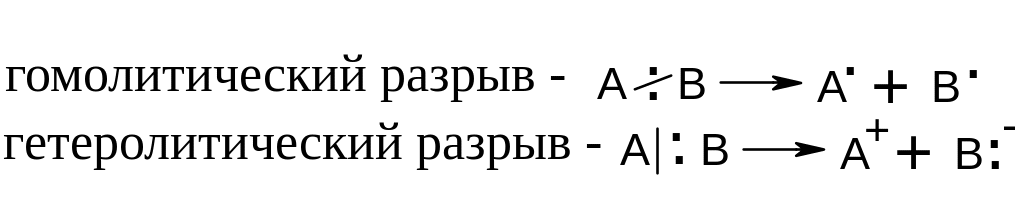
Под радикалом в органической химии понимают как часть молекулы (углеводородный остаток), с одной стороны, и как реально существующую частицу с одним неспаренным электроном (А и В), с другой.
Примеры связей и их характеристики сведены в табл. 2.2.
Табл. 2.2. Некоторые характеристики связей
Молекула |
Связь
|
Длина, нм |
Энергия Е, кДж/моль |
Степень Гибридизации |
% s-орбитали |
СН3СН3 |
|
0,154 |
331 |
sp3 |
25 |
Н2С=СН2 |
1 + 1 |
0,134 |
592 (331 + 261) |
sp2 |
33,3 |
НССН |
1 + 2 |
0,120 |
813 (592 + 221) |
sp |
50 |
СН3Н |
|
0,111 |
425 |
sp3 |
|
Длина связи зависит от многих факторов, но главным образом от типа гибридизации или кратности связи. С увеличением доли s-АО в гибридной орбитали (с увеличением ненасыщенности) длина связи уменьшается, ибо s-орбиталь лежит ближе к ядру (имеет меньший радиус), чем р-орбиталь.
Энергия двойной связи не равна удвоенному значению одинарной -связи. Энергия -связи в этилене (за вычетом энергии -связи) составляет 261 кДж/моль, т.е. на 70 кДж/моль меньше, чем -связи (на 20%). Это свидетельствует, что боковое перекрывание АО при образовании -связи менее эффективно, чем осевое при образовании -связи.
То обстоятельство, что -связь слабее -связи, заставляет сделать вывод, что для ненасыщенных соединений должны быть характерны, т.е. идти в первую очередь, реакции присоединения по кратным связям, ибо на их разрыв идет меньше энергии и они, кроме того, более доступны с пространственной точки зрения.
Энергия связи зависит также от природы элемента, атомы которого образуют связь. Так, связи СHal составляют следующий ряд прочности:
CF CCl CBr CІ .
Прочность связи в этом ряду уменьшается с увеличением порядкового номера элемента, ибо при этом растет радиус атома и длина связи (с увеличением расстояния электростатическое взаимодействие уменьшается).
В соединениях углерода с элементами ІІ периода прочность (энергия) связи возрастает в ряду: СN CO CF , т.е. с увеличением электроотрицательности элемента, радиус которого при этом уменьшается (элктростатическое взаимодействие усиливается).
Пространственная направленность связей уже рассмотрена на примере метана, этана, этилена и ацетилена.
Полярность связи и ее поляризуемость. С полярной связью мы уже встречались, рассматривая ковалентный характер связи. При образовании ковалентной связи между двумя одинаковыми атомами ее электронное облако симметрично расположено между ядрами связываемых атомов, связь неполярна, и молекула неполярна (этан, этилен, ацетилен).
Если ковалентную связь образуют различные атомы с различной электроотрицательностью, то возникает полярная ковалентная связь, поскольку электроны связи сдвинуты к электроотрицательному атому , а на атомах возникают эффективные частичные заряды, например, в Н3С F. Эта полярность постоянна (стационарна), ибо обусловлена внутренними факторами, а именно – природой взаимодействующих атомов и характером связи между ними.
Различную электроотрицательность имеют атомы одного и того же элемента, если эти атомы находятся в различном состоянии гибридизации. Так, для углерода:
Степень гибридизации sp3 sp2 sp
Электроотрицательность 2,5 2,75 3,2.
Таким образом, электроотрицательность атома возрастает с увеличением доли s-орбитали в гибридной орбитали.
Появление полярной связи в молекуле обуславливает возникновение полярности всей молекулы, а это влияет на свойства вещества. Так, полярные вещества, в отличие от неполярных, лучше растворяются в полярных растворителях, обычно имеют более высокие температуры кипения и плавления, легче реагируют по ионным механизмам.
Помимо стационарной различают еще и динамическую поляризацию. Динамическую поляризацию называют поляризуемостью. Это способность смещать электроны под воздействием внешних факторов: внешнего электрического поля и электрических полей, создаваемых реагентами, растворителем и катализаторами. Поляризуемости легче всего подвергаются подвижные электроны, т.е. электроны -связей и элементов с большим атомным радиусом. Полярность связи и ее поляризуемость связаны между собой определенным образом: чем полярнее связь, тем меньше она способна к поляризуемости.
Поляризуемость -связей больше чем -связей, влияние ее на протекание химических реакций больше, чем полярности. В целом, на реакционную способность соединений большее влияние оказывает динамическая поляризация, а не статическая.
