
- •12.2. Галогенпроизводные углеводородов.
- •12.3. Нуклеофильное замещение.
- •12.4. Побочные реакции при sn1-замещении.
- •12.5. Реакции отщепления.
- •13.1. Введение.
- •14.1. Гликоли.
- •1 4.2. Двухатомные фенолы.
- •14.3. Трехатомные спирты. Глицерин.
- •14.4. Простые эфиры.
- •14.5. Строение и номенклатура оксосоединений.
- •14.6. Методы синтеза оксосоединений.
- •14.7. Строение карбонильной группы.
- •14.8. Химические свойства оксосоединений.
- •15.1. Реакции окисления.
- •15.2. Реакции замещения водорода в -положении по отношению к
- •15.3. Реакции конденсации.
- •15.4. Реакции замещения кислорода на галогены.
- •1 5.5. Реакции восстановления.
- •15.6. Реакции полимеризации.
- •15.7. Дикарбонильные соединения.
- •16.1 Введение.
- •16.2. Монокарбоновые насыщенные кислоты.
- •16.3. Ассоциация карбоновых кислот.
- •16.3. Строение карбоксильной группы.
- •16.4. Химические свойства.
- •16.5. Ненасыщенные карбоновые кислоты.
- •17.1. Классификация, номенклатура, изомерия.
- •17.2. Методы синтеза.
- •17.3. Химические свойства.
- •18.1. Нитросоединения.
- •18.2. Амины.
- •19.1. Свойства ароматических аминов.
- •19.2. Диамины.
- •19.3. Ароматические диазосоединения.
- •19.4. Алифатические диазосоединения.
- •20.1.Введение.
- •20.2. Производные непереходных элементов.
- •20.3. Эос переходных элементов.
- •20.4. Общие методы синтеза.
- •20.5. Серусодержашие соединения.
- •20.6. Фосфорорганические соединения.
Часть ІІІ. МОНО- И ГОМОПОЛИФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Лекция № 12. ГАЛОГЕНПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
12.1. Введение.
Производные углеводородов можно классифицировать следующим
о бразом:
бразом:
В ІІІ-ю часть курса вошли производные углеводородов, содержащих одну (монофункциональные) или несколько одинаковых групп (гомофункциональные).
12.2. Галогенпроизводные углеводородов.
Очень большое значение в органической химии имеют галогенпроизводные углеводородов, которые вследствие своей высокой реакционной способности используют как исходные реагенты для синтеза многих других классов органических соединений. По сути дела галогенпроизводные являются промежуточным звеном в генетической связи между классами органических соединений, где первым звеном стоят сами углеводороды, вторым чаще всего их галогенпроизводные, которые превращаются в другие классы.
За неимением времени не будем рассматривать ни методы получения, ни свойства галогенпроизводных. Методы получения уже неоднократно встречались, а из множества свойств выбираем два наиболее важных типа реакций – нуклеофильное замещение и отщепление и рассматриваем их механизмы.
12.3. Нуклеофильное замещение.
Вы уже имеете представление об SN1 и SN2 реакциях (см. раздел 6., здесь мы остановимся на двух моментах – влияние структуры реагентов на механизм и скорость, а также стереоспецифичность этих реакций.
12.3.1.Влияние структуры реагентов.
По своей реакционной способности в нуклеофильных реакциях галогенпроизводные располагаются в ряд:
RF RCl RBr RI .
Причина – уменьшение прочности связи СHal (и увеличение ее поляризуемости).
Скорость нуклеофильного замещения зависит от структуры радикала R, что можно продемонстрировать при помощи графика:
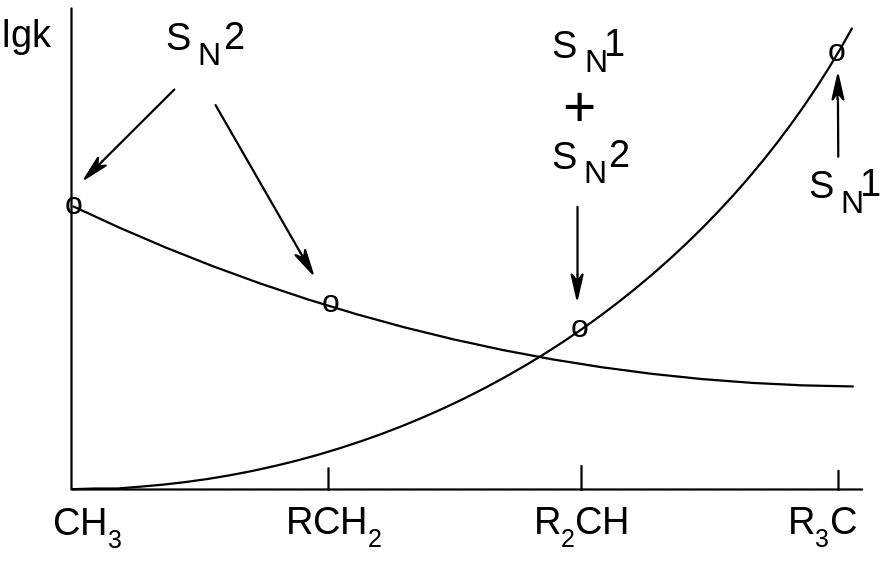
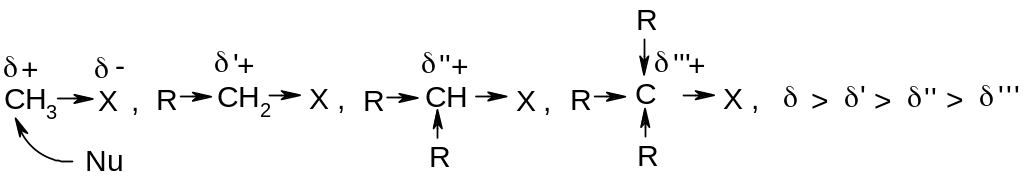 В
реакциях СН3Х
и RCH2X,
как отмечалось выше, карбокатионы не
могут образовываться, ибо они очень
нестабильны, т.е. возможен только SN2
механизм. При этом скорость реакции
уменьшаются при переходе от СН3
к первичным и вторичным радикалам
вследствие их + І-эффектов, уменьшающих
+
заряд на реакционном центре:
В
реакциях СН3Х
и RCH2X,
как отмечалось выше, карбокатионы не
могут образовываться, ибо они очень
нестабильны, т.е. возможен только SN2
механизм. При этом скорость реакции
уменьшаются при переходе от СН3
к первичным и вторичным радикалам
вследствие их + І-эффектов, уменьшающих
+
заряд на реакционном центре:
Тем самым понижается скорость реакции с нуклеофилом Nu. Кроме того, атаке препятствует и стерическое отталкивание радикалов R, поэтому SN2 механизм для третичных производных невозможен, здесь протекают только SN1 реакции по двум причинам:
образуется стабилизированный за счет гиперконьюгации карбокатион R3C+,
отсутствуют стерические препятствия атаке Nu на этот карбокатион, имеющий плоскую структуру вследствие sp2-гибридного состояния атома углерода.
12.3.2. Стереохимия реакций замещения.
12.3.2.1. Стереохимия реакций SN1-замещения.
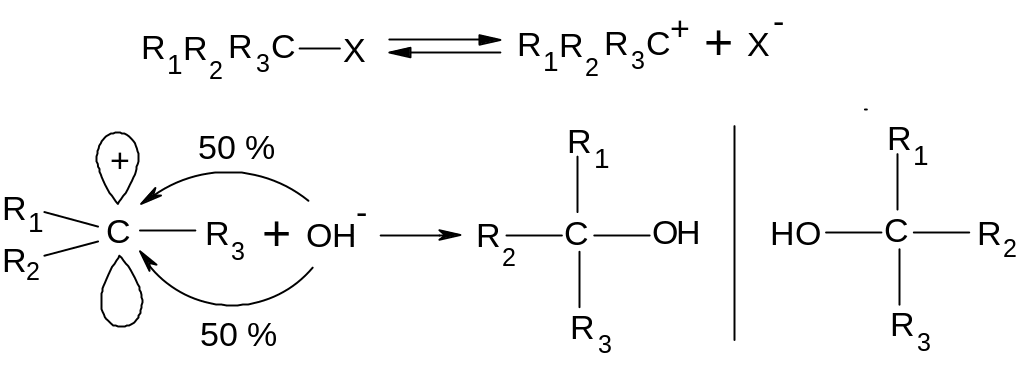 Скорость
реакции определяется самой медленной
первой стадией, поэтому W = k [RX]. Cтереохимия
реакции:
Скорость
реакции определяется самой медленной
первой стадией, поэтому W = k [RX]. Cтереохимия
реакции:
рацемат
Образуется оптически неактивная эквимолекулярная рацемическая смесь энантиомеров (оптических антиподов).
Таким образом, при SN1-замещении всегда образуется оптически неактивный рацемический продукт реакции.
12.3.2.2. Стереохимия реакций SN2-замещения.
Процесс одностадийный, а скорость реакции определяется уравнением W = k [RX][Nu]. Пример:
З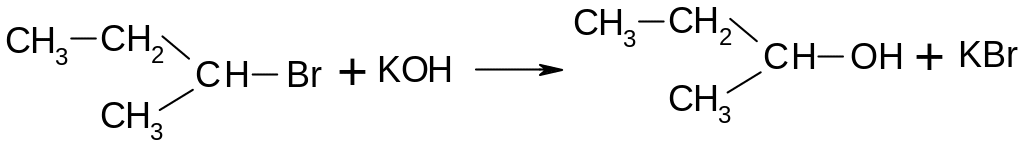 десь
имеет место тыловая атака (Вальденовское
обращение конфигурации):
десь
имеет место тыловая атака (Вальденовское
обращение конфигурации):
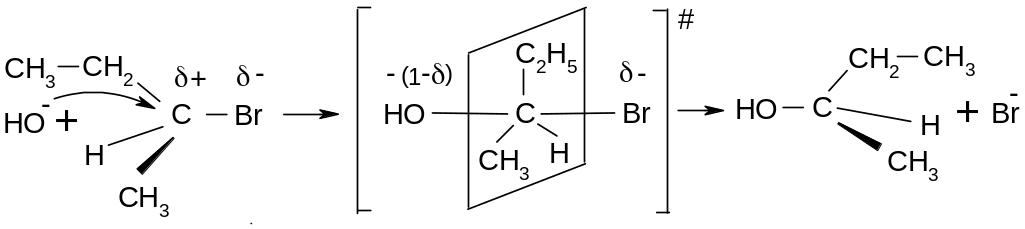 S-конфигурация
R-конфигурация
S-конфигурация
R-конфигурация
12.3.2.3. Стереохимия SN1-замещения с участием ионных пар.
![]() В
ряде малополярных растворителей
образование свободных ионов затруднено,
поэтому диссоциация RX останавливается
на образовании ионных пар – контактных
(КИП) и сольватно-разделенных (СРИП):
В
ряде малополярных растворителей
образование свободных ионов затруднено,
поэтому диссоциация RX останавливается
на образовании ионных пар – контактных
(КИП) и сольватно-разделенных (СРИП):
А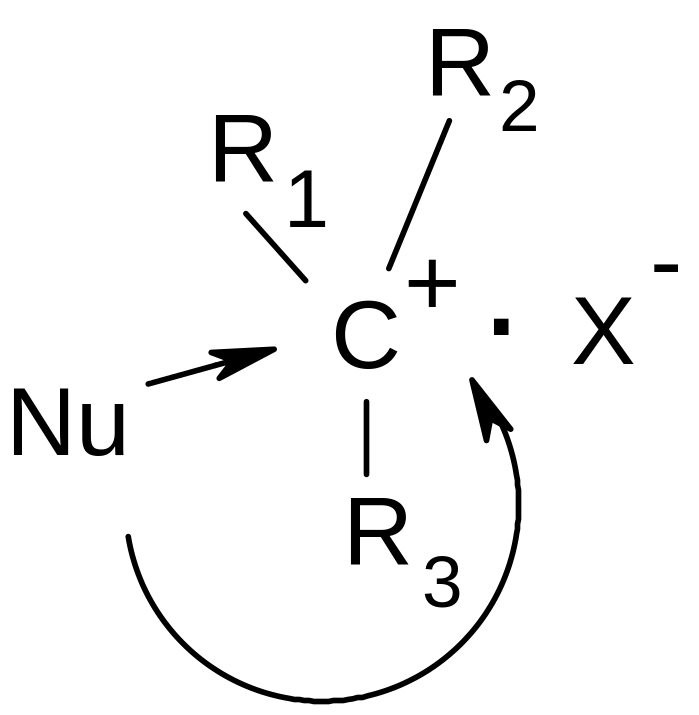 нион
в ионной паре частично мешает атаке
нуклеофила на катион с той стороны, с
которой он находится:
нион
в ионной паре частично мешает атаке
нуклеофила на катион с той стороны, с
которой он находится:
Поэтому идет частичная рацемизация наряду с частичным Вальденовским обращением.
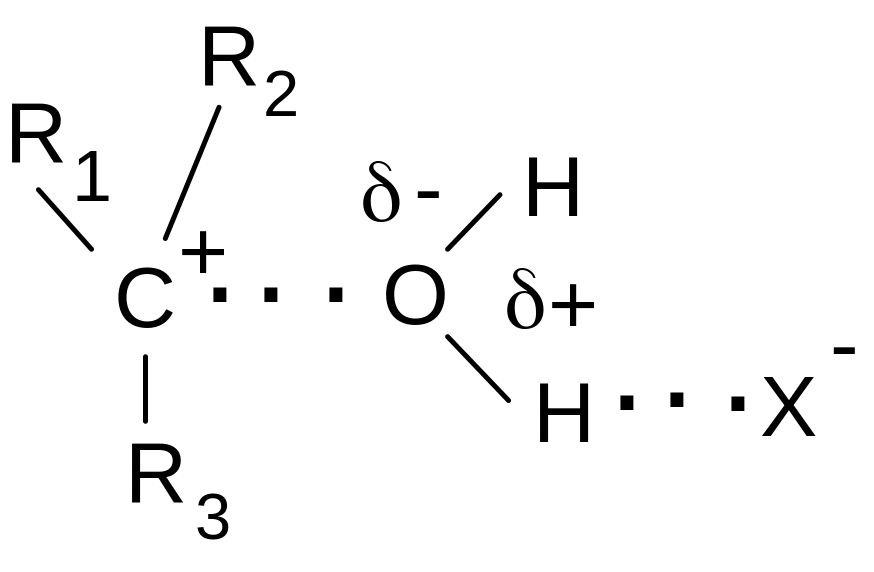 В
ряде случаев растворитель, например
Н2О,
проникает между ионами и образует СРИП:
В
ряде случаев растворитель, например
Н2О,
проникает между ионами и образует СРИП:
Если же эта молекула воды (или другого растворителя, например, спирта) выступает в качестве нуклеофильного реагента, то имеет место сохранение конфигурации.
