
- •Часть 5. Гетероциклы.
- •28.1. Ведение
- •28.2. Пятичленные гетероциклы с одни гетероатомом.
- •28.2.1. Методы получения.
- •28.3. Химические свойства
- •29.1. Конденсированные гетероциклы с одним гетероатомом.
- •29.2. Пятичленные гетероциклы с несколькими гетероатомами.
- •30.1. Пиридин и его алкильные производные
- •30.2. Хинолин и изохинолин.
- •31.1. Одноядерные шестичленные гетероциклы с двумя гетероатомами.
- •31.2. Конденсированные азотсодержащие гетероциклы с несколькими атомами азота.
- •31.3. Алкалоиды пурина.
- •31.4. Нуклеиновые кислоты (нк).
ЛЕКЦИИ КУРСА "Органическая химия"
для студентов химического факультета специальности "Биохимия"
Часть 5. Гетероциклы.
Лекции № 28 - 29. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ.
28.1. Ведение
Гетероциклические соединения – это такие соединения, в молекулах которых один или несколько атомов из цикла являются гетероатомами, в основном это О, N и S. Они принадлежат к одним из наиболее распространенных природных соединений (алкалоиды, пигменты, витамины, нуклеиновые кислоты и др.).
Условно гетероциклы подразделяют на насыщенные, ненасыщенные и ароматические. Их еще классифицируют по размерам циклов и по природе гетероатома. Не имея времени останавливаться на классификации всех циклов и на их номенклатуре, остановимся только на тех, которые имеют значение в природе, т.е. на 5-ти и 6-ти членных ароматических гетероциклах. С насыщенными гетероциклами студенты уже сталкивались, например, с лактонами, лактамами и др.
28.2. Пятичленные гетероциклы с одни гетероатомом.
 Строение гетероцикла можно показать
на примере фурана:
Строение гетероцикла можно показать
на примере фурана:
На формуле указан порядок нумерации атомов цикла, причем, положения 2 и 5 эквивалентны и обозначаются как - положения, эквивалентными являются также положения 3 и 4, которые в свою очередь обозначаются как - положения.
Всего таких гетероциклов три (показаны формулы в упрощенном варианте):
 фуран пиррол
тиофен
фуран пиррол
тиофен
Их структура удовлетворяет всем требованиям ароматичности: плоские, циклически замкнутые с цепочкой сопряженных связей структуры, содержащие в соответствии с правилом Хюккеля 6 -электронов (на формулах внутри цикла). Свойства у них ароматические – характерны реакции электрофильного замещения. С другой стороны фуран не имеет свойств простого эфира, пиррол – свойств амина, а тиофен – свойств сульфида.
По энергии стабилизации и свойствам гетероциклы по сравнению с бензолом располагаются в ряд в порядке уменьшения их ароматичности:
Э нергия
стабилизации в кДж/моль; 152 120
119 92
нергия
стабилизации в кДж/моль; 152 120
119 92
Электроотрицательность атомов С(2,5) S(2,5) N(3,0) О(3,5)
Как видим, ароматичность уменьшается с увеличением электроотрицательности гетероатомов. Оттягивая электроны от ароматической системы, гетероатом тем самым уменьшает ее ароматичность.
28.2.1. Методы получения.
 28.2.1.
Декарбоксилирование природных продуктов:
28.2.1.
Декарбоксилирование природных продуктов:
фурфурол пирослизевая к-та
 28.2.2.
Реакции ацетилена :
28.2.2.
Реакции ацетилена :
 28.2.3.
Взаимное превращение по Юрьеву (450оС,
Al2O3):
28.2.3.
Взаимное превращение по Юрьеву (450оС,
Al2O3):
28.2.4. Циклизация 1,4-дикарбонильных соединений.
 При
взаимодействии 1,4-дикарбонильных
соединений (диальдегидов или дикетонов)
с аммиаком при нагревании образуется
пиррол или его производные:
При
взаимодействии 1,4-дикарбонильных
соединений (диальдегидов или дикетонов)
с аммиаком при нагревании образуется
пиррол или его производные:
Аналогично из того же диальдегида под действием Р2О5 или P2S5 получают фуран или тиофен.
28.3. Химические свойства
28.3.1. Ацидофобные свойства фурана и пиррола.
 Как
наименее ароматичные соединения, фуран
и пиррол в кислой среде неустойчивы
вследствие присоединения протона к
-положению и потери
ароматических свойств:
Как
наименее ароматичные соединения, фуран
и пиррол в кислой среде неустойчивы
вследствие присоединения протона к
-положению и потери
ароматических свойств:
В этих условиях они ведут себя как диены, полимеризуясь в смолы.
28.3.2. Свойства тиофена.
 Тиофен,
как наиболее близкий по ароматичности
к бензолу, похож на бензол своими
свойствами, т.е. вступает в реакции
электрофильного замещения, причем, в
этих реакциях он активнее бензола, так
же как и фуран и пиррол, вследствие
сопряжения и появления отрицательного
заряда на атомах углерода:
Тиофен,
как наиболее близкий по ароматичности
к бензолу, похож на бензол своими
свойствами, т.е. вступает в реакции
электрофильного замещения, причем, в
этих реакциях он активнее бензола, так
же как и фуран и пиррол, вследствие
сопряжения и появления отрицательного
заряда на атомах углерода:
 Тиофен
бромируется Br2 даже
без электрофильного катализатора,
нитруется раствором HNO3
в уксусном ангидриде (без воды),
сульфируется безводной серной кислотой,
алкилируется и ацилируется алкил- и
ацилгалогенидами (в присутствии
электрофильных катализаторов типа
AlCl3), конденсируется
с формальдегидом в присутствии НСl.
При этом эти реакции идут в -положение:
Тиофен
бромируется Br2 даже
без электрофильного катализатора,
нитруется раствором HNO3
в уксусном ангидриде (без воды),
сульфируется безводной серной кислотой,
алкилируется и ацилируется алкил- и
ацилгалогенидами (в присутствии
электрофильных катализаторов типа
AlCl3), конденсируется
с формальдегидом в присутствии НСl.
При этом эти реакции идут в -положение:
М еханизм
этих реакций SE
:
еханизм
этих реакций SE
:
-замещение
-замещение
Замещение идет в -положение, поскольку образующийся в этом случае -комплекс стабильнее (описывается тремя резонансными структурами), чем соответствующий -комплекс, образующийся при замещении в -положение (описывается двумя резонансными структурами).
Реакции присоединения идут с трудом, например, гидрирование:

Тиофен стоек к окислению, не окисляется даже марганцевокислым калием при нагревании, но гидрированный тиофен (тифан) легко окисляется до сульфоксида и сульфона:
 тиофан- тиофансульфодиоксид,
тиофан- тиофансульфодиоксид,
сульфоксид сульфон (или сульфолан)
28.3.3. Свойства фурана.
 Для
фурана также характерны реакции SE,
но при этом, поскольку он наименее
ароматичен, то его бромирование и
нитрование идут через присоединение –
отщепление. Также вследствие ацидофильности
его нельзя нитровать азотной кислотой
и сульфировать серной кислотой. Нитрование
проводят ацетилнитратом СН3СООNO2
(смешанный ангидрид уксусной и азотной
кислот), а сульфирование можно проводить
SO3 с пиридином или
диоксаном:
Для
фурана также характерны реакции SE,
но при этом, поскольку он наименее
ароматичен, то его бромирование и
нитрование идут через присоединение –
отщепление. Также вследствие ацидофильности
его нельзя нитровать азотной кислотой
и сульфировать серной кислотой. Нитрование
проводят ацетилнитратом СН3СООNO2
(смешанный ангидрид уксусной и азотной
кислот), а сульфирование можно проводить
SO3 с пиридином или
диоксаном:
Примеры реакций:

 Фуран
легче гидрируется, чем тиофен:
Фуран
легче гидрируется, чем тиофен:
тетрагидрофуран
Вследствие невысокой ароматичности фуран проявляет свойства сопряженного диена и реагирует с диенофилами типа малеинового ангидрида (реакция диенового синтеза Дильса – Альдера):

28.3.. Свойства пиррола.
 По
своим кислотным свойствам пиррол
напоминает фенол, т.е. ведет себя как
слабая кислота, причина – сопряжение:
По
своим кислотным свойствам пиррол
напоминает фенол, т.е. ведет себя как
слабая кислота, причина – сопряжение:
Сопряжение электронной пары азота с соседними непредельными связями вызывает появление на атоме азота положительного заряда, что и обеспечивает кислотный характер пиррольного водорода.

 Пиррол
может реагировать со щелочными металлами,
сухим КОН, алкоксидами металлов, реактивом
Гриньяра. Примеры реакций:
Пиррол
может реагировать со щелочными металлами,
сухим КОН, алкоксидами металлов, реактивом
Гриньяра. Примеры реакций:
N-метилпиррол -метилпиррол
 N-ацетил-
-ацетилпиррол
N-ацетил-
-ацетилпиррол
пиррол (метил--пиррилкетон)
Реакции электрофильного замещения с участием пиррола аналогичны тем, в которые вступает фуран.
 В
реакции присоединения пиррол вступает
труднее фурана:
В
реакции присоединения пиррол вступает
труднее фурана:
пирролидин (тетрагидропиррол)
Из производных пирролидинов важное значение имеет пирролидон (лактам -аминомасляной кислоты) и N-винилпирролидон. Пирролидон синтезируют неполным восстановлеием сукцинимида (имида янтарной кислоты):

 Пирролидон полимеризуется, в результате
чего образуется синтетическое волокно
найлон-4:
Пирролидон полимеризуется, в результате
чего образуется синтетическое волокно
найлон-4:
Щелочь является инициатором полимеризации:

N-Винилпирролидон получают взаимодействием ацетилена с пирролидоном:
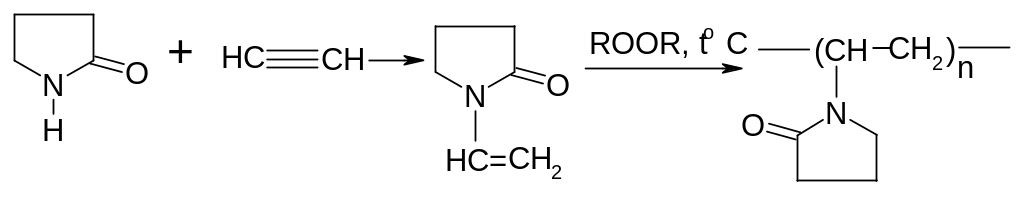 Поливинилпирролидон
Поливинилпирролидон
Получаемый таким способом полимер используют как клей, а также в качестве заменителя плазмы крови.
При нагревании -пирролкарбоальдегида с муравьиной кислотой происходит конденсация с частичным восстановлением:
 порфин
порфин
Порфин – небензоидное ароматическое соединение, содержащее 26
-электронов (n = 6, N = 4n + 2 = 26), т.е. 11 двойных связей + 4 р-электрона двух атомов N.
 Переносчик
кислорода в крови – гемоглобин (и
красящее вещество крови) состоит из
белка глобина и гема, который в свою
очередь является комплексным соединением
Fe2+ c
cоответствующим порфирином,
т.е. производным порфина:
Переносчик
кислорода в крови – гемоглобин (и
красящее вещество крови) состоит из
белка глобина и гема, который в свою
очередь является комплексным соединением
Fe2+ c
cоответствующим порфирином,
т.е. производным порфина:
Пигмент листьев и катализатор ассимиляции углекислого газа хлорофилл имеет немного отличающеееся от гема строение с несколько другими боковыми заместителями в порфиновом ядре, которое связано с Mg2+ (вместо Fe2+).
