
- •Часть 5. Гетероциклы.
- •28.1. Ведение
- •28.2. Пятичленные гетероциклы с одни гетероатомом.
- •28.2.1. Методы получения.
- •28.3. Химические свойства
- •29.1. Конденсированные гетероциклы с одним гетероатомом.
- •29.2. Пятичленные гетероциклы с несколькими гетероатомами.
- •30.1. Пиридин и его алкильные производные
- •30.2. Хинолин и изохинолин.
- •31.1. Одноядерные шестичленные гетероциклы с двумя гетероатомами.
- •31.2. Конденсированные азотсодержащие гетероциклы с несколькими атомами азота.
- •31.3. Алкалоиды пурина.
- •31.4. Нуклеиновые кислоты (нк).
30.1. Пиридин и его алкильные производные
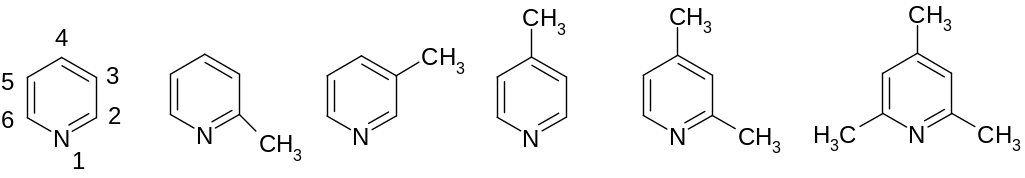 30.1.1.Строение
и номенклатура.
30.1.1.Строение
и номенклатура.
Пиридин -пиколин -пиколин -пиколин 2,4-лутидин 2,4,6-коллидин
(2-метилпи- (3-метилпи- (4-метил- (2,4-диметил- (2,4,6-триме-
ридин) ридин) пиридин) пиридин тилпиридин)
Нумерация атомов в кольце показана на примере пиридина, кроме того, положения можно обозначать греческими буквами: 2 - , 3 - , 4 - .
Пиридин своим строением напоминает бензол, но при этом -электроны кольца стянуты к электроотрицательному атому азота, а на атомах углерода находится определенный положительный заряд, о чем свидетельствуют резонансные структуры:
П ри
этом положительный заряд в ,
и -положениях
уменьшается в ряду:
ри
этом положительный заряд в ,
и -положениях
уменьшается в ряду:
+ + +. Молекула пиридина более полярна, чем молекула пиперидина (гексагидропиридина). Энергия резонанса не намного меньше, чем для бензола. Все атомы пиридинового кольца (пять углеродов и один азот) находятся в sp2-гибридном состоянии. Три гибридных орбитали каждого атома углерода используются на образование трех -связей (две с соседними атомами цикла и одна с атомом водорода), две гибридных орбитали азота используются на образование двух -связей с соседними углеродами, тогда как третья, лежащая в плоскости кольца и не сопряженная с ним, занята парой свободных электронов, обеспечивающих основные свойства пиридина.
Пиридин – ароматическая система, удовлетворяющая правилу Хюккеля (6 -электронов, но электрофильное замещение идет с трудом (кольцо дезактивировано) и только в -положение, где электронная плотность наибольшая. Но зато для пиридина реакции нуклеофильного замещения идут легче, чем в бензоле.
30.1.2. Методы получения.
30.1.2.1. Получение из каменноугольной смолы.
Каменноугольную смолу обрабатывают раствором кислоты, например, серной, из раствора выделяют свободные основания и разделяют (обычно разгонкой). Содержание пиридина в смоле 0,1%, этого мало для промышленности, поэтому недостающее количество синтезируют.
30.1.2.2. Конденсация ацетилена с синильной килотой.
Реакцию проводят в раскаленных до 450 оС металлических трубках:
 2 НССН + НСN
C5H5N
2 НССН + НСN
C5H5N
Этот метод не стал промышленным вследствие низкого выхода и ядовитости синильной кислоты.
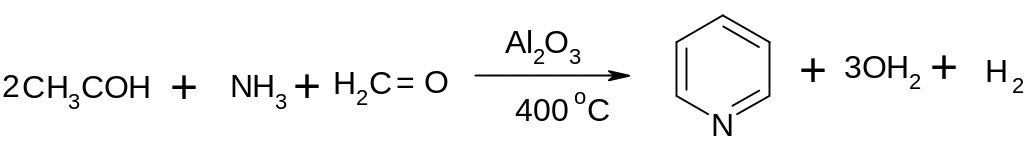 30.1.2.3.
Конденсация альдегидов с аммиаком:
30.1.2.3.
Конденсация альдегидов с аммиаком:
30.1.3. Физические и химические свойства.
Эти соединения - жидкости с неприятным запахом, очень вредны для здоровья.
30.1.3.1. Основность.
Пиридин (рКВН =5,25) чуть более основен, чем анилин (рКВН =4,6), но менее основен чем аммиак (рКВН =9,25) и первичные амины (10,6). Он более основен, чем анилин, потому что его свободная электронная пара на азоте не сопрягается с кольцом, менее основен чем аммиак и амины, поскольку азот находится в sp2-гибридном состоянии, а sp2-электроны (доля s-орбитали составляет 33%) сильнее притянуты к ядру азота, чем в аминах (азот в sp3-гибридном состоянии, доля s-орбитали составляет 25%). Реакции:
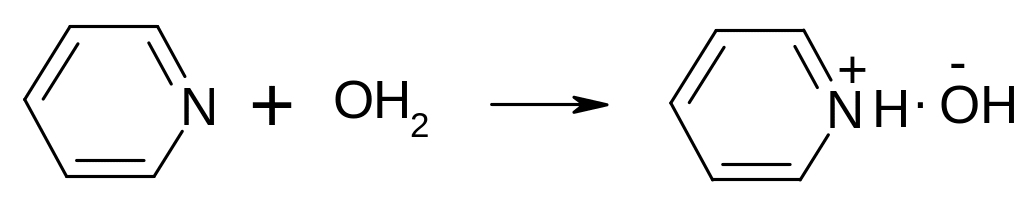
 Пиридиний хлорид
Пиридиний хлорид
Пиридиний гидроксид
30.1.3.2. Реакции электрофильного замещения.
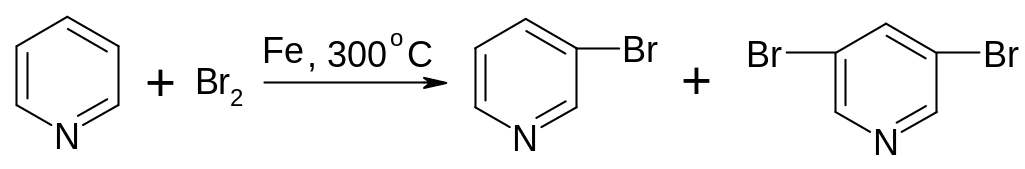 Резонансные
структуры показывают, что наибольшая
электронная плотность находится в
-положении, поэтому
SE-замещение
идет только в -положение
и в очень жестких условиях:
Резонансные
структуры показывают, что наибольшая
электронная плотность находится в
-положении, поэтому
SE-замещение
идет только в -положение
и в очень жестких условиях:
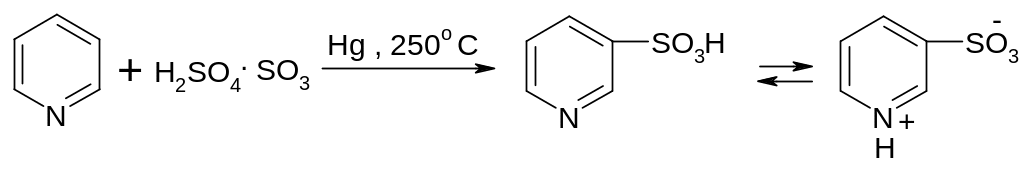 3-бромпиридин 3,5-дибромпиридин
3-бромпиридин 3,5-дибромпиридин
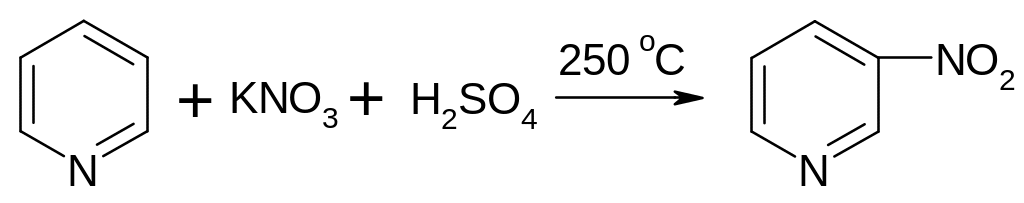 -пиридинсульфоновая
кислота
-пиридинсульфоновая
кислота
3-нитропиридин
30.1.3.3. Реакции электрофилов по азоту.
Электрофилы типа галогеналканов с кольцом пиридина не взаимодействуют, но они реагируют с азотом:
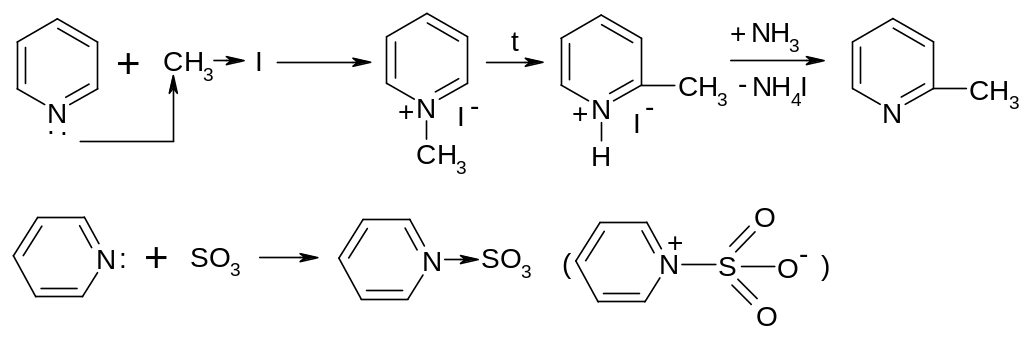 пиридинсульфотриоксид
пиридинсульфотриоксид
Это мягкий сульфирующий реагент для ацидофобных гетероциклов.
 При
окислении пиридина перекисью водорода
образуется N-пиридиноксид:
При
окислении пиридина перекисью водорода
образуется N-пиридиноксид:
Для пиридиноксида имеет место сопряжение отрицательно заряженного кислорода с кольцом, что активирует само кольцо, увеличивая электронную плотность на нем:
П оэтому
относительно легко идут (по сравнению
с самим пиридином) реакции электрофильного
замещения, например, при нитровании
концентрированной НNО3:
оэтому
относительно легко идут (по сравнению
с самим пиридином) реакции электрофильного
замещения, например, при нитровании
концентрированной НNО3:
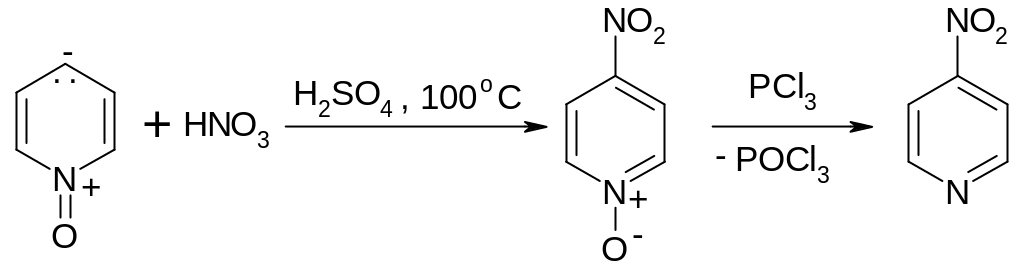 4-нитро-N-
4-нитропиридин
4-нитро-N-
4-нитропиридин
пиридиноксид
30.1.3.4. Реакции нуклеофильного замещения.
Нуклеофильное замещение идет в - и -положения (если оба -положения заняты), например:
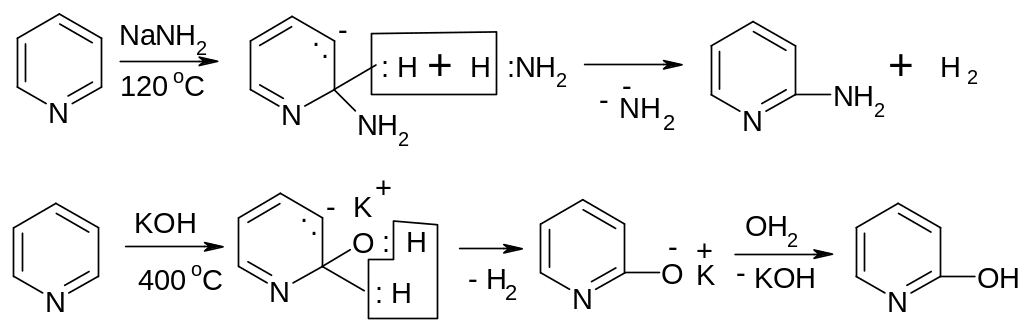
2-гидроксипиридин
2-Гидроксипиридин вследствие таутомерного равновесия превращается в
п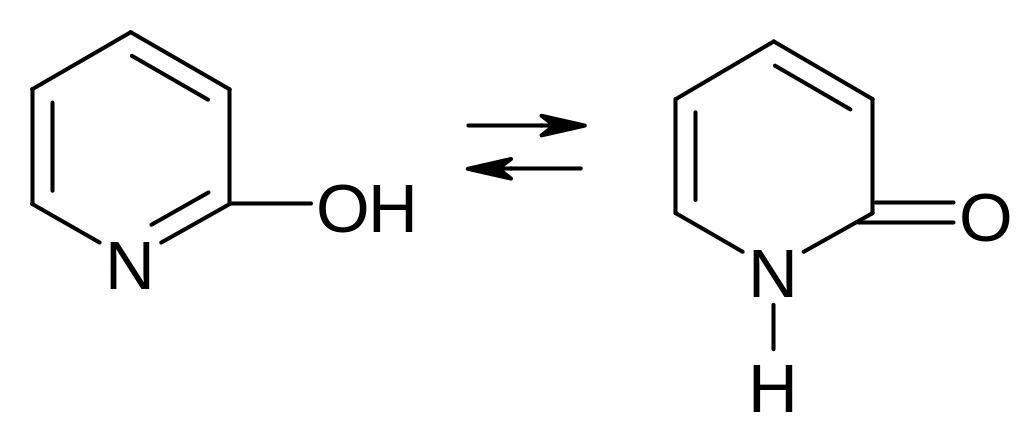 иридон
2:
иридон
2:
30.1.3.5. Восстановление.
Пиридин, обладая дефицитом электронов, способен присоединять свободные атомы водорода (образующегося в момент выделения и отдающего электрон), т.е. легче, чем бензол:
 1,4-дигид-
1,2,3,4-тетра- пиперидин
1,4-дигид-
1,2,3,4-тетра- пиперидин
ропиридин гидропиридин (гексагидропиридин) Пиперидин имеет основность диалкиламина и входит в состав некоторых природных алкалоидов.
30.1.3.6. Окисление.
Пиридин, подобно бензолу, стоек к окислению (с КMnO4 не реагирует). Но алкильные производные пиридина окисляются перманганатом в нейтральной среде при нагревании легче, чем толуол:
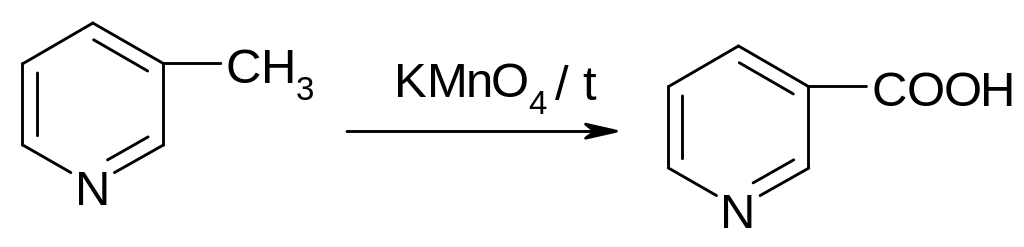 -пиколин
никотиновая (3-пиридинкарбоновая)
кислота
-пиколин
никотиновая (3-пиридинкарбоновая)
кислота
30.1.3.7. Реакции конденсации метилпиридинов.
- и - пиколины способны вступать в реакции конденсации в качестве метиленовых компонентов:
 2-винилпиридин
2-винилпиридин
(мономер для поли-
меризации)
30.1.4. Производные пиридина.
30.1.4.1. Пиридинкарбоновые кислоты
П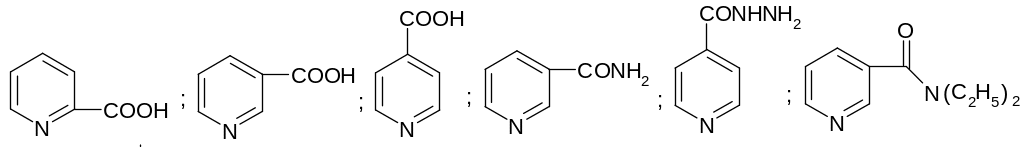 иридинкарбоновые
кислоты и их производные – биологически
активные соединения широкого спектра
действия на человека:
иридинкарбоновые
кислоты и их производные – биологически
активные соединения широкого спектра
действия на человека:
Пиколиновая Никотино- изонико- никотин- изониазид, кардиамин,
(2-пиридинкар- вая к-та тиновая амид, ви- гидразид N,N-диэтил-
боновая) к-та к-та тамин РР изоникоти- никотинамид
новой к-ты
Следует отметить, что изониазид – лекарство от туберкулеза, а кардиамин – стимулятор центральной нервной системы.

30.1.4.1. Алкалоиды.
Никотин (алкалоид табака) анабазин, -(-пиперидил)пиридин (из
3-[2-(N-метилпирролидил)пиридин ежевника безлистого из Средней Азии)
Оба вещества очень ядовиты, но используются как инсектициды в сельском хозяйстве и как сырье для получения никотиновой кислоты.
