
- •Часть 4. Гетерофункциональные соединения.
- •21.1. Строение и номенклатура.
- •21.2. Методы получения.
- •21.3. Физические и химические свойства гидроксикислот.
- •21.4. Стереоизомерия гидроксикислот.
- •21.5. Стереохимия реакций замещения и присоединения с участием
- •В случае фумаровой кислоты атака с разных сторон (50 на 50%) приводит к образованию рацемата:
- •2 1.6. Разделение рацематов.
- •22.1. Строение и номенклатура.
- •22.2. Методы получения.
- •22.3. Химические свойства.
- •23.1. Строение и номенклатура.
- •Методы получения.
- •23. 3. Свойства аминокислот.
- •24.1. Понятие о полипептидах и белках.
- •24.2. Классификация белков.
- •24.3. Структура белков.
- •Р исунок 24.1
- •24.4. Установление первичной структуры белков.
- •24.5. Синтез белков химическими методами.
- •25.1. Введение.
- •25.2. Моносахариды.
- •26.1. Химические свойства моносахаридов.
- •26.2. Брожение моносахаридов.
- •27.1. Олигосахариды или сахароподобные вещества.
- •27.2. Несахароподобные полисахариды.
- •С хема 27.2. Формула амилозы:
Часть 4. Гетерофункциональные соединения.
Лекции № 21. (испр. 1.08.2012)
ГИДРОКСИКИСЛОТЫ.
21.1. Строение и номенклатура.
Гидроксикислоты одновременно содержат две разных функции – карбоксильную (кислотную) и спиртовую. Их классифицируют по основности (количество групп СООН) и атомности (количество групп ОН, включая группы ОН, входящие в карбоксильные группы).
21.1.1. Одноосновные, двухатомные:
г![]() ликолевая -гидроксипропионовая
молочная
ликолевая -гидроксипропионовая
молочная
гидроксиуксусная 3-гидроксипропановая -гидроксипропионовая
гидроксиэтановая 2-гидроксипропановая
![]() 21.1.2.
Двухосновная, трехатомная:
21.1.2.
Двухосновная, трехатомная:
яблочная
гидроксиянтарная
2-гидроксибутандиовая
![]() 21.1.3.
Двухосновная, четырехатомная:
21.1.3.
Двухосновная, четырехатомная:
винная
2,3-дигидроксибутандиовая
 21.1.2.
Трехосновная, четырехатомная:
21.1.2.
Трехосновная, четырехатомная:
лимонная, 3-гидрокси-3-карбоксипентадиовая кислота.
21.2. Методы получения.
21.2.1. Гидролиз галогензамещенных кислот
З![]() десь
всегда образуются рацематы.
десь
всегда образуются рацематы.
21.2.2. Циангидриновый синтез

21.2.3. Синтез -гидроксикислот по реакции Реформатского

21.3. Физические и химические свойства гидроксикислот.
Эти кислоты – жидкости и твердые вещества. Т.кип. их выше, чем одинаковых с ними по молекулярному весу монокарбоновых одноатомных кислот вследствие дополнительных водородных связей за счет гидроксильной группы. Все -гидроксикислоты, за исключением гликолевой, хиральны, т.е. имеют энантиомеры.
Гидроксикислоты имеют все свойства кислот и спиртов. Как кислоты могут образовывать галогенангидриды, эстеры, амиды, соли, как спирты – алкоголяты, этеры (простые эфиры), эстеры, галогенпроизводные и др. Могут реагировать обе группы одновременно, например:
R CH(OH)COOH
+ 2PCl5
RCHClCOCl
+ 2POCl3
+ 2HCl
CH(OH)COOH
+ 2PCl5
RCHClCOCl
+ 2POCl3
+ 2HCl
Гидролиз полученного хлорангидрида в шелочной или кислой среде приведет к образованию кислоты RCHClCOОН.
Чтобы провести синтез хлорангидрида -гидроксикарбоновой кислоты, нужно предварительно защитить гидрокисльную группу, провести реакцию, а затем снять защиту по схеме:
 Защита
ОН реакция снятие защиты
Защита
ОН реакция снятие защиты
21.3.1. Взаимное влияние функциональных групп.
Наибольшее влияние будет, если группы находятся в -положении, поэтому -гидроксикислоты при кипячении с разбавленной серной кислотой расщепляются:
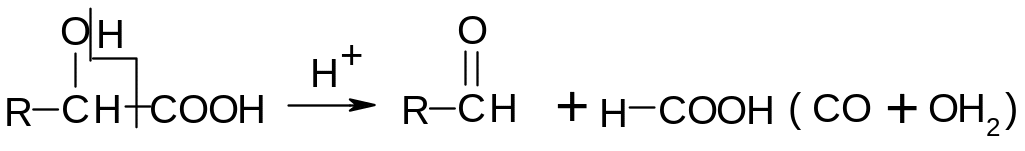 Муравьиная
кислота в этих условиях способна
расщепляться на СО и воду.
Муравьиная
кислота в этих условиях способна
расщепляться на СО и воду.
21.3.2. Реакции дегидратации гидроксикислот.
а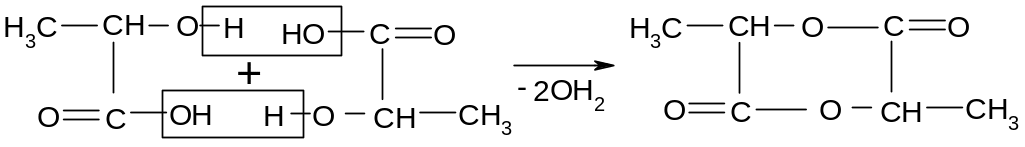 ).
-Гидроксикислоты
при нагревании в присутствии каталитических
количеств минеральных кислот образуются
циклические межмолекулярные сложные
эфиры – лактиды:
).
-Гидроксикислоты
при нагревании в присутствии каталитических
количеств минеральных кислот образуются
циклические межмолекулярные сложные
эфиры – лактиды:
лактид молочной кислпты
При кипячении лактида в слабокислом растворе идет его гидролиз, т.е. обратная реакция, до исходной кислоты.
б). -Гидроксикислоты при нагревании образуют ,-ненасыщенные кислоты:
в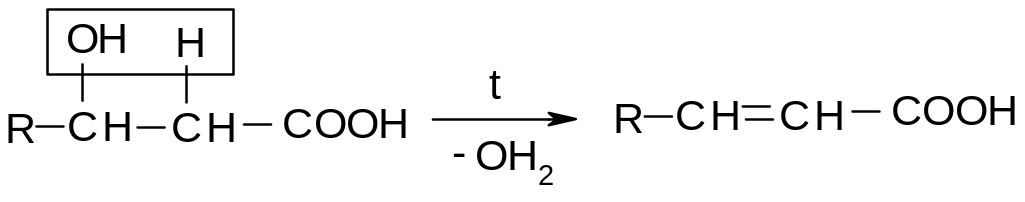 ).
и -Гидроксикислоты
при нагревании образуют лактоны
).
и -Гидроксикислоты
при нагревании образуют лактоны
 (внутримолекулярные
эфиры):
(внутримолекулярные
эфиры):
бутиролактон
г) -Гидроксикислоты при нагревании вступают в реакции поликонденсации с
образованием полиэфира (где m > 4):

21.3.3. Окисление гидроксикислот.
Окисление гликолевой кислоты до щавелевой уже рассматривалось. Окисление кислот со вторичной гидроксильной группой происходит с образованием кетокислот:

