
- •Часть 4. Гетерофункциональные соединения.
- •21.1. Строение и номенклатура.
- •21.2. Методы получения.
- •21.3. Физические и химические свойства гидроксикислот.
- •21.4. Стереоизомерия гидроксикислот.
- •21.5. Стереохимия реакций замещения и присоединения с участием
- •В случае фумаровой кислоты атака с разных сторон (50 на 50%) приводит к образованию рацемата:
- •2 1.6. Разделение рацематов.
- •22.1. Строение и номенклатура.
- •22.2. Методы получения.
- •22.3. Химические свойства.
- •23.1. Строение и номенклатура.
- •Методы получения.
- •23. 3. Свойства аминокислот.
- •24.1. Понятие о полипептидах и белках.
- •24.2. Классификация белков.
- •24.3. Структура белков.
- •Р исунок 24.1
- •24.4. Установление первичной структуры белков.
- •24.5. Синтез белков химическими методами.
- •25.1. Введение.
- •25.2. Моносахариды.
- •26.1. Химические свойства моносахаридов.
- •26.2. Брожение моносахаридов.
- •27.1. Олигосахариды или сахароподобные вещества.
- •27.2. Несахароподобные полисахариды.
- •С хема 27.2. Формула амилозы:
Методы получения.
Получение из продуктов гидролиза белков.
Микробиологический синтез
Ряд бактерий, выращиваемых на крахмале, патоке и др. питательных
средах, вырабатывает ряд аминокислот (лизин, триптофан, глутаминовую кислоту и др.), причем, всегда образуется один L-изомер, в отличие от химических методов, когда образуются рацематы.
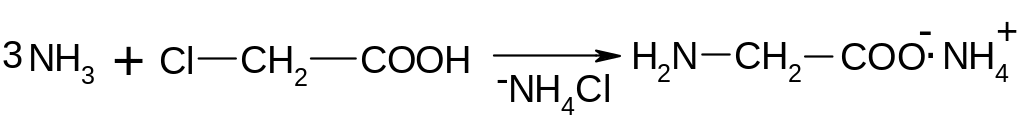
Получение из галогензамещенных кислот.
Образование из циангидринов.

Присоединение аммиака к ,-ненасыщенным кислотам.
Присоединение происходит вопреки правилу Марковникова:
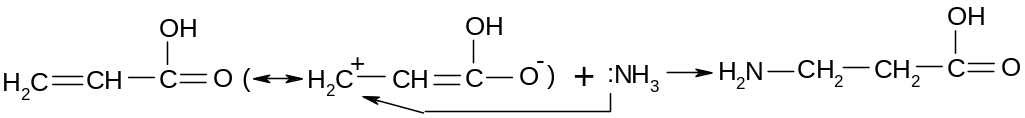
Получение из малоновой кислоты.
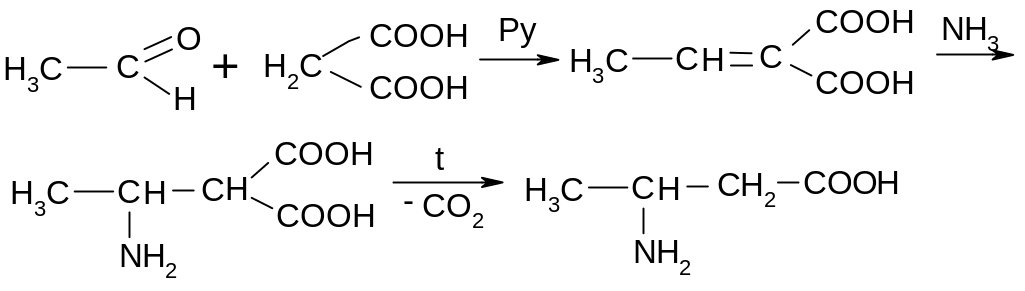 Сначала получают непредельную
кислоту по Кневенагелю, к ней присоединяют
аммиак, а полученный продукт
декарбоксилируют:
Сначала получают непредельную
кислоту по Кневенагелю, к ней присоединяют
аммиак, а полученный продукт
декарбоксилируют:
Получение из лактама.
П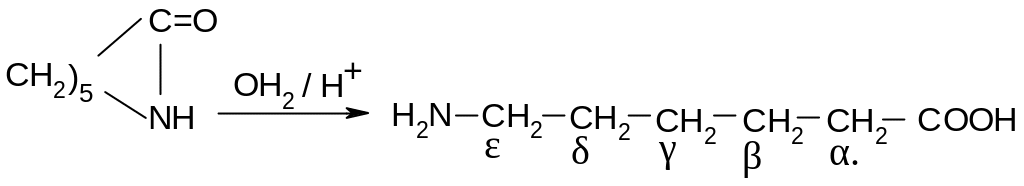 ри
гидролизе капролактама, получение
которого уже рассматривалось в лекции
№ 18 (перегруппировка Бекмана), образуется
-аминокапроновая
кислота:
ри
гидролизе капролактама, получение
которого уже рассматривалось в лекции
№ 18 (перегруппировка Бекмана), образуется
-аминокапроновая
кислота:
23. 3. Свойства аминокислот.
23. 3.1. Физические свойства.
Это кристаллические бесцветные вещества, L-аминокислоты имеют горький вкус, D – сладкий.
23. 3.2. Кислотно-основные свойства.
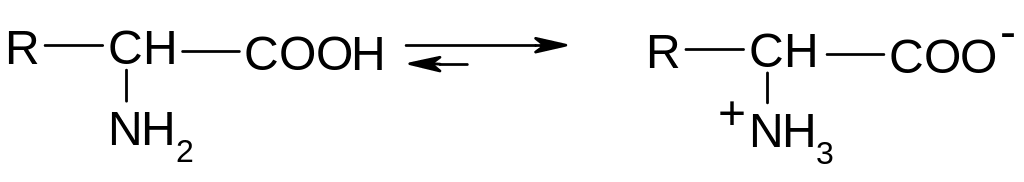 Поскольку
аминокислоты имеют и карбоксильную, и
аминную функции, они проявляют и
кислотные, и основные свойства, т.е. они
амфотерны, причем, эти функции
взаимодействуют и внутримолекулярно,
образуя биполярную, цвиттерионную
структуру:
Поскольку
аминокислоты имеют и карбоксильную, и
аминную функции, они проявляют и
кислотные, и основные свойства, т.е. они
амфотерны, причем, эти функции
взаимодействуют и внутримолекулярно,
образуя биполярную, цвиттерионную
структуру:
В водном растворе равновесие сдвинуто в сторону внутренней соли, в твердом состоянии эти вещества кристаллические, поскольку находятся только в цвиттер-ионной форме. Они взаимодействуют и с кислотами, и с основаниями:
 H3NCHRCOO
+ HCl ClH3NCHRCOOН
(катионная форма, хло-
H3NCHRCOO
+ HCl ClH3NCHRCOOН
(катионная форма, хло-
ристоводородная соль)
H 3N CHRCOO + NaOH H2NCHRCOONa (анионная форма, натри-
-Н2О евая соль)
Таким образом, форма аминокислоты в растворе зависит от рН (lg[H] ):
+ H2O(-НО) + H
H


 2NCHRCOO
H3N
CHRCOO
H3N
CHRCOOH
2NCHRCOO
H3N
CHRCOO
H3N
CHRCOOH
+HO(-Н2О)
Щелочная среда нейтральная среда кислая среда
рН 7 рН 5
То значение рН, при котором аминокислота находится в цвиттерионной форме, называется изоэлектрической точкой, она различна для разных кислот.
Аминокислоты проявляют все свойства кислот и аминов.
23. 3.3. Реакции по аминогруппе.
23. 3.3.1. Алкилирование.
NH3 CH3I(NH3)
H
 2NCH2COOH
+ CH3I
CH3NHCH2COOH
2NCH2COOH
+ CH3I
CH3NHCH2COOH
NH4I NH4I
CH3I(NH3)
( CH3)2NCH2COOH (CH3)3NCH2COO (бетаин)
NH4I
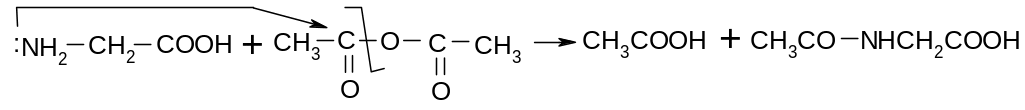 23.
3.3.2. Ацилирование.
23.
3.3.2. Ацилирование.
N-ацетилглицин
23. 3.3.3. Действие азотистой кислоты.
H
 ON=O
+ H2
NCH2COOH H2O
+ N2
+ HOCH2COOH
ON=O
+ H2
NCH2COOH H2O
+ N2
+ HOCH2COOH
23. 3.4. Реакции карбоксильной группы.
23. 3.4.1. Образование галогенангидридов.
РCl5
H 2NCH2COOH Cl NH3CH2COCl
- POCl3
23. 3.4.2. Реакции эстерификации.
В присутствии НCl cо спиртами идут реакции эстерификации:
H 2NCH2CO OH + Н ОR + HCl Cl∙NH3CH2COOR + H2O
При обработке содой выделяются свободные эфиры, которые устойчивы и подвергаются перегоне, что и используется для разделения аминокислот из гидролизата белков, предварительно подвергнутого эстерификации.
23. 3.4.3. Реакции декарбоксилирования.
Аминокислоты можно декарбоксилировать только при нагревании со щелочами:
H
 2NCHRCOONa
+ NaO H Na2CO3
+ RCH2NH2
2NCHRCOONa
+ NaO H Na2CO3
+ RCH2NH2
Однако в организме под воздействием ферментов в нормальных условиях – это обычная реакция.
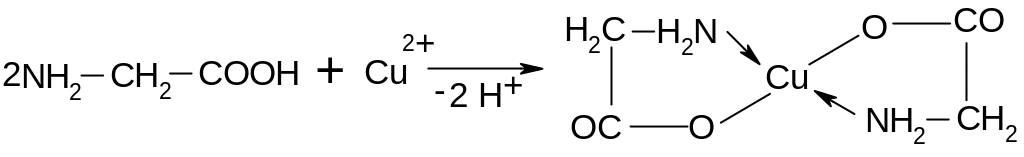 23.
3.5. Образование комплексных солей с
тяжелыми металлами.
23.
3.5. Образование комплексных солей с
тяжелыми металлами.
Такие комплексы окрашены и их используют для выделения природных -аминокислот.
23. 3.6. Отношение аминокислот к нагреванию.
По строению продуктов можно судить о положении аминогруппы в кислоте.
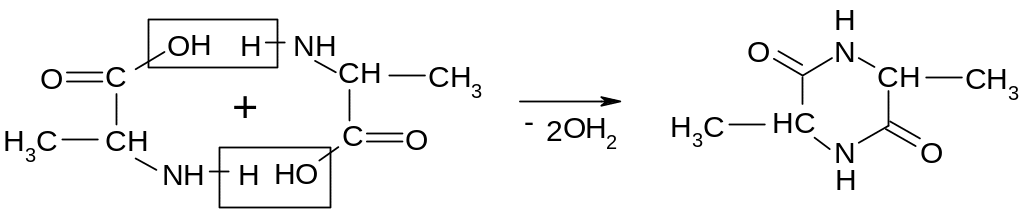 23.
3.6.1. Дегидратация -аминокислот.
23.
3.6.1. Дегидратация -аминокислот.
При нагревании -аминокислоты образуют дикетопиперазины:
2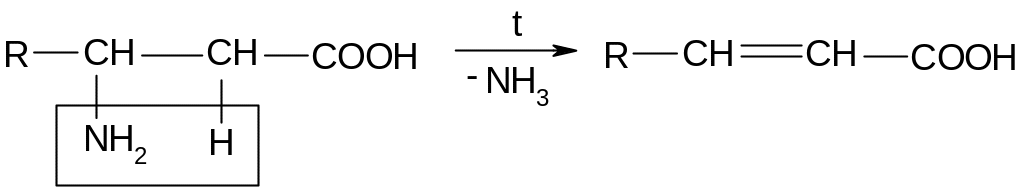 3.
3.6.2. Дезаминирование -аминокислот.
3.
3.6.2. Дезаминирование -аминокислот.
2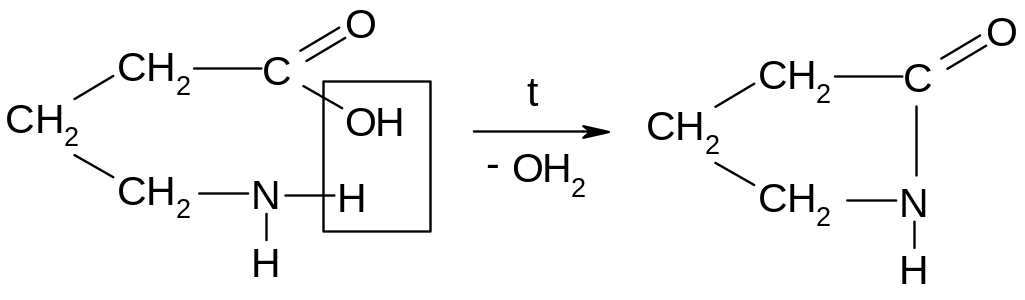 3.
3.6.3. Дегидратация -
и -аминокислот.
3.
3.6.3. Дегидратация -
и -аминокислот.
Бутиролактам
Из -аминовалериановой кислоты образуется валеролактам.
23. 3.6.4. Дегидратация -аминокислот.
Аминокислоты, в которых функциональные группы разделены более чем четырьма группами СН2 , при нагревании образуют высокомолекулярные полиамиды. Например:
 Капрон
Капрон
23.3.7. Характерные реакции на аминокислоты
 На
-аминокислоты
есть несколько характерных реакций –
одна из них на нингидрин:
На
-аминокислоты
есть несколько характерных реакций –
одна из них на нингидрин:
В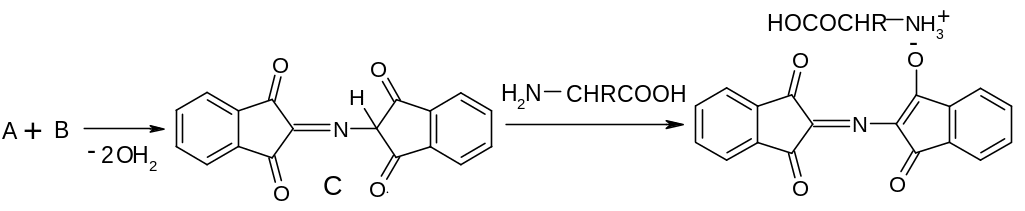 заимодествие
веществ А и В приводит к образованию
вещества С, которое, взаимодействуя со
свободной аминогруппой аминокислоты,
образует окрашенную в синий цвет соль
енольной формы вещества С:
заимодествие
веществ А и В приводит к образованию
вещества С, которое, взаимодействуя со
свободной аминогруппой аминокислоты,
образует окрашенную в синий цвет соль
енольной формы вещества С:
Эта реакция используется для проявления хроматограмм, а также для колориметрического определения аминокислот (кроме пролина и оксипролина). Реакция чувствительна на очень небольшие количества аминокислот.
Лекция № 24.
ПОЛИПЕПТИДЫ И БЕЛКИ.
