
- •1.1.Предмет органической химии в историческом аспекте.
- •1.2. Теория химического строения
- •1.4. Природа химической связи.
- •1.4.2. Ковалентная связь.
- •1.4.2. Ионная связь.
- •1.4.3. Водородная связь.
- •2.1.Образование связей с участием углерода.
- •2.2. Основные характеристики ковалентной связи.
- •2.3. Электронные эффекты строения.
- •3.1. Классификация органических соединений
- •3.2. Номенклатура органических соединений
- •3.2.1. Тривиальная номенклатура
- •3.2.2. Рациональная номенклатура
- •3.2.3. Систематическая номенклатура
- •3.2.3.1. Заместительная номенклатура июпак
- •Последовательность составления названия.
- •3.2.3.2. Радикально-функциональная номенклатура июпак
- •4.1. Понятийный аппарат в стереоизомерии.
- •4.2. Конформационная изомерия.
- •4.3. Элементы симметрии.
- •4.4. Энантиомерия или зеркальная изомерия.
- •4.5. Наблюдение оптической активности.
- •4.6. Изображение структуры стереоизомеров на плоскости.
- •4.7. Рацематы.
- •4.8. Конфигурация и знак вращения.
- •4.9. Стереоизомерия веществ с несколькими асимметричными центрами.
- •4.10. Обозначение абсолютной конфигурации молекул.
- •4.11. Причины хиральности молекулы.
- •4.12. Геометрическая изомерия (-диастереомерия).
- •5.1. Понятие о механизме реакции.
- •5.2. Реакционная способность, субстраты и реагенты.
- •5.3. Классификация органических реакций.
- •5.4. Номенклатура органических реакций.
- •5.5. Примеры механизмов реакций.
- •5.6. Селективность (избирательность) химических реакций.
1.4.3. Водородная связь.
Водородная связь возникает вследствие минимум двух причин:
а) электростатического взаимодействия электроположительным атомом водорода и электроотрицательными атомами O, N, S и др. (диполь-дипольное взаимодействие);
б) донорно-акцепторное взаимодействие водорода (акцептор) и указанными выше атомами, имеющими неподеленную электронную пару (доноры)
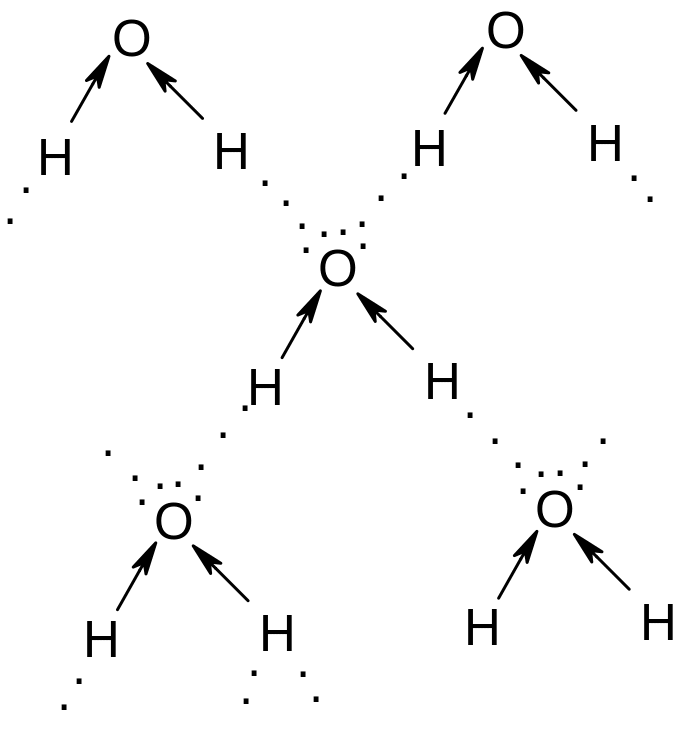 Водородная связь наблюдается между
молекулами воды, спиртов, фенолов,
карбоновых кислот, первичных и вторичных
аминов. Вода образует ассоциативные
связи:
Водородная связь наблюдается между
молекулами воды, спиртов, фенолов,
карбоновых кислот, первичных и вторичных
аминов. Вода образует ассоциативные
связи:
Энергия водородной связи небольшая (примерно в 20 раз меньше энергии ковалентной -связи), однако, благодаря ей образуются межмолекулярные ассоциаты, существенно повышающие температуры кипения и плавления. Так, вода в соответствии со своим молекулярным весом должна быть газообразным веществом с т.кип. – 80оС (а не + 100) и т.пл. – 100 оС ( а не 0 оС ).
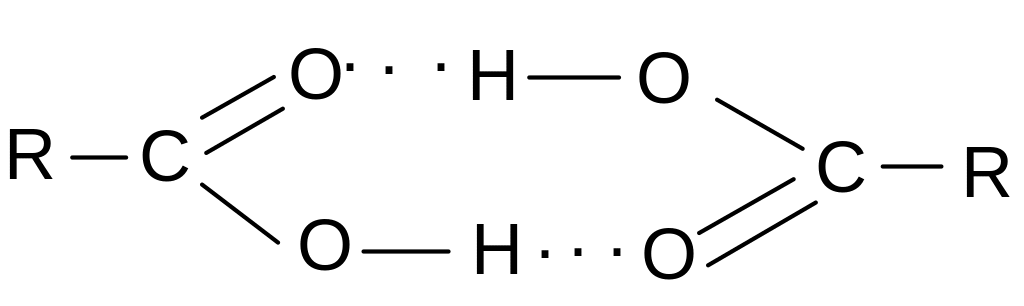 Аналогичные ассоциаты образуются для
всех перечисленных выше веществ. Для
карбоновых кислот образуются циклические
димеры:
Аналогичные ассоциаты образуются для
всех перечисленных выше веществ. Для
карбоновых кислот образуются циклические
димеры:
Водородные связи могут быть межмолекулярными (вышеперечисленные случаи), так и внутримолекулярные, например, в случае енольной формы ацетилацетона:
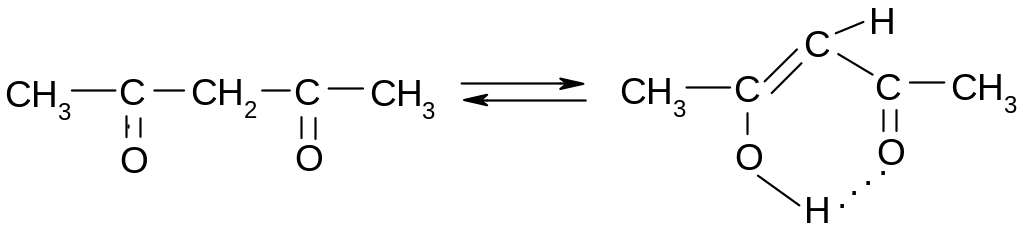
Внутримолекулярные связи прочнее межмолекулярных и обеспечивают дополнительную стабилизацию енольной формы, сдвигая равновесие вправо.
Водородные связи играют важную роль в биологических системах: определяют необходимую для жизни конформацию белка и по сути дела несут и обеспечивают передачу генетической информации, записанной в РНК и ДНК.
Лекция № 2. КВАНТОВО-ХИМИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКОЙ СВЯЗИ.
2.1.Образование связей с участием углерода.
2.1.1. Состояние электрона.
Состояние электрона описывается четырьмя квантовыми числами:
n – главное квантовое число, которое принимает значение ряда целых чисел от 1 до N, равного номеру периода, в котором находится элемент, определяет номер электронного слоя, в котором находится рассматриваемый электрон, а также расстояние электрона от ядра.
l – побочное квантовое число, характеризующее форму электронной орбитали (ограниченное определенным объемом пространство, в котором локализован рассматриваемый электрон), принимает ряд значений от 0 до n – 1.
m – магнитное квантовое число, характеризующее ориентацию орбитали по отношению в векторам внешних магнитных полей, создаваемых электронами на соседних орбиталях (т.е. ориентацию одних орбиталей по отношению к другим) и принимающее значения от – l до + l через единицу.
s – спиновое квантовое число электрона, связанное с его вращением вокруг собственной оси, принимает значения – 1/2 и + 1/2.
Распределение орбиталей по слоям, типам и ориентации для элементов 1-го – 4-го периодов периодической системы представлено в табл. 2.1.
Табл. 2.1. Распределение орбиталей по слоям, типам и ориентации
n, число слоев, номер слоя |
l |
m |
Тип орбитали |
Число орби-талей |
Макс.число электронов на орбиталях |
Макс.число электронов в слое |
1 |
0 |
0 |
1s |
1 |
2 |
2 |
2 |
0 1 |
0 -1, 0, +1 |
2s 2p |
1 3 |
2 6 |
8 |
3 |
0 1 2 |
0 -1, 0, +1 -2, -1, 0, +1,+2 |
3s 3p 3d |
1 3 5 |
2 6 10 |
18 |
4 |
0 1 2 3 |
0 -1, 0, +1 -2, -1, 0, +1,+2 -3, -2, -1, 0, +1,+2,+3 |
4s 4p 4d 4f |
1 3 5 7 |
2 6 10 14 |
32 |
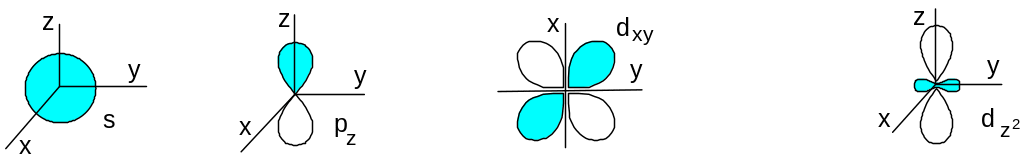
Форма орбиталей:
s – орбиталь px py pz – орбитали dxy, dxz, dyz, - орбитали.
Распределение орбиталей по расположению уровня энергии:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f< . . .
Заполнение орбиталей происходит по трем правилам:
Правило Хунда: при заполнении орбиталей с одинаковой энергией на каждой из них размещается по 1 электрону с параллельными спинами, и только после этого орбитали начинают заполняться электронами с противоположными спинами;
Принцип Паули: на каждой орбитали может находиться только два электрона с противоположными спинами;
Правило Клечковского: Каждая новая орбиталь заполняется только после того, как будут заполнены все предыдущие орбитали с более низкой энергией.
Концепция гибридизации атомных орбиталей.
Опыт показывает, что в молекуле метана СН4 все 4 связи (т.е. 4 атома Н) эквивалентны, что не согласуется с наличием у атома углерода в валентном слое двух разных по энергии типов орбиталей (s и p). Чтобы устранить это противоречие, Полинг и Слейтер (1927 - 1934 г.г.) предложили концепцию гибридизации атомных орбиталей – при образовании метана СН4 происходит sp3-гибридизация (смешение):
О сновное
состояние возбужденное гибридное
состояние
сновное
состояние возбужденное гибридное
состояние
состояние sp3
Запись другим способом:
1(2s) + 3(2р) 4(2sp3), где цифра перед скобками означает количество орбиталей, цифра в скобках – номер электронного слоя.
![]() При
гибридизации происходит изменение
формы орбиталей:
При
гибридизации происходит изменение
формы орбиталей:
Все четыре sp3 орбитали в метане эквивалентны и направлены от атома С к вершинам симметричного тетраэдра, тогда как в этане фактически два тетраэдра связаны между собой вершинами, причем, при осевом перекрывании гибридных орбиталей, образующих С-С связь, один тетраэдр (одна группа СН3) легко вращается относительно другого:
4 С-Н связи
(осевое 6 С-Н
связей и 1С-С
связь (осевое
С-Н связи
(осевое 6 С-Н
связей и 1С-С
связь (осевое
перекрывание) в метане перекрывание) в этане.
У атома углерода возможны еще два типа гибридизации при образовании двойных (sp2) и тройных (sp)связей.
В sp2 гибридизации при образовании этилена участвуют орбитали валентного (2-го) электронного слоя: 1(2s) + 2(2р) 3(2sp2) . Чтобы быть максимально удаленными друг от друга, эти три орбитали должны размещаться в одной плоскости под углом 120 о:
В молекуле этилена два типа связей С–С:
-связь образуется
при осевом перекрывании sp2-гибридных
орбиталей, -связь
– при боковом перекрывании негибридизованных
(по одной на каждом углероде) р-орбиталей.
Молекула этилена плоская, а -связь
в ней менее прочна, чем -связь,
ибо боковое перекрывание менее эффективно,
чем осевое перекрывание при образовании
-связи.
молекуле этилена два типа связей С–С:
-связь образуется
при осевом перекрывании sp2-гибридных
орбиталей, -связь
– при боковом перекрывании негибридизованных
(по одной на каждом углероде) р-орбиталей.
Молекула этилена плоская, а -связь
в ней менее прочна, чем -связь,
ибо боковое перекрывание менее эффективно,
чем осевое перекрывание при образовании
-связи.
При sp гибридизации в случае образования ацетилена также участвуют орбитали 2-го валентного электронного слоя атома углерода:
1(2s) + 1(2p) 2(2sp).
C троение
ацетилена:
троение
ацетилена:
Чтобы быть максимально удаленными друг от друга, 2 sp-орбитали атома углерода в ацетилене должны размещаться на одной прямой линии под углом 180 о. Оставшиеся 2 негибридизованные р-орбитали размещаются
перпендикулярно этой линии и между собой, вследствие чего молекула ацетилена является линейной (все 4 атома, 2С и 2Н, лежат на одной прямой), причем, между атомами углерода имеется 1 и 2 СС связи.
Необходимо подчеркнуть, что образование ковалентной связи всегда приводит к уменьшению энергии системы, т.е. молекула устойчивее, чем отдельные атомы или группы атомов.
