
- •1.1.Предмет органической химии в историческом аспекте.
- •1.2. Теория химического строения
- •1.4. Природа химической связи.
- •1.4.2. Ковалентная связь.
- •1.4.2. Ионная связь.
- •1.4.3. Водородная связь.
- •2.1.Образование связей с участием углерода.
- •2.2. Основные характеристики ковалентной связи.
- •2.3. Электронные эффекты строения.
- •3.1. Классификация органических соединений
- •3.2. Номенклатура органических соединений
- •3.2.1. Тривиальная номенклатура
- •3.2.2. Рациональная номенклатура
- •3.2.3. Систематическая номенклатура
- •3.2.3.1. Заместительная номенклатура июпак
- •Последовательность составления названия.
- •3.2.3.2. Радикально-функциональная номенклатура июпак
- •4.1. Понятийный аппарат в стереоизомерии.
- •4.2. Конформационная изомерия.
- •4.3. Элементы симметрии.
- •4.4. Энантиомерия или зеркальная изомерия.
- •4.5. Наблюдение оптической активности.
- •4.6. Изображение структуры стереоизомеров на плоскости.
- •4.7. Рацематы.
- •4.8. Конфигурация и знак вращения.
- •4.9. Стереоизомерия веществ с несколькими асимметричными центрами.
- •4.10. Обозначение абсолютной конфигурации молекул.
- •4.11. Причины хиральности молекулы.
- •4.12. Геометрическая изомерия (-диастереомерия).
- •5.1. Понятие о механизме реакции.
- •5.2. Реакционная способность, субстраты и реагенты.
- •5.3. Классификация органических реакций.
- •5.4. Номенклатура органических реакций.
- •5.5. Примеры механизмов реакций.
- •5.6. Селективность (избирательность) химических реакций.
1.4. Природа химической связи.
Причина химической связи одна – взаимодействие ядер и электронов. Однако, хотя и условно, можно выделить 5 типов связи: ионная, ковалентная, водородная, металлическая и дисперсионное (вандерваальсово) взаимодействие. Для органической химии наиболее важными являются первые три.
1.4.2. Ковалентная связь.

 При образовании любой связи (ионной
или ковалентной) всегда образуется
октетная электронная оболочка вокруг
атомов, образующих эту связь в соответствии
с октетной теорией Льюиса (1916 г.).
Исключение составляет водород, вокруг
которого в таком случае образуется 2-х
электронная (как у гелия) оболочка. Таким
образом, образуются электронные оболочки,
характерные для инертных газов. Пример:
При образовании любой связи (ионной
или ковалентной) всегда образуется
октетная электронная оболочка вокруг
атомов, образующих эту связь в соответствии
с октетной теорией Льюиса (1916 г.).
Исключение составляет водород, вокруг
которого в таком случае образуется 2-х
электронная (как у гелия) оболочка. Таким
образом, образуются электронные оболочки,
характерные для инертных газов. Пример:
Заменив пары электронов на черточки, изображающие связь, получаем привычную формулу метана, приведенную выше в разделе 1.3.2.
Неполярная ковалентная связь с симметричным распределением электронов между связываемыми атомами характерна для углеводородов с 2-мя одинаковыми атомами, например, связь С-С в этане. Полярной ковалентная связь становится, если связываемые ею атомы различаются по электроотрицательности.
По своей электроотрицательности элементы располагаются в ряд (по Полингу):
Н Li B C N O F Cl
2,1 1 2 2,5 3 3,5 4 3,0
В следствие
большей электроотрицательности углерода
по сравнению с водородом в метане, этане
и любом другом углеводороде электроны
связей слегка оттянуты к углероду,
который слегка (частично) заряжен
отрицательно, а водород положительно.
Дипольные моменты (le, где l – расстояние
между зарядами, е – величина заряда) и
метана и этана равны 0 (молекулы неполярны),
ибо указанные выше сдвиги электронов
вследствие тетраэдрического расположения
связей у атома углерода взаимно
компенсируются (суммарный вектор сдвигов
равен 0). Пример полярной ковалентной
молекулы: Н3С
Cl (как
и в НCl в газовой фазе). Дипольный момент
здесь не равен 0, молекула полярна.
следствие
большей электроотрицательности углерода
по сравнению с водородом в метане, этане
и любом другом углеводороде электроны
связей слегка оттянуты к углероду,
который слегка (частично) заряжен
отрицательно, а водород положительно.
Дипольные моменты (le, где l – расстояние
между зарядами, е – величина заряда) и
метана и этана равны 0 (молекулы неполярны),
ибо указанные выше сдвиги электронов
вследствие тетраэдрического расположения
связей у атома углерода взаимно
компенсируются (суммарный вектор сдвигов
равен 0). Пример полярной ковалентной
молекулы: Н3С
Cl (как
и в НCl в газовой фазе). Дипольный момент
здесь не равен 0, молекула полярна.
Октетные формулы Льюиса дают возможность изобразить структурные формулы многих органических соединений:
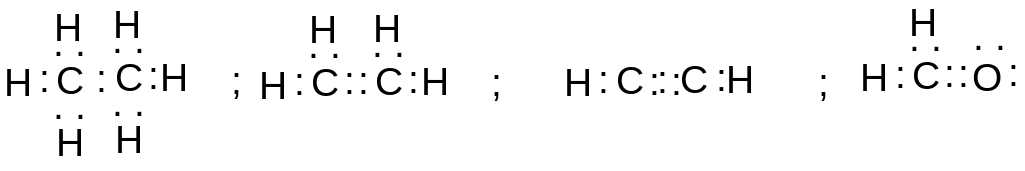
 Этан этилен ацетилен
формальдегид
Этан этилен ацетилен
формальдегид
Эти же формулы в привычной форме:
1.4.2. Ионная связь.
В органических молекулах доминируют ковалентные связи, тогда как ионные связи встречаются намного реже, например, в солях органических соединений. В качестве такой соли можно привести хлористый триметиламмоний (СН3)3NH+Cl, где хлорид-анион и катион триметиламмония удерживаются друг возле друга за счет электростатического притяжения. Точка между катионом и анионом указывает, что между ними нет локализованной в пространстве связи, т.е. хлорид-анион не связан ни с одним из атомов катиона.
Эта же молекула является примером донорно-акцепторной связи, которая хотя и является ковалентной (связь NH), но обеспечивает существование катиона. Молекула НCl в газовой фазе имеет ковалентную, но сильно полярную связь, где электроны оттянуты к сильно электроотрицательному хлору. В любой фазе, в том числе и газовой от НCl отщепляется протон, присоединяясь к триметиламину и одновременно освобождая хлорид-анион:
 (СН3)3N: + НCl
(СН3)3N+:HCl
(СН3)3N: + НCl
(СН3)3N+:HCl
Между протоном и азотом образуется донорно-акцепторная связь: азот отдает в общую ковалентную связь пару свободных электронов (донор), а пустая орбиталь протона их принимает (акцептор).

 В ряде случаев при образовании
донорно-акцепторной связи происходит
распределение электронной плотности,
вследствие чего на атомах возникают
формальные заряды:
В ряде случаев при образовании
донорно-акцепторной связи происходит
распределение электронной плотности,
вследствие чего на атомах возникают
формальные заряды:
В привычном изображении:
 (СН3)3N
O или (СН3)3N+
O .
(СН3)3N
O или (СН3)3N+
O .
донор акцептор
Донорно-акцепторная связь в N-оксиде амина является семиполярной (полуполярной). Диссоциировать на ионы соединение не может, ибо между заряженными атомами наличествует прочная ковалентная связь, усиленная ионной. Семиполярные связи характерны для сульфоксидов и нитроалканов:
 Донорно-акцепторная
связь распространена в металлоорганических
комплексных соединениях, которые еще
называют координационными. Например,
растворимость и устойчивость реактивов
Гриньяра в этиловом эфире (без эфира
они самовозгораются на воздухе)
объясняется образованием комплекса с
донорно-акцепторными связями (эфир –
донор, атом Mg – акцептор):
Донорно-акцепторная
связь распространена в металлоорганических
комплексных соединениях, которые еще
называют координационными. Например,
растворимость и устойчивость реактивов
Гриньяра в этиловом эфире (без эфира
они самовозгораются на воздухе)
объясняется образованием комплекса с
донорно-акцепторными связями (эфир –
донор, атом Mg – акцептор):
 R Cl
R Cl
2

 (С2Н5)2О
+ СlMgR
(С2Н5)2О Mg
O(С2Н5)2 .
(С2Н5)2О
+ СlMgR
(С2Н5)2О Mg
O(С2Н5)2 .
 Существуют многочисленные комплексные
(клешневидные) соединения металлов
(гликоляты, глицераты, ацетилацетонаты),
природные пигменты (гемин, хлорофилл и
др.), имеющие координационную связь и
играющие важную роль в химических и
биохимических процессах. Гликолят меди:
Существуют многочисленные комплексные
(клешневидные) соединения металлов
(гликоляты, глицераты, ацетилацетонаты),
природные пигменты (гемин, хлорофилл и
др.), имеющие координационную связь и
играющие важную роль в химических и
биохимических процессах. Гликолят меди:
